Лабораторна робота № 4
Гідроліз солей
4.1 Мета:
провести гидроліз деяких солей, дослідити вплив складу солей і зовнішніх умов на повноту їх гідролізу
4.2 Короткі теоретичні відомості
У водних розчинах солі повністю дисоціюють на катіони і аніони. Крім них, в розчині є йони H3О+ і ОН–, що утворюються внаслідок дисоціації молекул води. Якщо під час взаємодії цих йонів з йонами солі утворюються сполуки, що погано дисоціюють (слабкі електроліти: слабкі кислоти і основи), то відбувається гідроліз солі, тобто розкладання солі водою з утворенням слабкого електроліту.
Гідроліз є результатом поляризаційної взаємодії йонів з їх гідратною оболонкою. Чим сильнішою є поляризаційна дія йонів і чим більшою є їх поляризованість, тим глибше відбувається гідроліз. Сильну поляризуючу дію здатні чинити невеликі за розмірами багатозарядні йони, як правило, це катіони слабких основ. А сильною поляризованістю характеризуються великі за розмірами аніони – кислотні залишки слабких кислот.
В результаті гідролізу зміщується рівновага електролітичної дисоціації води, що призводить до зміни рH середовища, яке можна визначити за допомогою індикаторів.
Наприклад, в результаті розчинення ацетату натрію середовище стає лужним завдяки наступним процесам:
CH3COONa  Na+ + CH3COO–
Na+ + CH3COO–
CH3COO–+ HOH  CH3COOH + OH–
CH3COOH + OH–
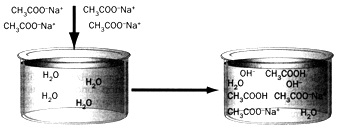
Зміна водневого показника рH під час розчинення солі у воді є основною ознакою гідролізу.
Можливість і характер гідролізу визначається природою кислоти і основи, якими утворена сіль.
1. Солі, утворені сильними основами (лугами) і сильними кислотами, не піддаються гідролізу. Розчини таких солей (NaCl, KNO3, Ва(NO3)2 та ін.) мають нейтральне середовище (рH ≈ 7).
2. Солі, утворені сильними основами і слабкими кислотами, гідролізуються за аніоном, оскільки аніон утворює з йонами гідроксонію Н3О+ слабку кислоту. Середовище розчину в цьому випадку є лужним (рН > 7) :
КСN  K+ + CN–
K+ + CN–
CN–+ HOH 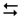 HCN + OH–
HCN + OH–
Солі цього типу, утворені багатоосновними кислотами, гідролізуються ступінчасто, наприклад:
К2СО3 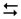 К+ +СО32–
К+ +СО32–
1-й ступінь: СО32– + НОН 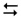 НСО3–+ ОН–
НСО3–+ ОН–
2-й ступінь: НСО3–+ НОН 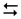 Н2СО3 + ОН–,
Н2СО3 + ОН–,
причому гідроліз відбувається в основному за першим ступенем.
3. Солі, утворені слабкими основами і сильними кислотами, гідролізуються за катіоном, оскільки катіон утворює з гідроксид-йонами слабку основу. Середовище розчину в цьому випадку є кислим (рН < 7).
NH4Cl 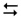 NH4+ + Cl–
NH4+ + Cl–
NH4+ + 2HOH 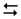 NH3•Н2О + H3О+
NH3•Н2О + H3О+
Солі такого типу, але утворені багатокислотними основами, гідролізуються ступінчасто, наприклад:
ZnCl2 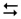 Zn2+ + 2Cl–
Zn2+ + 2Cl–
у водному розчині Zn2+
Zn2+ +4HOH 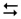 [Zn(Н2О)4]2+
[Zn(Н2О)4]2+
1-й ступінь: [Zn(Н2О)4]2+ + HOH 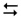 [Zn(Н2О)3(ОН)]+ + H3О+
[Zn(Н2О)3(ОН)]+ + H3О+
2-й ступінь: [Zn(Н2О)3(ОН)]+ + НОН 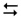 [Zn(Н2О)2(ОН)2] + H3О+
[Zn(Н2О)2(ОН)2] + H3О+
причому гідроліз відбувається в основному за першим ступенем.
4. Солі, утворені слабкими основами і слабкими кислотами, гідролізуються і за катіоном і за аніоном, наприклад:
NH4CN 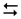 NH4+ + CN–
NH4+ + CN–
гідроліз за катіоном: NH4+ + 2HOH 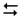 NH3•Н2О + H3О+
NH3•Н2О + H3О+
гідроліз за аніоном: CN–+ HOH 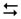 HCN + OH–
HCN + OH–
сумарна реакція гідролізу: H3О+ + OH– 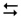 2Н2О
2Н2О
В даному випадку рН середовища залежить від сили слабких кислот, що утворюються, і основ (зазвичай рН дорівнює 6 – 8). Такі солі гідролізуються в більшій мірі, ніж розглянуті в п.п. 2 і 3. Гідроліз таких солей відбувається практично безповоротно, якщо виділяється газ або осад або якщо те і інше утворюється одночасно, наприклад:
Al2S3 + 3H2O = 2Al(OH)3↓ + 3H2S↑
4.3 Експериментальна частина
Реактиви. Розчини солей: КСl, Al2(SO4)3, Na3PO4, КNO3, Na2CO3 (1). Кристалічний FeSO4 і розчин FeCl3 (2). Розчини Na2SO3 и Na2CO3 (3). Розчини FeCl3, дистильована вода (4). Розчин Al2(SO4)3, Na2CO3 Na2S (5).
Посуд і прилади. Пробірки, паперові смужки універсального індикатору, шпатель, скляна паличка, спиртівка або сухий спирт, пробіркотримач, сірники.
4.3.1 Визначення середовища розчинів різних солей
На смужку універсального індикаторного паперу нанести по одній краплі розчинів КСl, Al2(SO4)3, Na3PO4, КNO3, Na2CO3. У якому випадку відбувається гідроліз? Визначити рН розчинів, результати досліду оформити у вигляді таблиці :
Таблиця 4.1 – Середовище розчинів різних солей
|
№ |
Формула солі |
Колір індикатора |
рН |
Середовище |
Рівняння гідролізу в молекулярному та йонному вигляді |
|
1 |
KCl |
|
|
|
|
|
2 |
Al(SO4)3 |
|
|
|
|
|
3 |
Na3PO4 |
|
|
|
|
|
4 |
КNO3 |
|
|
|
|
|
5 |
Na2CO3 |
|
|
|
|
4.3.2 Вивчення впливу заряду катіона на повноту гідролізу за катіоном
Один мікрошпатель сульфату заліза(II) розчинити в 10-15 краплях води. За допомогою універсального індикаторного паперу визначити рН розчину і порівняти одержані значення рН для розчинів FeSO4 і FeCl3 (розчин цієї солі є в штативі). Яка з двох солей гідролізується краще і чому? Написати молекулярні і йонні рівняння гідролізу цих солей за першим ступенем.
4.3.3 Порівняння гідролізу за аніоном
За допомогою універсального індикаторного паперу визначити рН розчинів Na2SO3 і Na2CO3 та порівняти їх значення. У звіті написати молекулярні і йонно-молекулярні рівняння гідролізу. За величиною рН вказати, в якому з двох розчинів є більшим (-шою): а) ступінь гідролізу; б) концентрація ОН–-йонів. Який аніон має більшу поляризованість?
4.3.4 Вивчення впливу умов проведення гідролізу на його повноту
Вплив концентрації. У пробірку помістити 2 – 3 краплі концентрованого розчину хлориду феруму(III) і за допомогою індикаторного паперу визначити його рН. Розчин в пробірці розбавити водою, збільшивши об’єм в 3 – 4 рази і визначити рН розбавленого розчину. Написати рівняння гідролізу за першим і другим ступенем в молекулярному і йонному вигляді. Зробити висновок про вплив концентрації солі на повноту її гідролізу.
Вплив температури. У пробірку на 1/3 її об’єму налити розчин хлориду феруму(III) і прокип’ятити його декілька хвилин на спиртівці. Що спостерігається? Чому розчин внаслідок кип’ятіння стає каламутним?
У звіті описати дослід і записати рівняння гідролізу в молекулярному і йонному вигляді за усіма ступенями, маючи на увазі, що другий і третій ступінь гідролізу можливі за нагрівання.
За результатами досліду 4.3.4 зробити загальний висновок про вплив концентрації розчину солі і температури на повноту гідролізу солей.
4.3.5 Взаємне посилення гідролізу двох солей
До 5 – 6 крапель розчину сульфату алюмінію додати такий же об’єм розчину карбонату натрію. Спостерігати утворення осаду гідроксиду алюмінію і виділення бульбашок вуглекислого газу. Повторити дослід в іншій пробірці з використанням сульфату алюмінію і сульфіду натрію. Визначити за запахом, який газ виділяється.
У звіті описати дослід. Написати рівняння реакцій в молекулярному і йонному вигляді і пояснити, чому в реакціях утворюються не карбонат алюмінію (у першій пробірці) і не сульфід алюмінію (у другій пробірці), а гідроксид алюмінію (у обох пробірках). Навести ще два-три приклади взаємного посилення гідролізу двох солей.
4.4 Контрольні питання та завдання
1. Наведіть приклади розчинних у воді солей, середовище розчинів яких є нейтральним, кислим, лужним. Напишіть рівняння їх гідролізу в йонному вигляді.
2. Наведіть приклади солей, гідроліз яких відбувається: а) тільки за катіоном; б) тільки за аніоном; в) за катіоном і за аніоном одночасно. Напишіть рівняння їх гідролізу в йонному вигляді.
3. Наведіть приклади солей, гідроліз яких можливий: а) за одним; б) за двома; в) за трьома ступенями. Напишіть рівняння їх гідролізу в йонному вигляді.
4. Напишіть в йонному вигляді рівняння спільного гідролізу : а) сульфату хрому(III) і карбонату натрію і б) нітрату алюмінію і сульфіду калію.
5. Як впливає додавання розчинів КОН, ZnCl2, Na2S, соляної кислоти і твердого NaCl на гідроліз карбонату калію (гідроліз посилюється, послаблюється, впливу не спостерігається).
6. Як впливає додавання розчинів NaОН, Na2CO3, Al2(SO4)3, сірчаної кислоти і твердого K2SO4 на гідроліз хлориду цинку (гідроліз посилюється, послаблюється, впливу не спостерігається).
7. Напишіть в йонному вигляді рівняння трьох ступенів гідролізу хлориду феруму(III). Поясніть, чому за кімнатної температури гідроліз відбувається тільки за першим ступенем, а внаслідок кип’ятіння розчину – за всіма трьома.