Лабораторна робота № 5
Швидкість хімічних реакцій. Хімічна рівновага
5.1 Мета роботи :
вивчити вплив різних чинників на швидкість і рівновагу фізико-хімічних процесів.
5.2 Короткі теоретичні відомості
ШВИДКІСТЬ ФІЗИКО-ХІМІЧНИХ ПРОЦЕСІВ
Хімічна кінетика – розділ хімії, що вивчає швидкість і механізм фізико-хімічних процесів.
У хімічній кінетиці розрізняють гомогенні і гетерогенні процеси.
Гомогенні процеси відбуваються в усьому об’ємі, реагуючі речовини знаходяться в одній фазі, молекули усіх реагуючих речовин знаходяться за однакових умов. Гетерогенні процеси відбуваються на межі поділу фаз.
Швидкість фізико-хімічного процесу – зміна кількості реагуючих речовин за одиницю часу в одиниці реакційного простору.
Швидкість гомогенної реакції можна визначити, як зміну концентрації однієї з реагуючих речовин за одиницю часу.
Швидкість гетерогенних реакцій вимірюється кількістю речовини, що вступає в реакцію або, що утворюється за одиницю часу, на одиниці поверхні. Процес відбувається не в об’ємі твердої речовини, а на поверхні, концентрація її залишається постійною, тому швидкість гетерогенних реакцій визначається зміною концентрації газів або рідин.
Швидкість реакції залежить від природи реагуючих речовин, їх концентрації, температури, тиску (для реакцій за участю газів), присутності в системі каталізаторів, від площі поверхні взаємодії реагуючих речовин (у разі гетерогенної реакції) і т. д.
Залежність швидкості реакції від концентрації реагуючих речовин. Залежність швидкості реакції від концентрації реагуючих речовин виражається основним законом хімічної кінетики – законом діючих мас (ЗДМ):
швидкість гомогенної хімічної реакції за постійної температури прямо пропорційна добутку концентрацій реагуючих речовин, узятих в степенях їхніх стехіометричних коефіцієнтів в рівнянні реакції.
Для реакції aA + bB = cC + dD математичний вираз закону запишеться так:
Ѵгом = kСАа×СВb, (5.1)
де Ѵгом – швидкість реакції; k – константа швидкості хімічної реакції; САа і СВb – концентрації реагуючих речовин, моль/л; а, b – стехіометричні коефіцієнти в рівнянні реакції.
Фізичний зміст константи швидкості (k): k показує, з якою швидкістю відбувається реакція за концентрацій реагуючих речовин 1 моль/л. Константа швидкості залежить від природи реагуючих речовин, температури, присутності каталізатора, але не залежить від концентрації реагуючих речовин і парціальних тисків (для газів).
Для реагуючих речовин в газоподібному стані замість концентрацій в законі діючих мас можна використати їх парціальні тиски:
Ѵгом = k×рАа×рВb. (5.2)
У разі гетерогенних процесів в закон діючих мас входять концентрації тільки тих речовин, які знаходяться в газовій фазі або розчині. Концентрації речовин, що знаходяться в твердій фазі, постійні і включені в константу швидкості. Наприклад:
C(т) + О2(г) = СО2(г) 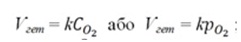
Zn(т) + 2HCl(ж) = ZnCl2(ж)+ H2(г) 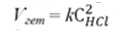
У загальному випадку швидкість реакції в гетерогенних процесах пропорційна поверхні зіткнення реагуючих речовин. Чим більшою є поверхня взаємодії, тим більшою є ймовірність зіткнення взаємодіючих частинок, а, отже, більшою є і швидкість гетерогенної реакції.
Закон діючих мас справедливий для простих реакцій, що відбуваються в газах або розчинах. Для складних гомогенних реакцій закон є справедливим для кожної окремої стадії, але не для усієї реакції в цілому. Швидкість складних реакцій визначається найповільнішою стадією.
У гетерогенних процесах, що відрізняються складністю і багатостадійністю, закон діючих мас справедливий лише тоді, коли найповільнішою стадією є сама хімічна реакція.
Залежність швидкості реакції від температури
Залежність швидкості фізико-хімічного процесу від температури приблизно виражається правилом Вант-Гоффа: зі збільшенням температури на кожні 10 градусів швидкість більшості хімічних реакцій зростає приблизно в 2 -4 рази. Математично ця залежність виражається так:
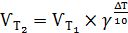 (5.3)
(5.3)
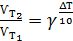 (5.4)
(5.4)
де 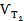 и
и 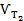 – швидкості реакції за температур Т2 і Т1; ΔТ = Т2 – Т1; γ – температурний коефіцієнт швидкості (значення змінюються від 2 до 4), що показує, в скільки разів збільшиться швидкість реакції з підвищенням температури на 10 градусів. Кількісне значення γ залежить від природи реагуючих речовин і для цієї реакції є величиною сталою.
– швидкості реакції за температур Т2 і Т1; ΔТ = Т2 – Т1; γ – температурний коефіцієнт швидкості (значення змінюються від 2 до 4), що показує, в скільки разів збільшиться швидкість реакції з підвищенням температури на 10 градусів. Кількісне значення γ залежить від природи реагуючих речовин і для цієї реакції є величиною сталою.
Збільшення швидкості хімічної реакції з підвищенням температури пов’язане із зростанням числа активних молекул, що мають надмірну енергію. Для того, щоб брати участь в реакції, молекулам необхідний надлишок енергії в порівнянні з середньою енергією молекул за цієї температури. Цей надлишок енергії називається енергією активації реакції; вона позначається Еа і вимірюється в кДж/моль. Чисельне значення Еа залежить від природи реагуючих речовин і каталізатора. Чим більше значення Еа, тим меншою є швидкість хімічної реакції. Константа швидкості реакції і енергія активації пов’язані рівнянням Ареніуса:
k = А×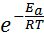 (5.5)
(5.5)
де k – константа швидкості; А – постійна величина для реакції, характеризує загальне число зіткнень із сприятливою орієнтацією, не залежить від температури; е – основа натурального логарифма; Еа – енергія активації, кДж моль ; R – універсальна газова стала; Т – абсолютна температура, К.
Множник ![]() , що називається експоненціальним, характеризує частку активних зіткнень (зіткнень активних частинок) від їх загальної кількості.
, що називається експоненціальним, характеризує частку активних зіткнень (зіткнень активних частинок) від їх загальної кількості.
Аналіз рівняння Ареніуса показує: з підвищенням температури зростає частка активних зіткнень, що пояснює експоненціальну залежність швидкості реакції від температури.
Висновок з рівняння Ареніуса (5.5): зі збільшенням температури зросте константа швидкості тієї реакції, енергія активації якої є більшою.
Енергію активації можна знайти, якщо виміряти константу швидкості реакції за двох температур Т1 і Т2. В обчисленні енергії активації знадобляться не абсолютні значення константи швидкості, а їх відношення (k2 : k1). Це те ж саме, що відношення швидкостей реакції за двох температур (Ѵ2 : Ѵ1) або відношення часу реакції за Т1 до її часу за Т2 (τ1: τ2), оскільки усі ці відношення рівні між собою: k2: k1 = Ѵ2 : Ѵ1 = τ1: τ2, то формулу для обчислення енергії активації можна одержати, якщо записати рівняння Ареніуса двічі – для температур Т1 і Т2:
k1 = А×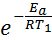 (5.6) і k2 =А×
(5.6) і k2 =А×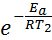 (5.7)
(5.7)
розділити друге рівняння на перше, прологарифмувати одержане рівняння. Після перетворень виходить формула:
Ea = 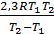 ×lg
×lg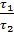 (5.8).
(5.8).
Одним з найбільш поширених в практиці способів зміни швидкості процесів є каталіз. За каталізу реакція відбувається через ряд проміжних стадій, кожна з яких характеризується певним значенням енергії активації: каталізатори зменшують Еа, інгібітори (уповільнювачі) збільшують Еа.
РІВНОВАГА У ФІЗИКО-ХІМІЧНИХ ПРОЦЕСАХ
За принципом оборотності реакції можна розділити на оборотні, такі, що відбуваються одночасно в двох протилежних напрямах (прямому і зворотному), і необоротні, такі, що відбуваються до кінця в даному напрямі. Оборотні реакції в закритій системі за постійної температури і тиску відбуваються до стану рівноваги.
Хімічна рівновага – стан оборотного процесу, за якого швидкості прямої і зворотної реакції є рівними. Концентрації реагуючих речовин, що встановилися на момент настання рівноваги, називають рівноважними, вони залишаються постійними до порушення хімічної рівноваги.
Ѵ пр =Ѵ про – кінетична умова рівноваги.
Кількісно хімічна рівновага характеризується величиною константи рівноваги. Для оборотної реакції:
аА + вВ ↔ сС + dD
швидкість реакцій відповідно дорівнює
Ѵпр![]() і Ѵзв
і Ѵзв![]() (5.9)
(5.9)
у момент рівноваги Ѵпр= Ѵзв :
![]() =
= ![]() або
або ![]() , (5.10)
, (5.10)
де Кс – константа хімічної рівноваги, kпр , kзв – константи швидкості прямої і зворотної реакції; [С], [D], [A], [B] – рівноважні концентрації речовин, моль/л; а, b, с, d – cтехіометричні коефіцієнти в рівнянні реакції.
Для газоподібних систем можна використати рівноважні парціальні тиски газів. Тоді:
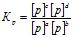 . (5.11)
. (5.11)
У гетерогенних системах у вирази константи рівноваги не входять концентрації твердих речовин. Наприклад, для рівноважної системи
CaCO3(т) → СaO(т) + СО2(г),
KC = 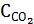 або KC =
або KC = 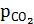
Фізичний зміст КС (КР): константа рівноваги визначає глибину процесу до моменту досягнення системою рівноважного стану.
Чим більше чисельне значення К, тим більшим є ступінь перетворення початкових речовин в продукти реакції а, отже, тим з більшою швидкістю відбувається пряма реакція до досягнення рівноваги.
Константа рівноваги залежить від температури і природи реагуючих речовин і не залежить від концентрацій (парціальних тисків), присутності каталізатора. Введення каталізатора в систему не впливає на відношення kпр/kзв, тобто на значення константи рівноваги: однаково зменшується енергія активації і збільшується константа швидкості як прямої, так і зворотної реакції.
Вплив зміни зовнішніх умов на стан хімічної рівноваги.
Стан хімічної рівноваги існує лише за певних умов: концентрації, температури, тиску. За зміни однієї з цих умов рівновага порушується внаслідок неоднакової зміни швидкостей прямої та зворотної реакції. Перехід з одного рівноважного стану в інший називається зміщенням положення рівноваги. Якщо швидкість прямої реакції стає більшою за швидкість зворотної реакції, рівновага зміщується вправо (→). Якщо швидкість прямої реакції стає меншою, ніж швидкість зворотної, то рівновага зміщується вліво (←). З часом в системі встановлюється нова хімічна рівновага, яка характеризується рівністю швидкостей Ѵпр = Ѵзв і новими рівноважними концентраціями усіх речовин в системі.
Напрям зміщення рівноваги визначається принципом Ле Шателье: якщо на систему, що знаходиться в рівновазі, подіяти ззовні, то рівновага зміщується в бік тієї реакції, яка послабляє цю дію.
Вплив трьох основних типів зовнішньої дії – зміни концентрації, тиску і температури – на хімічну рівновагу згідно з принципом Ле Шателье
1. Збільшення концентрації однієї з реагуючих речовин зміщує рівновагу в бік тієї реакції, під час якої ця речовина витрачається; зменшення концентрації однієї з реагуючих речовин зміщує рівновагу у бік реакції утворення цієї речовини.
Як приклад розглянемо контактний метод одержання сірчаної кислоти:
1) 2SO2 + O2 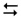 2SO3
2SO3
2) SO3 + H2O 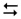 H2SO4,
H2SO4,
у якому бажано було б найповніше перетворення оксиду сульфуру(IV) на оксид сульфуру(VI) в першій (оборотній) реакції.
Для збільшення виходу SO3 можна збільшити концентрацію SO2 в початковій реакційній суміші. Проте це є нерентабельним і екологічно шкідливим, оскільки надлишок SO2 викидатиметься в атмосферу. Тому реакцію проводять за надлишку повітря, збагаченого киснем. В результаті досягається зміщення рівноваги вправо, тобто повніше перетворення SO2 в SO3.
У йонообмінних реакціях між розчиненими речовинами рівновага зміщується у бік утворення осадів, газів або слабких електролітів.
2. Зміна температури впливає як на пряму, так і на зворотну реакцію, але в різній мірі. Для з’ясування впливу температури на хімічну рівновагу необхідно знати знак теплового ефекту реакції. З підвищенням температури рівновага зміщується у бік ендотермічної реакції, зі зниженням температури – у бік екзотермічної. Наприклад, реакція синтезу аміаку є екзотермічною:
N2 + 3H2 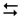 2NH3 ΔН° = -92,4 кДж
2NH3 ΔН° = -92,4 кДж
Тому з підвищенням температури її рівновага зміщується вліво (аміак розкладається), а зі зниженням – вправо (аміак утворюється).
3. Зі збільшенням тиску рівновага зміщується у бік зменшення кількості молів газу, тобто у бік зниження тиску; зменшення тиску зміщує рівновагу в бік зростання кількості молів газів, тобто в бік збільшення тиску. Якщо реакція відбувається без зміни кількості молів газоподібних речовин, то тиск не впливає на стан рівноваги в цій системі.
Наприклад, в реакції синтезу аміаку
N2 + 3H2 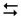 2NH3
2NH3
об’єм продукту є в два рази меншим за об’єм реагентів. Тому рівновага цього оборотного процесу зі збільшенням тиску зміщується в бік утворення NH3, а зі зменшенням тиску – у бік його розкладання.
5.3 Експериментальна частина
Реактиви. Розчини Nа2S2O3, Н2SO4, дист. вода, універсальний індикатор (1, 2). Розчин FeCl3, NH4SCN або КSCN, крист. NH4Cl або КCl (3). Розчин NH3®H2O, дист. вода, фенолфталеїн, крист. NH4Cl (4). Розчин K2CrO4 , K2Cr2O7, розчин H2SO4, розчин NаОН (5). 0,1 М розчин СН3СООН, крист. СН3СООNа, метилоранж, дист. вода (6).
Посуд і прилади. Пробірки, бюретки, шпатель, скляна паличка, хімічна склянка на 500 мл, секундомір.
5.3.1. Залежність швидкості реакції від концентрації
Досліджується реакція між тіосульфатом натрію і сірчаною кислотою, яка описується рівнянням :
Na2S2O3 + H2SO4 = Na2SO4 + SO2↑ + S↓+ H2O
В ході реакції один із її продуктів – сірка утворюється у вигляді дуже дрібних, невидимих спочатку, колоїдних частинок, зависі у воді. Коли кількість сірки зростає, її частинки починають з’єднуватися між собою (коагулювати).
Розсіювання світла колоїдними частинками сірки спостерігається у вигляді блакитнуватого забарвлення розчину, що нагадує слабке світіння. Це явище називається опалесценцією. В ході експерименту необхідно вимірювати проміжок часу між двома моментами: моментом початку реакції і моментом, коли стає видимою опалесценція.
Цей проміжок приймається за час реакції (τ). Величина, обернена часу реакції (1/τ) є пропорційною швидкості реакції (Ѵ); одиниця її виміру – с-1. Надалі скорочено цю величину називатимемо швидкістю реакції.
Дослід виконується за різних концентрацій тіосульфату натрію, тоді як концентрація сірчаної кислоти береться однаковою для усіх вимірів в цій серії. За допомогою даного досліду можна виявити залежність швидкості реакції від концентрації тіосульфату натрію.
Хід досліду.
1. У п’яти окремих пробірках приготувати п’ять розчинів тіосульфату натрію з різними концентраціями. У першу пробірку налити з бюретки 5 мл розчину Na2S2O3, в другу – 10, в третю – 15. Після цього об’єм розчину в кожній пробірці довести до 15 мл додаванням води: у в другу пробірку додати 5 мл води, в третю – 10 мл.
2. У приготованих пробірках з розчинами Na2S2O3 провести реакції з сірчаною кислотою. Для цього в кожну з них додати 5 мл сірчаної кислоти. Кожного разу за секундоміром визначити час реакції – досягнення однакової інтенсивності опалесценції.
3. Обчислити значення швидкості реакції і заповнити таблицю:
Таблиця 5.1 – Залежність швидкості реакції від концентрації реагуючої речовини
|
Номер досліду |
V, мл Na2S2O3 |
V, мл Н2О |
Концентрація Na2S2O3 С, моль/л |
Час реакції, τ |
Швидкість реакції, Ѵ = 1/τ |
|
1 |
15 |
0 |
0,075 |
|
|
|
2 |
10 |
5 |
0,050 |
|
|
|
3 |
5 |
15 |
0,025 |
|
|
4. Побудувати графік залежності швидкості реакції від концентрації розчину (С, моль/л) тіосульфату натрію Na2S2O3.
5.3.2 Залежність швидкості реакції від температури. Визначення енергії активації
За допомогою даного досліду можна визначити енергію активації реакції між тіосульфатом натрію і сірчаною кислотою. Для цього час реакції вимірюється за трьох різних температур, але за однакових концентрацій реагентів.
1. У трьох пробірках приготувати однакові об’єми розчину Na2S2O3 однієї і тієї ж концентрації.
2. У першій пробірці реакція проводиться за кімнатної температури. Для цього пробірку перед початком реакції помістити на 3 – 5 хв в термостат, що має кімнатну температуру, так, щоб розчин в пробірці набув температури термостата. В якості термостата використовується хімічна склянка з водою; температура води в термостаті контролюється термометром. Після того, як температура встановилася, в пробірку додається 5 мл сірчаної кислоти і вимірюється час реакції.
3. Температура термостата підвищується (додаванням гарячої води) на двадцять градусів. Друга пробірка з Na2S2O3 термостатується впродовж 5 хв за нової температури і в ній так само проводиться реакція з 5 мл сірчаної кислоти. Так само з інтервалом в двадцять градусів проводиться вимір часу реакції в третій пробірці. Дані заносяться в таблицю 5.2.
Таблиця 5.2 – Залежність швидкості реакції від температури
|
Номер пробірки |
1 |
2 |
3 |
|
Температура, С° |
|
|
|
|
Температура, К |
|
|
|
|
Час реакції τ, с |
|
|
|
|
Швидкість реакції, V = 1/�� |
|
|
|
4. Для кожної пари з двох температур обчислити величину енергії активації. Після цього, виходячи з трьох отриманих значень енергії активації, знайти її середнє значення.
5. Визначити похибку досліду, порівнявши знайдене значення енергії активації з відомим з літератури (35 кДж/моль).
6. Описати дослід і зробити висновок.
5.3.3 Вплив концентрації реагуючих речовин на зміщення рівноваги можна дослідити за допомогою оборотної реакції
FeCl3 + 3KSCN 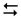 Fe(SCN)3 + 3 KCl
Fe(SCN)3 + 3 KCl
Розчин ферум(ІІІ) роданіду інтенсивно забарвлений у кров’янисто-червоний колір, FeCl3 – у жовтий, а розчини KSCN і KCl – безбарвні. У результаті зміни концентрації Fe(SCN)3 забарвлення розчину змінюється, що вказує на напрямок зміщення хімічної рівноваги.
До 20 мл води у невеликій склянці додайте 1-2 краплі насичених розчинів FeCl3 і KSCN (NH4SCN). Одержаний розчин розлийте у 4 пробірки: у першу прилийте кілька крапель концентрованого розчину KSCN (або NH4SCN), у другу – розчину FeCl3, у третю – додайте невелику кількість кристалічного КСl (або NH4Сl), а четверту пробірку залиште для порівняння. Порівняти інтенсивність забарвлення отриманих розчинів з інтенсивністю забарвлення еталону. Результати досліду оформити у вигляді таблиці:
Таблиця 5.3 – Вплив концентрації на зміщення рівноваги
|
Номер пробірки |
Додана речовина |
Зміна інтенсивності забарвлення (послаблення, посилення) |
Напрям зміщення рівноваги((→,←) |
|
1 FeCl3 |
|
|
|
|
2 KCNS |
|
|
|
|
3 KCl |
|
|
|
|
4 Контрольна |
|
|
|
5.3.4 Зміщення рівноваги в розчині аміаку
У дві пробірки налити по одній третині дистильованої води, по 5 крапель фенолфталеїну і по 2-3 краплі розчину аміаку. Відмітити колір розчинів. Одну пробірку залишити для порівняння, а в іншу додати 3-4 мікрошпателі хлориду амонію і перемішати розчин. Як і чому змінилася інтенсивність забарвлення?
Розглянувши схему рівноваги у водному розчині аміаку
NH3 + H2O 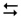 NH4+ + OH–
NH4+ + OH–
пояснити її зміщення в результаті додавання кристалічного хлориду амонію.
5.3.5 Вплив середовища розчину на зміщення рівноваги переходу хромату в дихромат
Хром в шестивалентному стані утворює два аніони: хромат-йон Cr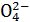 і дихромат-йон Cr2
і дихромат-йон Cr2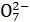 . Їх існування визначається наявністю лужного (рН > 7) або кислого (рН < 7) середовища.
. Їх існування визначається наявністю лужного (рН > 7) або кислого (рН < 7) середовища.
У дві пробірки внести по 3 краплі розчину хромату калію (K2CrO4).
Повторити дослід, узявши в двох пробірках за початкову речовину дихромат калію K2Cr2O7
Описати дослід. Написати молекулярні рівняння переходу хромату в дихромат і зворотного процесу, використовуючи наступні йонні рівняння:
2CrO42– + 2H+ 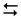 Cr2O72– + H2O;
Cr2O72– + H2O;
Cr2O72– + 2OH– 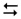 2CrO42– + H2O.
2CrO42– + H2O.
Зробити висновок про вплив середовища на утворення хроматів і дихроматів.
5.3.6 Зміщення рівноваги під час дисоціації слабких кислот
Дисоціація усіх електролітів під час розчинення відбувається внаслідок їх взаємодії з водою. Наприклад, процес електролітичної дисоціації слабкої оцтової кислоти, який виражається короткою схемою:
СН3СООН 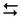 Н+ + СН3СОО–,
Н+ + СН3СОО–,
насправді відбувається з утворенням гідратів невизначеного складу :
СН3СООН + H2O 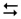 Н3О+ + СН3СОО–
Н3О+ + СН3СОО–
Рівновага цього оборотного фізико-хімічного процесу, як і оборотних реакцій, можна зміщувати в обидва боки за допомогою зовнішнього впливу.
У дві пробірки внести по 6 крапель 0,1 М оцтової кислоти. У кожну додати одну краплю метилоранжу. Під впливом яких йонів індикатор набуває рожевого забарвлення?
Одну пробірку з кислотою залишити в якості контрольної, а в іншу внести 3-4 мікрошпателі ацетату натрію і перемішати розчин скляною паличкою. Порівняти забарвлення отриманого розчину із забарвленням в контрольній пробірці. На зміну концентрації яких йонів вказує зміна забарвлення індикатора?
У звіті описати дослід і спостереження. Написати схему дисоціації оцтової кислоти і вираз константи її дисоціації (константи рівноваги). Пояснити зміщення рівноваги дисоціації кислоти додаванням до неї ацетату натрію. Як змінюється в даному випадку ступінь дисоціації кислоти і концентрація катіонів H3О+ в розчині? Чи підтвердився в дослідах принцип Ле Шателье? Сформулювати загальний висновок по роботі.
5.4 Контрольні питання та завдання
1. Напишіть вираз для константи рівноваги реакції
Н2 + I2 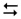 2HI
2HI
Як зміниться константа рівноваги зі збільшенням концентрації продукту реакції (йодоводню) в 2 рази?
2. Для реакції
Na2CO3(к) + СО2(г) + Н2О(г) 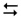 2NaHCO3(к)
2NaHCO3(к)
записати вираз для константи рівноваги через рівноважні концентрації (КС) і рівноважні парціальні тиски (КР).
3. Як вплине на рівновагу оборотної реакції
Fe2O3(к) + 3CO(г) 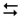 2Fe(к) + 3СО2(г)
2Fe(к) + 3СО2(г)
збільшення тиску?
4. Як вплине на рівновагу оборотної реакції
СаCO3(к) 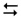 CаO(к) + СО2(г); ΔН° = 171,4 кДж
CаO(к) + СО2(г); ΔН° = 171,4 кДж
підвищення температури?
5. Які умови (температура, тиск, концентрації учасників реакції, каталізатор) необхідні для підвищення виходу хлору за оборотною реакцією?
4HCl(г) + О2(г) 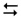 2Cl2(г) + 2Н2О(г); ΔН° = –116,4 кДж
2Cl2(г) + 2Н2О(г); ΔН° = –116,4 кДж
6. Запишіть вираз ЗДМ для реакцій:
а) 2S(к) + 2H2O(г) → O2(г) + 2H2S(г); б) 2NOCl(г) → 2NO(г) + Сl2(г).
Як зміниться їх швидкість, якщо: для реакції (а) збільшити об’єм в 2 рази, для реакції (б) підвищити температуру на 20 К (γ = 5)? Відповідь підтвердити розрахунками.