Лабораторна робота № 6
Взаємодія металів з кислотами, лугами, водою
6.1 Мета:
вивчити відновні властивості металів, їх взаємодію з кислотами, лугами, водою і розчинами солей.
6.2 Короткі теоретичні відомості
ВІДНОВНІ ВЛАСТИВОСТІ МЕТАЛІВ
Метали в хімічних реакціях є відновниками. Ступенем відновних властивостей металів за стандартних умов (Т= 298 К, [Men+] = 1 моль/л) є їх стандартні електродні потенціали ( φ0 або Е°). Метали, розміщені в порядку зростання стандартного електродного потенціалу, утворюють електрохімічний ряд активності металів або ряд напруг:
|
Ме: |
Li |
K |
Ba |
Ca |
Na |
Mg |
Al |
Ti |
Mn |
Zn |
|
Меn+ |
Li+ |
K+ |
Ba2+ |
Ca2+ |
Na+ |
Mg2+ |
Al3+ |
Ti3+ |
Mn2+ |
Zn2+ |
|
φ°У |
–3,04 |
–2,92 |
–2,91 |
–2,87 |
–2,71 |
–2,36 |
–1,66 |
–1,21 |
–1,18 |
–0,76 |
У ряді напруг відновні властивості металів зменшуються, а окиснювальні властивості їх катіонів зростають. Метали від літію до алюмінію прийнято вважати сильними або активними відновниками, від титану до плюмбуму – відновниками середньої активності, а розташовані у ряді напруг після водню – слабкими або малоактивними відновниками.
ЗАГАЛЬНІ ЗАКОНОМІРНОСТІ ВЗАЄМОДІЇ МЕТАЛІВ З ОКИСНИКАМИ
Окисно-відновні реакції за участю металів проводяться для їх одержання і аналізу, у виробництві хімічних реактивів, у виготовленні друкованих плат і так далі. Як окисники використовуються кислоти і солі інших металів. Такі реакції є можливими за умови, якщо значення φ° у окисника (таблиця А1), більше, ніж у металу (відновника), тобто коли виконується умова: Δφо = φоок – φ овідн
На практиці реакції відбуваються в тих випадках, коли Δφ ≥ 0,3 В (таблиця А1) і коли продукти переходять в розчин, а не покривають поверхню металу непроникною захисною плівкою.
З відхиленням від стандартних умов окисно-відновні потенціали змінюються, тому можна здійснити реакції, що є неможливими за стандартних умов. Наприклад, сульфатна кислота, значення φ° якої дорівнюють: 0; 0,303; 0,36 і 0,17 В (таблиця А1, рядки 1, 21-23), за стандартних умов окиснює тільки ті метали, які у ряді напруг розташовані до водню. Але концентрована сірчана кислота за нагрівання окиснює декілька металів, що стоять після водню, – до срібла включно.
Азотна кислота є сильним окисником і може окиснювати усі метали, окрім золота і платини. Відновлення NO3– йону може відбуватися паралельно за декількома напівреакціями (таблиця А1, додаток А, рядки 24 – 29), тому під час взаємодії металів з HNO3 – виходять суміші продуктів відновлення (NH4NO3, N2, N2O, NO, NO2 та ін.). Серед них термодинамічно найбільш ймовірним продуктом є азот, але з кінетичних причин, які до кінця не вивчені, переважають оксиди Нітрогену NO і NO2. Записуючи рівняння реакцій металів з азотною кислотою, зазвичай вказують тільки один продукт відновлення, якого утворюється найбільше.
Під час взаємодії багатьох металів з азотною і концентрованою сірчаною кислотами на поверхні металів утворюється щільна оксидна плівка, що перешкоджає подальшому окисленню металу. Це явище називається пасивацією металу, воно використовується для захисту металів від корозії.
На відновну здатність металів впливає присутність речовин, що утворюють з окисненим металом комплексні сполуки або малорозчинні продукти. Наприклад, з порівняння напівреакцій 4 – 6 в таблиці А1 видно, що відновна здатність цинку за присутності лугів і аміаку вища, ніж за їх відсутності.
ВЗАЄМОДІЯ МЕТАЛІВ З СОЛЯНОЮ І РОЗБАВЛЕНОЮ сірчаною КИСЛОТАМИ
В результаті взаємодії металів з соляною і розбавленою сірчаною кислотами окисником є йон H3О+. Тому з даними кислотами взаємодіють метали, що розміщені у ряді напруг до водню. В результаті взаємодії утворюється сіль і виділяється водень, наприклад:
Zn + 2HCl = ZnCl2 + H2↑
Zn + H2SO4(розб) = ZnSO4 + H2↑
Метали змінної валентності, що проявляють змінний ступінь окиснення, соляною і розбавленою сірчаною кислотами окиснюються, як правило, до нижчих ступенів окиснення, наприклад:
Fe + H2SO4(розб.) = FeSO4 + H2↑
Плюмбум практично не взаємодіє з соляною і розбавленою сірчаною кислотами, оскільки на його поверхні утворюється щільна нерозчинна плівка хлориду або сульфату плюмбуму(II).
ВЗАЄМОДІЯ МЕТАЛІВ З КОНЦЕНТРОВАНОЮ сірчаною КИСЛОТОЮ
У концентрованій сірчаній кислоті окисником є сульфат-йони S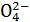 −, у яких Сульфур знаходиться в ступені окиснення +6. Окинюючи метал, сірчана кислота відновлюється до сірководню, сірки і оксиду сульфуру(IV). Відповідні напівреакції наведені в таблиці А1 (рядки 21 – 23). Чим лівіше у ряді напруг знаходиться метал, тим повніше відновлюється сірчана кислота.
−, у яких Сульфур знаходиться в ступені окиснення +6. Окинюючи метал, сірчана кислота відновлюється до сірководню, сірки і оксиду сульфуру(IV). Відповідні напівреакції наведені в таблиці А1 (рядки 21 – 23). Чим лівіше у ряді напруг знаходиться метал, тим повніше відновлюється сірчана кислота.
В результаті взаємодії з концентрованою сірчаною кислотою активних металів утворюються сіль, вода і переважно сірководень :
8Na + 5H2SO4(конц.) = 4Na2SO4 + H2S↑ + 4H2O
Малоактивні метали відновлюють концентровану сірчану кислоту переважно до SO2, наприклад:
Cu + 2H2SO4(конц.) = CuSO4 + SO2↑ + 2H2O
а метали середньої активності – переважно до сірки:
3Zn + 4H2SO4(конц.) = 3ZnSO4 + S↓ + 4H2O
Метали змінної валентності концентрованою H2SO4 окиснюються, як правило, до вищого ступеня окиснення, наприклад:
3Sn + 8H2SO4(конц.) = 3Sn(SO4)2 + 2S↓ + 8H2O
Благородні метали з концентрованою сірчаною кислотою не взаємодіють ні за яких умов. Деякі метали (Al, Fe, Сr, Ni, Ti, V та ін.) не взаємодіють з концентрованою сірчаною кислотою за звичайних умов (пасивуються), але взаємодіють за нагрівання. Велике практичне значення має пасивація заліза: концентровану сірчану кислоту можна зберігати в ємкостях із звичайної нелегованої сталі.
Плюмбум з концентрованою сірчаною кислотою взаємодіє з утворенням розчинної гідросолі, оксиду сульфуру(IV) і води :
Pb + 3H2SO4 = Pb(HSO4)2 + SO2↑ + 2H2O
ВЗАЄМОДІЯ МЕТАЛІВ З АЗОТНОЮ КИСЛОТОЮ
Незалежно від концентрації окисником в азотній кислоті є нітрат-йони 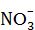 , з Нітрогеном в ступені окиснення +5. В результаті взаємодії металів з азотною кислотою водень не виділяється. Азотна кислота окиснює усі метали за винятком самих неактивних (благородних). В результаті чого утворюється сіль, вода і продукти відновлення Нітрогену(+5): NH4+, NО, N2, N2O, NO, НNО2, NO2. Вільний аміак не виділяється, оскільки він взаємодіє з азотною кислотою, утворюючи нітрат амонію :
, з Нітрогеном в ступені окиснення +5. В результаті взаємодії металів з азотною кислотою водень не виділяється. Азотна кислота окиснює усі метали за винятком самих неактивних (благородних). В результаті чого утворюється сіль, вода і продукти відновлення Нітрогену(+5): NH4+, NО, N2, N2O, NO, НNО2, NO2. Вільний аміак не виділяється, оскільки він взаємодіє з азотною кислотою, утворюючи нітрат амонію :
NH3 + HNO3 = NH4NO3
В результаті взаємодії металів з концентрованою азотною кислотою (30-60 % HNO3) продуктом відновлення HNO3 є переважно нітроген(IV) оксид, незалежно від природи металу, наприклад:
Mg + 4HNO3(конц.) = Mg(NO3)2 + 2NO2↑ + 2H2O
Zn + 4HNO3(конц.) = Zn(NO3)2 + 2NO2↑ + 2H2O
Hg + 4HNO3(конц.) = Hg(NO3)2 + 2NO2↑ + 2H2O
Метали змінної валентності під час взаємодії з концентрованою азотною кислотою окиснюються до вищого ступеня окиснення. Метали, які окиснюються до ступеня окиснення +4 і вище, утворюють кислоти або оксиди. Наприклад:
Sn + 4HNO3(конц.) = H2SnO3 + 4NO2↑ + H2O
2Sb + 10HNO3(конц.) = Sb2O5 + 10NO2↑ + 5H2O
Мо + 6HNO3(конц.) = H2МоO4 + 6NO2↑ + 2H2O
У концентрованій азотній кислоті пасивуються алюміній, хром, залізо, нікель, кобальт, титан і деякі інші метали. Після обробки азотною кислотою ці метали не взаємодіють і з іншими кислотами.
В результаті взаємодії металів з розбавленою азотною кислотою продукт її відновлення залежить від відновних властивостей металу: чим активніший метал, тим в більшій мірі відновлюється азотна кислота.
Активні метали відновлюють розбавлену азотну кислоту максимально, тобто утворюється сіль, вода і NH4NO3, наприклад:
8K + 10HNO3(розб.) = 8КNO3 + NН4NO3 + 3H2O
Метали середньої активності під час взаємодії з розбавленою азотною кислотою утворюють сіль, воду і азот або N2O. Чим лівіше метал в цьому інтервалі (чим ближче до алюмінію), тим ймовірніше утворення азоту, наприклад:
5Мn + 12HNO3(розб.) = 5Mn(NO3)2 + N2↑ + 6H2O
4Cd + 10HNO3(розб.) = 4Cd(NO3)2 + N2O↑ + 5H2O
Малоактивні метали під час взаємодії з розбавленою азотною кислотою утворюють сіль, воду і оксид нітрогену(II), наприклад:
3Сu + 8HNO3(розб.) = 3Cu(NO3)2 + 2NO↑ + 4H2O
Але рівняння реакцій в цих прикладах є умовними, оскільки насправді виходить суміш сполук Нітрогену, причому, чим вищою є активність металу і нижчою концентрація кислоти, тим нижчим є ступінь окиснення Нітрогену в тому продукті, якого утворюються більше від інших.
ВЗАЄМОДІЯ МЕТАЛІВ З "ЦАРСЬКОЮ водкою"
"Царською водкою" називається суміш концентрованих азотної і соляної кислот. Вона застосовується для окиснення і переведення в розчинний стан золота, платини й інших благородних металів.
Соляна кислота в "царській водці" витрачається на утворення комплексної сполуки окисненого металу. З порівняння напівреакцій 29 і 30 з напівреакціями 31-32 (таблиця А1) видно, що під час утворення комплексних сполук Арґентуму і Платини окисно-відновний потенціал зменшується, що робить можливим їх окиснення азотною кислотою. Рівняння реакцій золота і платини з "царською водкою" записуються так:
Au + HNO3 + 4HCl = H[AuCl4] + NO↑ + 2H2O
3Pt + 4HNO3 + 18HCl = 3H2[PtCl6] + 4NO↑ + 8H2O
З "царською водкою" не взаємодіють три метали: вольфрам, ніобій і тантал. Їх окиснюють сумішшю концентрованої азотної кислоти з плавиковою (HF), оскільки HF кислота утворює міцніші комплексні сполуки, ніж соляна. Рівняння реакцій такі:
W + 2HNO3 + 8HF = H2[WF8] + 2NO↑ + 4H2O
3Nb + 5HNO3 + 21HF = 3H2[NbF7] + 5NO↑ + 10H2O
3Ta + 5HNO3 + 24HF = 3H3[TaF8] + 5NO↑ + 10H2O
У деяких навчальних посібниках зустрічається інше пояснення взаємодії благородних металів з "царською водкою". Вважають, що в цій суміші між HNO3 і HCl відбувається каталізована благородними металами реакція, в якій азотна кислота окислює соляну за рівнянням :
HNO3 + 3HCl = NOCl + 2H2O
Хлорид нітрозилу NOCl є нестійким і розкладається за рівнянням:
NOCl = NO + Cl (атомарний)
Таким чином, окисником металу є атомарний (тобто дуже активний) хлор у момент виділення. Тому продуктами взаємодії "царської водки" з металами є сіль (хлорид), вода і оксид нітрогену(II) :
Au + HNO3 + 3HCl = AuCl3 + NO↑ + 2H2O
3Pt + 4HNO3 + 12HCl = 3PtCl4 + 4NO↑ + 8H2O,
а комплексні сполуки утворюються в подальших реакціях:
HCl + AuCl3 = H[AuCl4]; 2HCl + PtCl4 = H2[PtCl6]
7. ВЗАЄМОДІЯ МЕТАЛІВ З ВОДОЮ
Метали, розташовані у ряді напруг до водню, відновлюють водень з розчинів з концентрацією Н3О+-йонів 1 моль/л. Оскільки концентрація йонів H3О+ у воді складає 10-7 моль/л, то, обчисливши за рівнянням Нернста потенціал H3О+-йонів для води, отримаємо: φ = 0 + 0,591lg10 – 7 = – 0,41 В
Отже, водень з води можуть витісняти метали, що розташовані в ряді напруг лівіше кадмію – від літію до заліза.
За кімнатної температури з достатньою швидкістю взаємодіють з водою лише лужні і лужноземельні метали.
Порошкоподібний магній і алюміній взаємодіють з киплячою водою. Необхідною умовою реакції є попереднє видалення оксидної плівки :
MgO + H2O = Mg(OH)2
Цей процес відбувається без виділення газу. А далі вода безпосередньо взаємодіє з металом з виділенням водню :
Mg + 2H2O = Mg(OH)2 + Н2↑
Вода є слабким окисником, тому вона окиснює метали до нижчих ступенів окиснення.
Часто спостерігається взаємодія з водою металів, що розташовані у ряді напруг правіше заліза. Це пояснюється присутністю у воді розчиненого кисню, що є сильнішим окисником, ніж вода.
ВЗАЄМОДІЯ МЕТАЛІВ З ЛУГАМИ
Луги є дуже слабкими окисниками, тому під час взаємодії металів з розчинами лугів в ролі окисника виступає вода, потенціал якої в лужному середовищі рівний -0,83 В: φ = 0 + 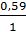 lg10–14 = -0,83 В, а луг є середовищем або комплексоутворювачем (напівреакція 2 в таблиці А1). Отже, з розчинами лугів за стандартної концентрації можуть взаємодіяти амфотерні метали, що утворюють гідроксокомплекси або солі, подібні до солей неметалів, за умови, що потенціали відповідних напівреакцій є більш негативними за -0,83 В (напівреакції 6, 13-19).
lg10–14 = -0,83 В, а луг є середовищем або комплексоутворювачем (напівреакція 2 в таблиці А1). Отже, з розчинами лугів за стандартної концентрації можуть взаємодіяти амфотерні метали, що утворюють гідроксокомплекси або солі, подібні до солей неметалів, за умови, що потенціали відповідних напівреакцій є більш негативними за -0,83 В (напівреакції 6, 13-19).
Взаємодія металів з лугами можна виразити такою загальною схемою:
Ме + Н2О + луг = гідроксокомплексна сіль + Н2↑
Роль лугу на початку реакції полягає в тому, що вона розчиняє поверхневий оксидний шар амфотерного металу, наприклад:
ZnO + H2O + 2KOH = K2[Zn(OH)4]
Після видалення оксидної плівки реакція відбувається в дві стадії:
1) Zn + 2H2O = Zn(OH)2 + Н2↑
2) Zn(OН)2 + 2КОН = K2[Zn(OH)4]
Таким чином, з розчинами лугів взаємодіють метали, які в лужному середовищі утворюють гідроксокомплекси і потенціали відповідних напівреакцій яких менше за -0,83 В, а саме:
4Al + 4OH- -3е- = [Al(OH)4]-; φ° = -2,33 B
2Be + 6OH--4е- = [Be2(OH)6]2-; φ° = -2,63 B
Cr + 4OH- – 3е- = [Cr(OH)4]-; φ° = -1,27 B
Ga + 4OH- – 3е- = [Ga(OH)4]-; φ° = -1,22 B
Sn + 4OH- – 2е- = [Sn(OH)4]2-; φ° = -0,91 B
Деякі метали (Fe, Ti, Re, Mn та ін.) взаємодіють з лугами у присутності сильнішого, ніж вода, окисника (KClO3, KNO3, O2 та ін.).
Mn + KClO3 + 2KOH = K2MnO4 + KCl + H2O
Fe + 3KNO3 + 2KOH = K2FeO4 + 3KNO2 + H2O
4Sb + 3O2 + 4NaOH + 6H2O = 4Na[Sb(OH)4]
Метали, які здатні взаємодіяти не лише з кислотами, але і з лугами, називаються амфотерними. Неамфотерні (типові) метали з лугами не взаємодіють.
ВЗАЄМОДІЯ МЕТАЛІВ З РОЗЧИНАМИ СОЛЕЙ ІНШИХ МЕТАЛІВ
Свої особливості мають реакції металів з розчинами солей інших металів. Вивчаючи такі реакцій необхідно враховувати можливість окиснення цього металу продуктами гідролізу солі.
Наприклад, в результаті взаємодії цинку з розчином сульфату купруму можливі наступні реакції:
– окиснення цинку йонами купруму (+2): Zn + CuSO4 = Cu + ZnSO4
– окиснення цинку сірчаною кислотою, яка утворюється під час гідролізу сульфату купруму:
2CuSO4 + 2Н2О = (CuОН)2SO4 + Н2SO4 – гідроліз
Zn + Н2SO4 = ZnSO4 + Н2↑ – окиснення
Підсумовуючи ці рівняння, отримуємо:
2Zn + 3CuSO4 + 2Н2О = Cu + (CuОН)2SO4 + 2ZnSO4 + H2↑
6.3 Експериментальна частина
Реактиви. Розчин НCl, магнієві стрічки, порошкоподібне залізо, мідь, гранули цинку (1). Розчин та конц. НCl, порошкоподібне залізо, розчини K3[Fe(CN)6], NH4SCN (2). Цинковий пил, розчин NH3®H2O, дист. вода (3). Мідний пил, конц. NH3®H2O, розчин Na2S, конц. НCl (4). Три залізні пластинки, конц. Н2SО4 і НCl, розчин CuSO4 (5). Алюміній, цинк, мідь, конц. NаОН(6). Цинк і розчин CuSO4; алюміній і розчин Na2CO3 (7).
Посуд і прилади. Пробірки, шпатель, скляна паличка, спиртівка або сухий спирт, пробіркотримач, сірники.
6.3.1 Порівняння відновних властивостей металів
У чотири пробірки помістити по 8 крапель розбавленої соляної кислоти. У першу пробірку внести шматочок магнію, в другу – заліза, в третю – міді, в четвертую – цинку.
У звіті описати спостереження; написати рівняння реакцій, пояснити, чому в третій пробірці реакція не відбувається. У висновку вказати, чи відповідають виявлені в досліді властивості вивчених металів їх положенню у ряді напруг.
6.3.2 Взаємодія заліза з розбавленою і концентрованою соляною кислотою
У дві пробірки внести по 8-10 крапель розбавленої соляної кислоти і по одному мікрошпателю порошкоподібного заліза. Для прискорення реакції пробірки злегка підігріти. Потім в першій пробірці провести якісну реакцію на йони феруму(II) :
FeCl2 + K3[Fe(CN)6] = KFe[Fe(CN)6]↓ + 2KCl,
а в другій – на йони феруму(III) :
FeCl3 + 3NH4SCN = Fe(SCN)3 + 3NH4Cl
За наявності в першій пробірці йонів Fe2+ утворюється темно-синій осад турнбулевой сині, а в другій пробірці за наявності йонів Fe3+ – криваво-червоний розчин роданіду феруму(ІІІ) (за малої концентрації йонів Fe3+ спостерігається слабке забарвлення розчину).
Потім дослід повторити від початку до кінця, замінивши розбавлену соляну кислоту на концентровану.
Описати дослід. Скласти рівняння двох можливих реакцій заліза з соляною кислотою і пояснити, яка з них є більш ймовірною і як впливає збільшення концентрації HCl на її хід.
6.3.3. Взаємодія цинку з водою і розчином аміаку
У дві пробірки внести по одному мікрошпателю цинкового пилу. У першу додати 15-20 крапель води, а в другу – стільки ж концентрованого водного розчину аміаку.
Описати спостереження. Використовуючи потенціали напівреакцій 3, 6, 7 (таблиця А1), оцінити можливість перебігу реакцій :
Zn + 2H2O = Zn(OH)2 + H2↑
Zn + 2H2O + 4NH3 = [Zn(NH3)4](OH)2 + 2H2↑
6.3.4 Взаємодія міді з соляною кислотою за наявності аміаку і сульфіду натрію
У дві пробірки внести по одному мікрошпателю порошку міді. У першу додати 10 крапель концентрованого розчину аміаку, в другу – стільки ж крапель розчину сульфіду натрію. Потім в обидві пробірки додати по 10 крапель концентрованої соляної кислоти. Для порівняння в третій пробірці провести реакцію міді з НСl за відсутності аміаку і сульфіду натрію. Описати спостереження. На основі результатів досліду і напівреакції 11 (таблиця А1) написати рівняння реакції, що відбувається в першій пробірці.
Поява чорного осаду в другій пробірці свідчить про такі реакції :
Cu + 2HCl + Na2S = CuS↓ + 2NaCl + H2↑
2Cu + 2HCl + Na2S = Cu2S↓ + 2NaCl + H2↑
Використовуючи потенціали напівреакцій 9 і 10 таблиці А1, пояснити, яка з цих двох реакцій є термодинамічно ймовірнішою.
6.3.5 Пасивація заліза в концентрованій сірчаній і азотній кислоті
Три залізні пластинки очистити наждачним папером, протравити в концентрованій соляній кислоті, промити водою і осушити фільтрувальним папером. Одну пластинку помістити в пробірку з концентрованою азотною, а іншу – з концентрованою сірчаною кислотою на 1-2 хв; третю пластинку не пасивувати. Потім усі пластинки занурити в розчин сульфату міді(II).
Описати спостереження. Пояснити різне відношення пластинок до розчину CuSO4.
6.3.6 Взаємодія металів з лугами
Невеликі кількості алюмінію, цинку і міді помістити в три пробірки і додати в них по 10 крапель концентрованого розчину гідроксиду натрію.
Описати спостереження. Використовуючи потенціали напівреакцій 5, 7, 12, 13 і 15 (таблиця А1), пояснити, чому мідь не взаємодіє, а алюміній і цинк взаємодіють з розчином NaOH; написати рівняння відповідних реакцій.
Написати також рівняння реакцій алюмінію і цинку з розплавленим гідроксидом натрію.
У висновку сформулювати характерні ознаки металів, що взаємодіють з лугами, і вказати, чим відрізняються реакції таких металів з розчинами і розплавами лугів.
6.3.7 Взаємодія металів з розчинами солей
Взаємодія цинку з розчином сульфату купруму(II). Помістити в пробірку шматочок цинку і додати 8-10 крапель розчину сульфату купруму(II). Описати спостереження. Скласти рівняння реакції.
Взаємодія алюмінію з розчином карбонату натрію. Помістити в пробірку шматочок алюмінію і додати 6 крапель розчину Na2CO3. Пробірку нагріти.
Описати спостереження. Оцінити можливість взаємодії алюмінію безпосередньо з розчином карбонату натрію, виходячи з розміщення алюмінію у ряді напруг:
Al + Na2CO3 =
Написати рівняння гідролізу карбонату натрію в йонному вигляді. Пояснити, з яким із продуктів гідролізу взаємодіє алюміній, і написати рівняння цієї реакції. Скласти сумарне рівняння реакції і вказати в ній окисник і відновник.
У висновках за дослідами 1 і 2 відмітити особливість взаємодії металів з розчинами солей.
6.4 Контрольні питання і завдання
1. Які метали, із запропонованих в переліку, взаємодіють з водою за звичайних умов: Ni, Na, Mg, Fe, Cu, Ca?
2. Продемонструйте за допомогою рівняння реакції механізм взаємодії алюмінію з розчином лугу, враховуючи, що його поверхня вкрита оксидною плівкою.
3. Напишіть декілька рівнянь взаємодії цинку з азотною кислотою. Яка реакція є найбільш ймовірною за стандартних умов?
4. Найбільш сильну окиснювальну дію має суміш двох кислот – азотної і гідрогенфлуоридної. Напишіть рівняння реакції взаємодії вольфраму з цією сумішшю.
5. Наведіть формули сполук, що мають назви: турнбулева синь, берлінська блакить, роданід феруму(III).
6. Яке явище називається пасивацією металу?