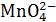Лабораторна робота № 8
Хімія d-елементів VІ, VІІ та VІІІ груп та їхніх сполук
8.1 Мета:
вивчити властивості Хрому, Мангану, Феруму, Кобальту, Нікелю та їх найбільш поширених сполук
8.2 Короткі теоретичні відомості
ХРОМ
Хром – d-елемент VІ групи, як проста речовина – метал середньої активності (φо = -0,74 В). Він взаємодіє з кислотами-неокисниками, але пасивується в концентрованих кислотах-окисниках: азотній, сірчаній, хлорній (HClO4) і хлорнуватій HClO3. Характерними ступенями окиснення Хрому в сполуках є +2, +3 і +6, але найбільш поширеними і стійкими є сполуки Хрому(+3).
Оксид і гідроксид хрому(II) проявляють основні властивості і є сильними відновниками. Сполуки хрому(III) є найстійкішими і найчисленнішими. Оксид і гідроксид хрому(III) є амфотерними основами. З кислотами і розчинами лугів оксид хрому(III) практично не взаємодіє, але в процесі спікання з карбонатом калію і лугами утворює хроміти (наприклад К2СrО2).
Свіжовиготовлений гідроксид хрому(III) легко розчиняється і в розчинах кислот, і в розчинах лугів з утворенням аквакомплексних і гідроксокомплексних солей, наприклад:
2Cr(OH)3 + 3H2SO4 + 6H2O = [Cr(H2O)6]2(SO4)3
Cr(OH)3 + 3KOH = K3[Cr(OH)6]
У ступені окиснення +6 Хром утворює сполуки, властиві неметалам: це хромовий ангідрид CrO3, хромова Н2CrO4 і дихромова Н2Cr2O7 кислота і солі цих кислот. Вони відомі своїми окисними властивостями, які особливо помітні в кислому середовищі :
Cr2O72- + 14H+ + 6е- = 2Cr3+ + 7H2O φо = +1,33 B
МАНГАН І ЙОГО СПОЛУКИ
Вивчення хімічних властивостей Мангану та його сполук має велике пізнавальне значення, пов’язане перш за все з їх різноманітністю і широким спектром застосування.
Манган – d-елемент VІІ групи, метал з середніми відновними властивостями: у ряді напруг він знаходиться між алюмінієм і цинком, його електродний потенціал негативний (-1,18 В). Манган активно взаємодіє з кислотами, але не взаємодіє з лугами.
У його атомі є сім валентних електронів в стані 3d54s2. У сполуках Манган проявляє ступені окиснення +2, +3, +4, +6 і +7. Максимальний ступінь окиснення відповідає його положенню в періодичній системі і кількості валентних електронів в його атомі. Найстійкішим є ступінь окиснення Мангану +4, який він проявляє в природній сполуці – мінералі піролюзиті МnО2. У однотипних сполук Мангану зі збільшенням його ступеня окиснення спостерігається закономірна зміна основно-кислотних і окисно-відновних властивостей. Так, у ряді оксидів основні властивості послаблюються, а кислотні посилюються:
|
MnO |
Mn2O3 |
MnO2 |
MnO3 |
Mn2O7 |
|
основний |
основний |
амфотерний |
кислотний |
кислотний |
Також змінюються основно-кислотні властивості гідроксидів:
|
Mn(OH) 2 |
Mn(OH) 3 |
Mn(OH)4 або H2MnO3 |
H2MnO4 |
HMnO4 |
|
основа |
основа |
амфоліт |
кислота |
кислота |
Окиснювально-відновні властивості сполук Мангану залежать від ступеня його окиснення: металевий манган – відновник, сполуки Мангану(+7) – окисники, а сполуки в проміжних ступенях окиснення мають окисно-відновну двоїстість.
У хімічній практиці як окисник часто використовується перманганат калію KMnO4 в таких середовищах:
|
кисле |
MnO4− + 8H+ + 5е → Mn2+ + 4H2O, |
φо = 1,531 В; |
|
нейтральне |
MnO4− + 2H2O + 3е → MnO2 + 4OH-, |
φо = 0,621 В; |
|
лужне |
MnO4− + 1е → |
φо = 0,558 В. |
ФЕРУМ, КОБАЛЬТ, НІКЕЛЬ
Ферум, Кобальт і Нікель – d-елементи (метали) восьмої групи періодичної системи. Вони є близькими за фізичними і хімічними властивостями, тому їх вивчають спільно як "родина заліза".
У електрохімічному ряді напруг ці метали розташовані в середній частині, до водню. Вони взаємодіють з соляною і розбавленою сірчаною кислотою з виділенням водню і окисненням до двовалентного стану. У концентрованій сірчаній і азотній кислоті метали пасивуються, що дозволяє концентровану H2SO4 перевозити в залізних цистернах. З розбавленою азотною кислотою залізо і кобальт взаємодіють з утворенням Fe(NO3)3 і Co(NO3)3, а нікель – з утворенням Ni(NO3)2. Нікель є стійким до дії лужних розчинів і розплавів; залізо і кобальт взаємодіють з концентрованими (>50 %) розчинами лугів за нагрівання, що свідчить про їх слабку амфотерність.
Для усіх трьох елементів в сполуках характерний ступінь окиснення +2, проте сполуки двовалентного Феруму, як гідроксид, так і солі, окиснюються до тривалентного стану киснем повітря. Сполуки Кобальту(II) і Нікелю(II) є стійкішими за подібні сполуки Феруму; наприклад, сполуки Нікелю(II) окиснюються до Нікелю(III) під впливом сильніших, ніж кисень, окисників: H2O2, NaClO і т.п. З цього можна зробити висновок, що сполуки Кобальту(III) і Нікелю(III) мають окиснювальні властивості. Дійсно, ці властивості спостерігаються в результаті взаємодії Ni(OH)3 і Co(OH)3 з соляною кислотою: замість обмінних відбуваються окисно-відновні реакції з виділенням хлору і утворенням NiCl2 і CoCl2.
Окиснювальні властивості сполук Феруму(III) виражені слабкіше: вони не виділяють хлор з соляної кислоти, але з гідрогенйодидною кислотою HI і її солями (йодидами) окисно-відновні реакції з утворенням йоду можливі. Окисні властивості солей Феруму(III) також можна спостерігати при їх взаємодії з сульфідами лужних металів і амонію: в цих реакціях Ферум(III) відновлюється сульфід-йонами до двовалентного стану і спостерігається утворення FeS і сірки.
Для Феруму, Кобальту і Нікелю характерна велика кількість комплексних сполук. Особливо цікаво спостерігати утворення забарвлених амінокомплексних сполук Кобальту і Нікелю і ціанокомплексних сполук Феруму: берлінській блакиті і турнбулевої сині. Сучасними дослідженнями встановлено, що їх склад однаковий, а різне забарвлення зумовлене різною будовою цих речовин.
Ферум відрізняється від Кобальту і Нікелю існуванням фератів – сполук зі ступенем окиснення Феруму +6. Їх отримують в лужних середовищах дією сильних окисників (Cl2, Br2, O3, NaClO і т.п.) на ферум(III) гідроксид. Усі ферати – сильні окисники.
8.3 Експериментальна частина
Реактиви: Розб. (5%-ні) розчини Cr2(SO4)3, KOH, H2SO4, NH3·H2O, Na2CO3, бромна вода (1). Розчини K2Cr2O7, H2SO4, KI, кристалічні Na2SO3, FeSO4 (2). Розчини MnSO4, KOH, H2SO4, бромна (хлорна) вода (3). Розчини KMnO4, Н2SО4, дист. вода, крист. Na2SO3 (4). Розчини H2SO4, HCl и HNO3; конц. H2SO4, залізні ошурки (5). Сіль Мора (NH4)2SO4·FeSO4·6H2O, KOH, KSCN; сіль кобальту (II), сіль нікелю (II), розчин NaOH, 3%-ный розчин H2O2, дист. вода, бромна вода (6). Розчини K2Cr2O7, FeSO4, H2SO4 FeCl3, КІ (7). Розчини FeSO4, FeCl3 (8). Розчини FeSO4, FeCl3, K3[Fe(CN)6], K4[Fe(CN)6] (9).
Посуд і прилади : штатив з пробірками, спиртівка, сірники, універсальний індикаторний папір.
8.3.1 Сполуки Хрому(III)
Одержання і властивості гідроксиду хрому(III). У пробірку наливають близько 2 мл розчину Cr2(SO4)3 і додають розчин аміаку до випадання сіро-зеленого осаду гідроксиду хрому(III) :
Cr2(SO4)3 + 6NH3·H2O = 2Cr(OH)3↓ + 3(NH4)2SO4
осад ділять на дві частини. До однієї частини додають, перемішуючи, розчин гідроксиду калію до утворення прозорого зеленого розчину, що містить гексагідроксохромат(III)-йони :
Cr(OH)3 +3OH– = [Cr(OH)6]3-
До іншої частини додають, перемішуючи, розбавлену сірчану кислоту до утворення сіро-фіолетового розчину, аквакатіонів хрому(III), що містить:
Cr(OH)3 + 3H3O+ = [Cr(H2O)6]3+
У звіті написати рівняння реакцій одержання гідроксиду хрому(III), його взаємодії з соляною кислотою і лугом, враховуючи, що і в тому, і в іншому випадку утворюються комплексні солі: хлорид гексааквахрому(III) і гексагідроксохромат(III) натрію. Зробити висновок про кислотно-основні властивості гідроксиду хрому(III).
Гідроліз солей хрому(III). Одну краплю розчину солі хрому(III) помістити на шматочок універсального індикаторного папірця. Визначити рН розчину.
Написати рівняння гідролізу в йонній формі. Пояснити, вплив нагрівання розчину на зміщення рівноваги гідролізу.
Незворотній гідроліз солей хрому(ІІІ.). У пробірку наливають 2 мл розчин хром(III) сульфату і додають рівний об’єм розчину карбонату натрію. Спостерігають випадання сіро-зеленого драглистого осаду гідроксиду хрому(III) і виділення діоксиду вуглецю за рахунок безповоротного гідролізу :
Cr2(SO4)3 + 3Na2CO3 +3H2O = 2Cr(OH)3↓ + 3CO2↑ + 3Na2SO4
Відновні властивості солей хрому(III). У пробірці отримати гексагідроксохромат(III) калію. До розчину додати 2-3 краплі бромистої води (Br2 + NaOH), пробірку злегка підігріти. Спостерігати зміну забарвлення розчину.
Cr(OH)3 + NaOH →
Br2 + NaOH →
Na[Cr(OH)4] + NaBrO + NaOH →
У звіті написати рівняння окиснення CrCl3 в лужному середовищі бромистою водою, враховуючи, що поява жовтого забарвлення свідчить про утворення хромату. Урівняти рівняння реакції.
8.3.2 Окиснювальні властивості сполук Хрому(VI)
У три пробірки внести по 4-5 крапель розчину дихромату калію, додати 3-4 краплі сірчаної кислоти. У першу пробірку підлити декілька крапель розчину йодиду калію, в другу додати один мікрошпатель сульфіту натрію і пробірку злегенька підігріти, в третю пробірку внести один мікрошпатель сульфату феруму(II). Спостерігати зміну забарвлення розчинів.
Описати дослід. Написати рівняння реакцій і урівняти їх методом електронного балансу.
8.3.3 Одержання і дослідження властивостей гідроксиду мангану(II)
У три пробірки внести по 2-3 краплі розчину сульфату мангану(II) і в кожну додати по 2-3 краплі розчину лугу; спостерігати утворення осаду Mn(OH)2, відмітити колір осаду. У першу пробірку додати 5-6 крапель сірчаної кислоти. Що відбувається з осадом? Вміст другої пробірки перемішати скляною паличкою – осад змінює забарвлення. У третю пробірку підлити 5-6 крапель бромистої води – забарвлення осаду також змінюється.
Описати дослід. Написати рівняння реакцій : а) одержання гідроксиду мангану(II); б) взаємодії Mn(OH)2 з сірчаною кислотою; в) окиснення його киснем повітря (під час перемішування) з утворенням гідроксиду мангану (IV); г) його окиснення бромистою водою з утворенням MnO2.
MnSO4 + КOH →
Mn(OH)2 + Н2SО4 →
Mn(OH)2 + О2 →
Mn(OH)2 + Вr2 + NaOH →
Зробити висновок про основно-кислотні і окисно-відновні властивості манган(II) гідроксиду.
8.3.4 Вплив середовища на властивості перманганату калію
У трьох пробірках провести паралельно три реакції між перманганатом калію і сульфітом натрію.
У першій пробірці реакція проводиться в кислому середовищі:
KMnO4 + Na2SO3 +H2SO4 = ...
У другій пробірці реакція проводиться в нейтральному середовищі:
KMnO4 + Na2SO3 +H2O = …
У третій пробірці – в лужному середовищі:
KMnO4 + Na2SO3 +KOH = …
Описати зміни в кожній з пробірок в ході реакцій. Закінчити рівняння усіх трьох реакцій, маючи на увазі, що в кислому середовищі перманганат-йони відновлюються до йонів Mn2+, в нейтральному середовищі – до оксиду мангану(IV), а в лужному середовищі – до манганат-йонів. Зробити висновок про те, як змінюються окислювальні властивості перманганату калію від кислого середовища до нейтрального і лужного.
8.3.5 Взаємодія заліза з кислотами
У три пробірки внести по 5 крапель розбавлених розчинів кислот: соляну, сірчану і азотну. У четверту пробірку внести 4 краплі концентрованої сірчаної кислоти. У кожну пробірку помістити по одному шматочку залізної стружки.
Пробірку з концентрованою сірчаною кислотою обережно нагріти. Спостерігати реакції, що відбуваються. Потім в кожну пробірку додати по одній краплі розчину роданіду калію, який з йонами феруму(+3) утворює сполуки Fe(SCN)3 з характерним червоним забарвленням. Переконатися в тому, що в результаті взаємодії заліза з соляною і розбавленою сірчаною кислотою утворюються йони феруму(+2), а з азотною і концентрованою сірчаною кислотою (за нагрівання) – йони Феруму (+3).
У звіті описати дослід, написати рівняння реакцій і сформулювати загальний висновок про взаємодію заліза з кислотами.
8.3.6 Одержання і дослідження властивостей гідроксидів феруму(II), кобальту(II) і нікелю(II)
Гідроксид феруму(II). Розчини солей феруму(II) ніколи не готують заздалегідь, оскільки вони легко окиснюються киснем повітря. Тому в дослідах використовується найбільш стійка кристалічна подвійна сіль – сіль Мора (NH4)2SO4·FeSO4·6H2O або її розчин, який готується безпосередньо перед дослідом (в пробірку насипають один мікрошпатель солі Мору і розчиняють в 6-8 краплях води). У рівняннях реакцій замість формули солі Мору можна користуватися формулою сульфату феруму (II).
У пробірку з 6 краплями розчину солі Мору додати по краплях розчин лугу до випадання осаду Fe(OH)2. Звернути увагу на колір одержаного гідроксиду.
FeCl2 + КOH →
Fe(OH)2 + O2 + H2O →
Перемішати отриманий осад скляною паличкою, спостерігати поступовий перехід забарвлення у бурий колір внаслідок окиснення гідроксиду феруму(II) в гідроксид феруму(III), формулу якого слід записувати у вигляді FeO(OH), оскільки катіон феруму(+3) має сильну поляризуючу дію, наслідком якої у момент утворення Fe(OH)3 є реакція :
Fe(OH)3 = FeO(OH) + H2O
У звіті написати рівняння реакцій : а) утворення гідроксиду феруму(II); б) його окиснення в гідроксид феруму(III) під дією кисню повітря і води; в) перетворення Fe(OH) 3 на гідроксид оксоферуму (III).
Гідроксид кобальту(II). У дві пробірки внести по 6 крапель розчину солі кобальту(II) і додати по краплях розчин лугу. Реакція відбувається. Спочатку з’являється синій осад основної солі Co(OH)Cl, який потім стає рожевим, що вказує на утворення гідроксиду кобальту(II). Осад в одній пробірці розмішати скляною паличкою і залишити на повітрі, а в іншу додати 2-3 краплі 3 %-го розчину пероксиду водню. У якій з пробірок спостерігається окиснення гідроксиду кобальту(II)?
Co(NO3)2 + NaOH→
Co(OH)2 + H2O2→
У звіті описати дослід і написати рівняння реакцій.
Гідроксид нікелю(II). У три пробірки помістити по 6 крапель розчину солі нікелю(II) і додати по краплях розчин лугу до випадання осаду Ni(OH)2. Відмітити колір осаду. У першій пробірці осад перемішати скляною паличкою і залишити на повітрі, в другу додати 2-3 краплі 3 % розчини H2O2, а в третю – 1 краплю бромистої води. У якому випадку відбувається окиснення Ni(OH)2?
Ni (NO3)2 +NaOH→
Ni (OH)2 + Br2 + NaOH →
У звіті описати дослід і написати рівняння реакцій.
За результатами досліду зробити загальний висновок про зміну відновних властивостей сполук у ряді Fe(OH)2 →Co(OH)2 →Ni(OH)2.
8.3.7 Окисно-відновні властивості сполук Феруму(II) і Феруму(III)
Відновні властивості йонів Fe2+. В пробірку помістити 6 крапель розчину дихромату калію, підкислити розбавленою сірчаною кислотою (5-6 крапель), потім додати один мікрошпатель кристалічного сульфату феруму(II). Спостерігати зміну забарвлення розчину.
У звіті написати рівняння реакції, урівняти його методом електронного балансу.
Окиснювальні властивості йонів Fe3+. Провести реакцію одержання йоду і підтвердити його утворення за допомогою якісної реакції. У звіті описати дослід і зробити висновок про окиснювальні властивості сполук феруму(III):
2FeCl3 + 2КІ = І2 + 2FeCl2 + 2КCl
8.3.8 Гідроліз солей Феруму
Гідроліз FeSO4 і FeCl3. Приготувати або узяти з штатива готові розчини сульфату феруму(II) і хлориду феруму(III). За допомогою універсального індикатора визначити водневий показник розчинів.
Описати дослід, написати рівняння гідролізу обох солей. Яка з них (FeSO4 чи FeCl3) і чому в більшій мірі піддається гідролізу? Відповідь мотивувати, використовуючи уявлення про поляризуючі властивості катіонів.
8.3.9 Комплексні сполуки Феруму, Кобальту і Нікелю
Одержання турнбулевої сині і берлінської блакиті. Приготувати в пробірці розчин сульфату Феруму(II) і додати одну краплю червоної кров’яної солі K3[Fe(CN)6]. Спостерігати утворення осаду комплексного сполуки, тривіальна назва якої "турнбулева синь".
K3[Fe(CN)6] + FeSO4 = KFeII,III[FeIII,II(CN)6] + K2SO4
Написати рівняння реакції в молекулярній і йонній формі, навести номенклатурні назви обох сполук.
Помістити в пробірку 2-3 краплі розчину хлориду Феруму(III) і додати одну краплю розчину жовтої кров’яної солі K4[Fe(CN)6]. Спостерігати випадання осаду комплексного сполуки, тривіальна назва якого «берлінська блакить».
K4[Fe(CN)6] + FeCl3 = KFeIII,II[FeII,III(CN)6] + 3KCl
Написати молекулярне і йонне рівняння утворення комплексного сполуки, навести її номенклатурну назву.
У звіті відмітити, що сучасні дослідження показали ідентичність складу турнбулевої сині і берлінської блакиті, які відрізняються тільки будовою комплексів.
8.4 Контрольні питання та завдання
1. Напишіть повну електронну формулу атома Хрому. Вкажіть його валентні електрони. Для валентних електронів побудуйте електронно-графічну формулу. Які можливі ступені окиснення Хрому?
2. Вкажіть найбільш характерні ступені окиснення Хрому, наведіть формули оксидів і гідроксидів хрому у вказаних ступенях окиснення.
3. Напишіть рівняння реакцій, за допомогою яких можна здійснити наступні перетворення : (NH4)2Cr2O7 → Cr2O3 → KCrO2 → Cr(OH)3 → Cr(NO3)3 → Cr2O3
4. Опишіть властивості гідроксиду хрому(III).
5. У якому середовищі стійкішими є хромати металів, а в якому – дихромати? Як з дихромату калію отримати хромат калію?
6. Випишіть усі елементи, що входять в підгрупу Мангану. Вкажіть характер зміни властивостей цих елементів.
7. Які властивості має оксид мангану(II)? Напишіть декілька рівнянь реакцій, що підтверджують його властивості.
8. Наведіть приклади сполук Мангану, що мають тільки окиснювальні, тільки відновні властивості і окиснювально-відновні властивості.
9. Чим зумовлена схожість хімічних властивостей металів тріади Феруму та їх сполук?
10. Вкажіть можливі, характерні й стійкі ступені окиснення Феруму, Кобальту, Нікелю.
11. Напишіть рівняння реакцій, які ілюструють різні способи одержання гідроксиду феруму(III).