Лабораторна робота № 9
Хімія d-елементів І та ІІ групи.
9.1 Мета:
вивчити властивості металевої міді і найважливіших сполук Купруму і Арґентуму; вивчити властивості цинку і його сполук
9.2 Короткі теоретичні відомості
ПІДГРУПА КУПРУМУ
Купрум, Арґентум і Аурум відносяться до d-металів першої групи – це її побічна підгрупа. Ці елементи відомі людині з глибокої давнини.
Фізичні властивості простих речовин цих елементів дуже близькі і багато в чому унікальні: мідь, срібло і золото мають найвищу тепло- і електропровідність, дуже пластичні, кристалізуються в однакових кубічних ґратках. У електрохімічному ряді напруг ці метали розташовані після водню, тому з розбавленою соляною і сірчаною кислотами вони не взаємодіють. Мідь і срібло взаємодіють з азотною і концентрованою сірчаною кислотою, а золото розчиняється в селеновій кислоті і "царській водці".
Купрум в сполуках буває в ступенях окиснення +1, +2, +3. Але найбільш стійким ступенем окиснення Купруму є +2 (CuO, CuСl2, CuSO4 та ін.); сполуки з ступенем окиснення +1 є менш стійкими і, як правило, в розчинах диспропорціонують:
Cu+ = Cu2+ + Cu↓,
а сполуки міді(+3) є найсильнішими окисниками.
Для Арґентуму характерним ступенем окиснення є +1, що пояснюється підвищеною стійкістю передостаннього повністю заповненого електронами d- підрівня (4d10), що сформувався ще у Паладію. Найпоширенішими є сполуки одновалентного Арґентуму – це його нітрат АgNO3, який використовується в аналітичній хімії як надійний реагент для виявлення в розчинах галогенід-йонів, а в медицині як лікарський препарат "ляпіс".
Гідроксиди купруму(II) і арґентуму(I) – нестійкі сполуки: перший розкладається на оксид СuO і воду за 40 – 50оС, а другий – за кімнатної температури. Солі Арґентуму, особливо хлорид і бромід, зважаючи на їх здатність розкладатися під впливом світла з виділенням металевого срібла, використовуються для виготовлення фотоматеріалів.
Найбільш характерний ступінь окиснення Ауруму в сполуках – +3, але природних сполук Аu(ІІІ) мало, оскільки вони, як правило, є термодинамічно нестійкими.
Купрум, Арґентум і Аурум входять до складу багатьох комплексних сполук. На утворенні однієї з комплексних сполук – диціаноаурату(I) натрію заснований найбільш поширений спосіб вилучення золота з піску і гірських порід.
Через відмінності складу і хімічних властивостей сполук Купруму і Арґентуму, вони розглядаються окремо. Аурум і його сполуки через дорожнечу в навчальних хімічних лабораторіях не застосовуються.
ЕЛЕМЕНТИ ПІДГРУПИ ЦИНКУ
Цинк, Кадмій і Гідраргірум знаходяться в побічній підгрупі другої групи періодичної системи. Повне заповнення електронами передостанніх d- орбіталей і зовнішніх s-орбіталей пояснює властивості цих елементів.
Zn, Cd, Hg – м’які, легкоплавкі метали, їх температури плавлення є нижчими в порівнянні з такими для інших d-металів, оскільки спарені d-електрони атомів не беруть участі в утворенні металевого зв’язку. Меркурій, що має температуру плавлення – 38,8 оС, є одним із найбільш легкоплавких металів, що дозволяє використовувати його в термометрах.
У своїх сполуках Цинк, Кадмій і Гідраргірум є завжди двовалентними. Для Гідраргіруму відомі сполуки, в яких він, будучи двовалентним (електронна валентність) проявляє ступінь окиснення +1, наприклад Hg2Cl2, Hg2(NO3)2 та ін. Такі сполуки із зв’язком метал-метал (наприклад: Cl – Hg – Hg – Cl) називаються кластерами (від англійського слова cluster – гроно). Утворення таких сполук у Гідраргіруму пояснюється підвищеною стійкістю 6s2-стану.
Утворення хімічного зв’язку в двоатомних йонах Hg22+ відбувається за донорно-акцепторним механізмом:
Hg: + Hg2+ = [Hg – Hg]2+, де – 6s-орбіталь.
У ряді Zn – Cd – Hg посилюється "благородство" металів, що підтверджується значеннями електродних потенціалів: -0,76 В (Zn); -0,40 В (Cd); +0,85 В (Hg). Тому цинк і кадмій взаємодіють як з розбавленими, так і з концентрованими кислотами. Меркурій з кислотами-неокисниками не взаємодіє, а з азотною кислотою взаємодіє своєрідно: в залежності від концентрації і надлишку кислоти утворюються або Hg(NO3)2, або Hg2(NO3)2:
3Hg + 8HNO3 = 3Hg(NO3)2 + 2NO + 4H2O – за надлишку HNO3,
6Hg + 8HNO3 = 3Hg2(NO3)2 + 2NO + 4H2O – за нестачі HNO3.
Основні властивості оксидів і гідроксидів посилюються від Цинку до Гідраргіруму. Сполуки Цинку ZnO і Zn(OH)2 взаємодіють з розбавленими розчинами лугів за звичайних умов. Амфотерність гідроксиду Кадмію проявляється в жорстких умовах: він взаємодіє з концентрованими розчинами їдких лугів за нагрівання. Оксид Гідраргіруму проявляє тільки основні властивості, а гідроксид Гідраргіруму не існує (розкладається у момент утворення).
Як і усі d-метали, Цинк, Кадмій і Гідраргірум – комплексоутворювачі. Для Цинку і Гідраргіруму характерним є координаційне число 4, для Кадмію – 6. Комплексні сполуки Цинку, Кадмію і Гідраргіруму є безбарвними, зважаючи на повне заповнення електронами d- підрівня.
9.3 Експериментальна частина
Реактиви: Розб. і конц. розчини HCl H2SO4, и HNO3, мідь (1). Розчини CuSO4, NaOH або КОН, розб. H2SO4, конц. NH3·H2O насич. K2CO3 (2). Розчини AgNO3, NaCl, NaВr, KI, 5%-ный Na2S2O3, конц. KOH і конц. NH3·H2O, 3%-ний H2O2 (3). Розб. і конц. HCl H2SO4, и HNO3, гранули цинку (4). Гранули цинку, розчини NaOH і NH3·H2O (5). Розчини ZnSO4 або ZnCl2, NaOH або КОН, NH3·H2O, H2SO4, свіжовиготовлений (NH4)2S (6).
Посуд і прилади : штатив з пробірками, спиртівка, сірники, універсальний індикаторний папір.
9.3.1 Взаємодія міді з кислотами.
Дослідити взаємодію міді з соляною, розбавленою сірчаною, розбавленою азотною кислотами і з концентрованою сірчаною і азотною кислотами. Для цього в п’ять пробірок помістити по одному шматочку міді. У першу пробірку додати 1-2 мл розбавленого розчину HCl, в другу – розбавлений розчин HNO3, в третю – розбавлений розчин H2SO4. У четверту пробірку (під тягою!) додати 1 мл концентрованого розчину HNO3, а в п’яту – 1 мл концентрованого розчину H2SO4 (під тягою!). Звернути увагу на колір газів, що виділяються, і колір розчинів в усіх пробірках.
У звіті написати рівняння реакцій, коефіцієнти підібрати методом електронного балансу. Пояснити різний склад продуктів взаємодії міді з розбавленою і концентрованою сірчаною, з розбавленою і концентрованою азотною кислотами.
9.3.2 Одержання і властивості сполук купруму(II)
Одержання і властивості купрум(II) гідроксиду. У чотирьох пробірках одержати осад купрум(II) гідроксиду взаємодією розчину CuSO4 (5-6 крапель) з розчином лугу (3-4 краплі). Розчин лугу слід додавати обережно (не перебільшити) до утворення блакитного осаду купрум(II) гідроксиду
CuSO4 + 2KOH →
Випробувати відношення гідроксиду міді(II) до нагрівання (нагрівати дуже обережно до кипіння) :
Cu(OH)2 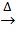
Перевірити розчинність Cu(OH)2 у H2SO4:
Cu(OH)2 + H2SO4 →
Перевірити розчинність Cu(OH)2 у розбавленому і концентрованому розчинах NaOH і аміаку.
Концентрований розчин калій гідроксиду розчиняє осад Cu(OH)2, в результаті чого утворюється бузково-блакитний тетрагідроксокупрат(II) калію:
Cu(OH)2 + 2KOH → K2[Cu(OH)4]
Концентрований розчин аміаку переводить купрум(II) гідроксид в розчинну комплексну сполуку яскраво-синього кольору:
Cu(OH)2 + 4NH3·H2O → [Cu(NH3)4](OH)2 + 4H2O
Описати дослід. Написати рівняння реакцій. Сформулювати висновок про термічну стійкість гідроксиду купруму(II) і його властивості.
Гідроліз солі купруму(II). У пробірку помістити 5-6 крапель розчину сульфату купруму(II) і за допомогою смужки універсального індикатора визначити середовище розчину. Потім в пробірку внести 5-6 крапель насиченого розчину карбонату натрію, відмітити утворення зеленого осаду основного карбонату купруму(II) Cu2(OH)2CO3 (ця речовина, аналогічна за складом природному малахіту).
2CuSO4 + 2К2CO3 + H2O = Cu2(OH)2CO3·+ 2K2SO4+CO2↑
Описати дослід. У звіті написати рівняння реакцій в йонному вигляді. Чому в результаті взаємодії солі купруму(II) з розчином соди не випадає середній карбонат купруму?
Одержання амінокомплексної сполуки купруму(II). До 4-5 крапель 0,1 н. розчину CuSO4 додати 1-2 краплі розчину аміаку. Спостерігати випадання осаду основної солі Cu2(OH)2SO4. Розчинити осад в надлишку аміаку.
2CuSO4 + 2NH3·H2Oнестача → Cu2(OH)2SO4 + (NH4)2SO4
CuSO4 + 4NH3·H2Oнадлишок → [Cu(NH3)4]SO4 + 4H2O
Описати дослід. Відмітити колір розчину. Написати рівняння реакцій.
9.3.3 Властивості сполук Арґентуму(I)
Одержання оксиду арґентуму(I). У пробірку з 3 – 4 краплями арґентум(І) нітрату підлити стільки ж розчину гідроксиду натрію. Відмітити колір осаду арґентум(І) оксиду.
2AgNO3 + 2NаOH = Ag2O↓ + H2O + 2NаNO3
Арґентум(І) гідроксид є нестійкою сполукою, а тому у момент утворення швидко розкладається на арґентум(І) оксид і воду.
До чорного осаду Ag2O, що утворився добавити концентрований розчин аміаку NH3 у воді, внаслідок чого відбувається повне розчинення осаду оксиду срібла(I) Ag2O, що утворився :
Ag2O + 4NH3·H2O = 2[Ag(NH3)2]OH + 3H2O
Одержання малорозчинних галогенідів арґентуму(I). У три пробірки внести по 2-3 краплі розчину арґентум(І) нітрату і додати по 2-3 краплі окремо в кожну пробірку розчинів натрій хлориду, натрій броміду і калій йодиду.
AgNO3 + NaCl →
AgNO3 + NaВr →
AgNO3 + KI →
Відмітити колір осадів, що утворились і зберегти їх для наступного досліду. У звіті написати рівняння реакцій в молекулярному і йонному вигляді.
Одержання комплексних сполук Арґентуму. Кожен осад, взятий з попереднього досліду, розділити на дві частини. До першої додати розчин аміаку, до другої – розчин тіосульфату натрію.
AgCl + 2Na2S2O3 = Na3[Ag(S2O3)2] + NaCl
2AgCl + 4NH3·H2O = 2[Ag(NH3)2] Cl + 4H2O
Чи усі осади розчинилися? Решту рівнянь запишіть самостійно.
Окиснювальні властивості катіона Ag+. У пробірку внести 1-2 краплі розчину АgNO3, 3-5 крапель 3% -го розчину пероксиду водню і 1-2 краплі розчину лугу. Спостерігати утворення дрібнодисперсного металевого срібла. У звіті написати рівняння реакції, урівняти її методом електронного балансу.
9.3.4 Взаємодія цинку з кислотами
У чотири пробірки помістити по одній гранулі цинку і додати по 8-10 крапель кислот: соляної, розбавленої сірчаної, концентрованої сірчаної (пробірку підігріти), розбавленої азотної. Виділення яких газів спостерігається? Йонне рівняння реакції цинку із розбавленою сірчаною і соляною кислотою має такий вигляд :
Zn + 2H3O+ = Zn2+ + H2↑ + 2H2O
запишіть її молекулярне рівняння.
Запишіть молекулярне рівняння взаємодії цинку з розбавленою азотною кислотою, враховуючи, що продуктом відновлення Нітрогену є NО.
У результаті взаємодії цинку із концентрованою сірчаною кислотою продуктом відновлення Сульфуру є SО2
Описати досліди, написати рівняння реакцій, урівняти їх методом електронного балансу
9.3.5 Взаємодія цинку з лугами.
У пробірку з розчином гідроксиду натрію опустити гранулу цинку, спостерігати виділення газоподібної речовини. Написати рівняння реакції, враховуючи, що в ній бере участь вода і утворюється гідроксокомплексна сполука. Йонне рівняння цієї реакції має такий вигляд:
Zn + 2H2O + 2OH- = [Zn(OH)4]2- + H2↑
Іншу гранулу цинку опустити в іншу пробірку – з розчином аміаку. Спостерігається розчинення металу і виділення газу : Zn + 4NH3•H2O = [Zn(NH3)4]2+ + 2OH- + H2↑ + 2H2O
запишіть молекулярні рівняння цих реакцій.
9.3.6 Одержання і властивості сполук Цинку
Одержання і властивості гідроксидів Цинку. У пробірку помістити 5 крапель розчину солі Цинку і додати 2 краплі розчину лугу. Одержаний осад розділити на три частини і досліджувати взаємодію гідроксиду з розчинами соляної кислоти, лугу і аміаку.
У звіті описати дослід. Написати рівняння реакцій в йонному і молекулярному вигляді, зважаючи, що в комплексних сполуках координаційне число цинку дорівнює 4. Зробити висновок про кислотно-основні властивості гідроксидів цинку.
Одержання амінокомплексних сполук Цинку. У пробірку помістити 3 краплі розчину солі Цинку і додати 2 краплі розчину аміаку. Спостерігати випадіння осаду. Потім в пробірку по краплях додати надлишок розчину аміаку. Чи розчиняється осад? Йонні рівняння реакцій мають такий вигляд:
Zn2+ + 2OH- = Zn(OH)2
Zn2+ + 4NH3•H2O = [Zn(NH3)4]2+ + 2H2O
Описати дослід. За допомогою рівнянь реакцій в молекулярному вигляді показати утворення гідроксиду цинку і розчинення його в надлишку аміаку.
Одержання малорозчинних солей Цинку. У пробірку з розчином солі цинку (3 – 4 краплі) додати 1 – 2 краплі свіжовиготовленого розчину сульфіду амонію. Відмітити колір осаду.
9.4 Контрольні питання та завдання
1. Як позначається на властивостях Цинку, Кадмію, Гідраргіруму та їх сполук наявність повністю заповнених s – і р-підрівнів?
2. За допомогою яких реакцій можна довести амфотерність оксиду і гідроксиду цинку? Напишіть рівняння цих реакцій.
3. Порівняйте властивості (амфотерність, стійкість) гідроксидів Цинку, Кадмію і Гідраргіруму.
4. Які ступені окиснення є характерними для Купруму? Наведіть приклади сполук Купруму в цих ступенях окиснення.
5. Який з реактивів дозволить перевести металеву мідь в розчинний стан: HCl, H2SO4(конц), HNO3(конц), H2SO4(розб), ZnSO4, HI, NaOH, Pb(NO3)2
6. Напишіть рівняння реакцій, за допомогою яких можна здійснити наступні перетворення : Cu → CuCl2 → Cu(OH)2 → CuO → [Cu(NH3)4](OH)2
7. До нітрату срібла підлили розчин лугу. Яка сполука випала в осад? Напишіть рівняння реакції.