Лабораторна робота № 2
Будова атома та хімічні властивості речовини
2.1 Мета:
навчитися характеризувати властивості хімічних елементів та їх сполук на основі електронної будови атомів
2.2 Короткі теоретичні відомості
ЕЛЕКТРОННА ОБОЛОНКА АТОМА. КВАНТОВІ ЧИСЛА
Будова атома в сучасній хімії розглядається з позицій квантової механіки, згідно з якою поведінка електрона як мікрочастки ґрунтується на трьох найголовніших положеннях.
1. Корпускулярно-хвильова природа мікрочастинки. Співвідношення хвиля – частинка таке, що зі зменшенням маси частинки її хвильові властивості посилюються. Хвильові властивості електронів експериментально підтверджені їх дифракцією.
2. Квантовий характер енергетичних змін. У системі мікрооб’єктів енергія поглинається і випускається не безперервно, а дискретно (стрибкоподібно), окремими порціями – квантами і, отже, може набувати тільки певних значень, кратних числам квантів.
3. Невизначеність положення і швидкості. Для електрона, згідно із квантовою механікою, не можна точно визначити місцезнаходження навколо ядра, а можна визначити статистичну ймовірність його перебування в даній точці (чи елементі об’єму) простору поблизу ядра. Простір навколо ядра, в якому з найбільшою ймовірністю (90 – 95 %) може перебувати електрон, називається атомною орбіталлю (АО).
Стан електрона в атомі описується чотирма квантовими числами: головним (n – характеризує енергію електрона), орбітальним (l – характеризує форму електронної хмари і його орієнтацію в просторі), магнітним (ml – характеризує орієнтацію електрона відносно магнітної осі атома) і спіновим (ms – характеризує рух електрона навколо своєї осі).
Під час переходу атома з одного стану в інший відбувається перебудова електронної орбіталі, тобто змінюються значення квантових чисел, що супроводжується поглинанням або випусканням атомом квантів енергії.
ПРАВИЛА ЗАПОВНЕННЯ ЕЛЕКТРОНАМИ АТОМНИХ ОРБІТАЛЕЙ
Стійкому (незбудженому) стану багатоелектронного атома відповідає такий розподіл електронів по атомним орбіталям, за якого енергія атома є мінімальною.
Заселення електронами атомних орбіталей (АО) відбувається згідно з принципом найменшої енергії, принципом Паулі і правилом Хунда.
Принцип найменшої енергії вимагає, щоб електрони заселяли АО в порядку збільшення їх енергії (максимуму стійкості системи відповідає мінімум її енергії). Найнижчим за енергією є перший, найближчий до ядра енергетичний рівень з n = 1.
Енергія підрівня, яка визначається формою орбіталі за одного і того ж значення n зростає в такому порядку: енергія ns- підрівня < np < nd < nf.
Зниженою енергією і відповідно особливою стійкістю характеризується конфігурації інертного газу ns2 і ns2np6 (октет).
Порядок заповнення електронами атомних орбіталей визначається правилом Клечковського (правило n+ l):
– заповнення електронних підрівнів зі збільшенням порядкового номера атома елемента відбувається від меншого значення (n + l) до більшого значення (n + l);
– за рівних значень (n + l) заповнюються спочатку енергетичні підрівні з меншим значенням n.
Послідовність заповнення енергетичних рівнів і підрівнів є наступною:
1s→ 2s→2p→ 3s→3p→ 4s→ 3d→ 4p→5s→ 4d→5p→ 6s→ (5d1) → 4f →5d→ 6p →7s→ (6d1) →5f→6d→7p.
Принцип Паулі: в атомі не може бути двох електронів, що характеризуються однаковим набором 4-х квантових чисел. Тому на одній орбіталі може міститися лише два електрони з антипаралельними спінами (ms = ± 1/2). Звідси ємність s- орбіталей – два, р-орбіталей – шість, d- орбіталей – десять і f- орбіталей – чотирнадцять електронів.
Розміщення електронів по атомним орбіталям в межах одного енергетичного рівня визначається правилом Хунда (Гунда): найменшу енергію має електронна конфігурація з максимальним спіном. Тому електрони в межах енергетичного підрівня розташовуються спочатку по одному, а потім якщо електронів більше ніж орбіталей, то вони заповнюються вже двома електронами так щоб сумарний їх спін був максимальним.
Наприклад, якщо на р-орбіталях три електрони, то вони розташовуються так: ↓ ↓ ↓ і сумарний спін Σms = 3/2, а не так: ↑↓ ↓ –, Σms = 1/2
У записі електронних формул (чи конфігурацій) відповідно до наведених правил перша цифра означає енергетичний рівень n, буква після неї – підрівень, а показник степеня – число електронів на цьому підрівні. Наприклад, електронна формула атома Літію – 1s22s1, Карбону – 1s22s22p2, Хлору – 1s22s22p63s23p5.
ЕЛЕКТРОННІ ФОРМУЛИ ЕЛЕМЕНТІВ І ПЕРІОДИЧНА СИСТЕМА Д. І. МЕНДЕЛЄЄВА
ПС побудована таким чином, що заселення нового енергетичного рівня співпадає з початком нового періоду. Номер періоду співпадає з номером зовнішнього валентного шару.
Перший період. У ньому всього два елементи, у яких заселяється 1 рівень – Гідроген (1Н 1s1) і Гелій(2Не 1s2).
Другий період. У елементів другого періоду на зовнішньому енергетичному рівні (n = 2) – два підрівні (одна s – і три p- орбіталі). Тому після двох s- елементів – Літію 3Li 1s22s1 і Берилію 4Ве 1s22s2 – з’являються шість p- елементів від бору 5В 1s22s22p1 до неону 10Ne 1s22s22p6. Число елементів в другому періоді – 8 – відповідає максимально можливому числу електронів на другому енергетичному рівні (два s – плюс шість р-електронів).
У третьому періоді заповнюється третій енергетичний рівень, що складається з 3s-, 3p, – і 3d-підрівнів. Проте, в ньому всього вісім елементів – електронних аналогів другого періоду: два s- (11Na 3s1 і 12Mg 3s2) і шість р- елементів від Алюмінію (Al) до Аргону (Ar). Благородний газ аргон 18Аr3s23p6 завершує третій період, таким чином, п’ять d- орбіталей (ℓ = 2) третього енергетичного рівня залишаються незаселеними.
Четвертий період. У Калію і Кальцію електрони заселяють s- орбіталь четвертого енергетичного рівня: 19К 3d04s¹ і 20Ca 3d04s². У наступних після Кальцію елементів від Скандію до Цинку заповнюється 3d-підрівень. Енергія заселеної 3d-орбіталі, відповідно до її положення є нижчою за енергію 4s-орбіталі й істотно нижчою за енергію 4р-орбіталі.
Таким чином, 3d-орбіталь, що належить 3-му енергетичному рівню, починає заселятися лише в IV періоді, тобто з відставанням на 1 період. Відповідно 4d-орбіталь заселятиметься в 5 періоді, 5d-орбіталь – в шостому, 6d-орбіталь – в сьомому. Елементи, у яких заповнюються внутрішні d- підрівні, утворюють вставні декади і називаються d- елементами.
У атомів таких елементів як Хром і Купрум спостерігається проскакування (провал) одного 4s-электрона на 3d-підрівень: 24Cr 3d54s1, 29Сu 3d104s1, що пояснюється як пониженням енергії d- підрівня, так і прагненням до утворенням стійких наполовину і повністю заповнених електронних конфігурацій відповідно d5 і d10.
Усі 3d-елементи – метали з нижчим ступенем окиснення +2, що проявляється за рахунок зовнішніх s- електронів. Нижчий ступінь окиснення 3d-елементів стабілізується в періоді зліва направо (Со+2, Ni+2, Cu+2), тоді як стійкість їх сполук у вищому ступені окиснення знижується в тому ж напрямі.
Утворення катіонів d- елементів пов’язане з втратою передусім зовнішніх ns- електронів і тільки тоді (n – 1) d- електронів. Наприклад:
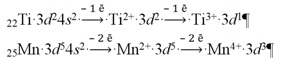
Після десяти d- елементів в четвертому періоді з’являються 4р-елементи від Галію 31Gа 3d104s24р1 до криптону 36Кr 3d104s24p6. Заповнений десятьма електронами попередній 3d-підрівень у них є невалентним. Незаселеними залишаються 4d – і 4f-підрівні. Всього в четвертому періоді 18 елементів.
У п’ятому періоді розміщені також 18 елементів – електронних аналогів елементів 4 періоду: два – 5s-, десять – 4d -(39 – 48) і шість – 5р- (49 – 54) елементів. Проте в електронних конфігураціях, ступенях окиснення, що проявляються, і властивостях 3d- і 4d-елементів разом зі схожістю спостерігаються деякі відмінності через наявність у останніх вакантного 4f-підрівня.
Це стабілізує 4d-подуровень (зменшує міжелектронну взаємодію) і призводить до провалу на нього електронів з 5s-орбіталі в усіх (окрім Технецію 43Тс 4d54f05s2) d- елементів 5 періоду, починаючи з Ніобію. У Nb, Mo, Ru, Rh, Ag з 5s – на 4d-орбіталь переходить один s-електрон, а у Паладію відразу обидва: 46Pd 4d104f05s0. Арґентум, що розміщений за Паладієм, 47Ag 5s1 і Кадмій 48Сd 4d105s2 – останні з 4d-елементів. Шість 5р-елементів від Індію до Ксенону (49 – 54) є електронними аналогами р-елементів попередніх періодів. П’ятий період завершується р-елементом Ксеноном 54Xe 4d105s25p6; в той же час залишаються вакантними 4f-, 5d-, і 5f-підрівні.
Аналізуючи послідовність заповнення електронами енергетичних рівнів, можна зробити такі висновки:
1. Номер періоду співпадає зі значенням головного квантового числа зовнішнього енергетичного рівня.
2. Початок кожного періоду співпадає з початком нового енергетичного рівня.
3. Кожен період розпочинається з двох s- елементів.
4. Кожен період (окрім першого) завершується шістьма р- елементами.
5. Заповнення s- і p- орбіталей відбувається на зовнішньому валентному рівні, який збігається з № періоду.
6. d-Підрівень заповнюється з відставанням на 1 період (3d – в 4-му періоді, 4d – в п’ятому, 5d – в шостому і так далі).
7. d- Елементи в ПС завжди передують р-елементам.
8. f- Підрівень заповнюється з відставанням на 2 періоди (4f – в шостому, 5f – в сьомому періоді).
9. f- Елементи в ПС розташовуються перед d- елементами.
10. Енергії (n – 2) f-, (n – 1)d – і ns- підрівнів є приблизно однаковими і завжди меншими за енергію р-підрівня.
11. У першому періоді розташовані два елементи. У другому – 8 елементів (два s – і шість р-елементів, №/№ 3 – 10). У третьому – 8 елементів (два s – і шість р-елементів, №/№ 11 – 18). У четвертому – 18 елементів (два s-, шість р- і десять d- елементів, №/№ 19-36). У п’ятому – 18 елементів (два s-, шість р- і десять d- елементів, №/№ 37-54). У шостому – 32 елементи (два s-, шість р-, десять d – і 14 f – елементів, №/№ 55-86). Сьомий період є незавершеним.
ПЕРІОДИ І ГРУПИ
Період – горизонтальний ряд, що має однакове число орбіталей, номер періоду співпадає зі значенням головного квантового числа зовнішнього рівня.
По вертикалі періодична система поділяється на вісім груп, які діляться на головні (А) – складаються з s- і р-елементів, і побічні (В) підгрупи – містять d- елементи. VI В і VІІ В підгрупи, окрім d- елементів, містять по чотирнадцять 4f – і 5f-элементов.
Схожість елементів усередині кожної групи – найбільш важлива закономірність в періодичній системі. Існує ще і така закономірність в зміні властивостей як діагональна схожість у пар елементів Li і Mg, Ве і Al, B і Si та ін. Ця закономірність зумовлена тенденцією зміни властивостей як по вертикалі (у групах), так і по горизонталі (у періоді).
У головних підгрупах валентні електрони (електрони, які здатні утворювати хімічні зв’язки) розташовані на s – і р-орбіталях зовнішнього енергетичного рівня, в побічних – на s- орбіталях зовнішнього і d- орбіталях передостаннього рівня. Для f- елементів валентними є (n – 2)f-, (n – 1)d – і ns- електрони.
ПЕРІОДИЧНІСТЬ ГЕОМЕТРИЧНИХ І ЕНЕРГЕТИЧНИХ ХАРАКТЕРИСТИК АТОМІВ
Зміна радіусу атомів. Атоми і йони не мають певних меж, тому виміряти абсолютні розміри атомів неможливо. За радіус вільного атома можна прийняти теоретично розраховане положення головного максимуму густини зовнішніх електронних хмар. Це так званий орбітальний радіус. Ефективні радіуси визначалися з експериментальних даних за між'ядерними відстанями в молекулах і кристалах. Орбітальний радіус є ближчим до істинного розміру атома, ніж ефективний.
Зміна орбітальних і ефективних атомних радіусів елементів носить періодичний характер: в періодах орбітальні атомні радіуси зі збільшенням заряду ядра (Z) зменшуються.
Найбільше зменшення радіусів спостерігається у ряді р-елементів. В межах кожного ряду найбільший орбітальний радіус має лужний метал, а найменший – атоми благородних газів (порівняйте: rLi = 0,159 нм; rNe = 0,032 нм).
В рядах d – і f- елементів зменшення радіусів носить назву d- і f- стиснення. На відміну від зменшення радіусів р-елементів воно не таке помітне, оскільки йде заповнення електронами внутрішніх рівнів (порівняйте: rSc = 0,157 нм; rZn = 0,107 нм).
У підгрупах радіуси в основному збільшуються внаслідок зростання числа енергетичних рівнів n.
Найбільша зміна радіусів, як і в періодах, спостерігається в групах s – і р-елементів, а у d- елементів радіуси електронних аналогів V і VI періодів під впливом лантаноїдного стискування практично однакові, що визначає близькість властивостей цих елементів і знаходження в природі в одних породах.
2.3 Експериментальна частина
Реактиви. Дистильована вода, метали: літій, натрій, калій, магній, алюміній, спиртовий розчин фенолфталеїну. Розчини НCl і НNO3, цинк, плюмбум, мідь.
Посуд і прилади. Пробірки, пінцет, фільтрувальний папір, скляна паличка спиртівка або сухий спирт, пробіркотримач, сірники.
2.3.1 Зміна металічних властивостей атомів елементів
Взаємодія металів з водою. У три порцелянові чашки з дистильованою водою помістіть шматочки (0,1-0,3 г) літію, натрію і калію; а у дві пробірки з водою – шматочки магнію і алюмінію. Спостерігайте хід реакцій без нагрівання, а також за нагрівання (у випадку магнію і алюмінію). Необхідно впевнитися у тому, що в усіх випадках утворилися відповідні гідроксиди. Як це зробити? За поведінкою (активністю) взаємодії металів з водою зробіть висновок про зміну металічних властивостей у І А групі зверху вниз.
Взаємодія металів з азотною кислотою. У три пробірки (на 1/3 об’єму) налийте розчин азотної кислоти. У першу пробірку занурте шматочок цинку, у другу – плюмбуму, а у третю – міді. Другу і третю пробірки підігрійте. Що сталося з металами, чи змінився колір розчину? Які ще спостерігаються ознаки хімічної реакції? Складіть рівняння реакції. Заповніть таблицю 2.1.
Таблиця 2.1 – Результати експерименту
|
До реакції |
Після реакції |
||
|
Хімічний знак атому металу |
Електронна формула атому |
Хімічний знак йону металу |
Електронна формула йону |
|
Zn Pb Сu |
|
|
|
2.3.2 Зміна неметалічних властивостей атомів елементів
У дві пробірки налийте окремо по 1 мл розчину калій йодиду і калій броміду. У першу добавте 1 мл бромної води, а у другу пробірку з розчином калій броміду – 1 мл хлорної води. Чи спостерігається зміна забарвлення розчинів?
У звіті запишіть відповідні рівняння реакції. На прикладі елементів VІІ А групи зробіть висновок про зміну неметалічних властивостей в групах зверху вниз.
2.4 Контрольні питання та завдання (для підготовки до семінарської частина роботи)
- Основні положення квантової (хвильової) механіки.
- Квантові числа та їх інтерпретація (охарактеризувати значення n, l, ml, ms).
- Принцип найменшої енергії.
- Послідовність заповнення енергетичних рівнів. Правило В. М. Клечковського.
- Принцип Паулі. Ємність енергетичних рівнів і підрівнів.
- Правило Хунда. Які орбіталі називаються виродженими
- Електронні формули. Валентні електрони.
- Характеристика властивостей елементів та їхніх сполук за такою схемою: 1) електронна формула; 2) період; 3) група; 4) підгрупа; 5) родина; 6) метал чи неметал; 7) вищий ступінь окиснення; 8) формула вищого оксиду та його кислотно-основні властивості; 9) формула відповідної кислоти чи гідроксиду. (Кожен пункт відповіді пояснити).
- Періодичний закон і періодична система елементів. Періоди і родини елементів. Групи і підгрупи.
- Види аналогій (горизонтальна, вертикальна, діагональна, валентна; навести приклади).