Лабораторна робота № 3
Хімічний зв’язок і властивості речовини
3.1 Мета:
вивчити основні типи хімічного зв’язку і на цій основі вміти встановлювати кореляцію між типом хімічного зв’язку в молекулах та хімічними, фізико-хімічними і фізичними властивостями речовин
3.2 Короткі теоретичні відомості
ТИПИ ХІМІЧНОГО ЗВ’ЯЗКУ
Розрізняють п’ять основних типів зв’язку (рисунок 3.1): ковалентний, йонний, металевий, водневий і ван-дер-ваальсовий. Основним типом внутрішньомолекулярного хімічного зв’язку є ковалентний.
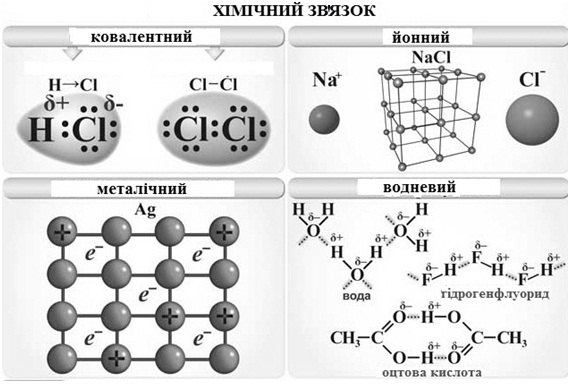
Рисунок 3.1 – Типи хімічних зв’язків
Ковалентний зв’язок – хімічний зв’язок між двома атомами, який здійснюється спільною парою електронів, що утворюється внаслідок перекриванням електронних орбіталей взаємодіючих атомів.
В залежності від природи атомів, які взаємодіють між собою, спільна електронна пара може однаково належати атомам, що взаємодіють між собою або зміщуватись в той чи інший бік. Для оцінки здатності атома даного елемента, що утворює зв’язок, зміщувати електрону густину, користуються значенням відносної електронегативності (ЕН). Чим більше ЕН атома, тим сильніше притягує він узагальнені електрони. Причому, спільна електронна пара зміщується до атома з більшою ЕН в тим більшій мірі, чим більшою є різниця електронегативності (ΔЕН) атомів, що взаємодіють. В результаті несиметричного розподілу електронної густини між атомами з різною ЕН зв’язок стає полярним. З ростом ΔЕН ступінь ковалентності зв’язку зменшується і зростає ступінь йонності зв’язку. Значення ЕН атомів деяких елементів наведені в таблиці 3.1.
Таблиця 3.1 – Відносна електронегативність атомів
|
H |
|
|
|
|
|
|
|
2,2 |
|
|
|
|
|
|
|
Li |
Be |
B |
C |
N |
O |
F |
|
1,0 |
1,5 |
2,0 |
2,5 |
3,0 |
3,5 |
4,0 |
|
Na |
Mg |
Al |
Si |
P |
S |
Cl |
|
0,9 |
1,2 |
1,5 |
1,8 |
2,1 |
2,5 |
3,0 |
|
K |
Сa |
Ga |
Ge |
As |
Se |
Br |
|
0,8 |
1,0 |
1,6 |
2,0 |
2,0 |
2,4 |
2,9 |
|
Rb |
Sr |
In |
Sn |
Sb |
Te |
I |
|
0,8 |
1,0 |
1,7 |
1,8 |
1,9 |
2,1 |
2,5 |
Ковалентний зв’язок – це міцний хімічний зв’язок, він може об’єднувати атоми не лише в молекули, але і в кристали.
Найважливішими характеристиками ковалентного зв’язку є: насичуваність (здатність елементів утворювати певну кількість зв’язків); напрямленість (просторова напрямленість); поляризованість (здатність зв’язку перетворюватись на полярний (або більш полярний) під впливом зовнішнього електростатичного поля).
Йонний зв’язок – міцний хімічний зв’язок, що утворюється між атомами з великою різницею електронегативності (ΔЕН > 1,7 за Полінгом) в результаті зміщення електронної густини до найбільш електронегативного атома. Між йонами, що утворилися, виникає електростатичне притягання, яке називається йонним зв’язком (рисунок 3.1).
Повного 100% зміщення електронної густини до атома з більшою ЕН не відбувається навіть в найбільш йонних сполуках, якими є бінарні сполуки лужних металів з галогенами. Це пояснюється, зокрема, впливом зарядів йонів, що утворилися, на електронні оболонки один одного, тобто їх взаємною поляризацією. Прикладом може бути сполука CsF, в якій за ΔЕН = 3,3 "ступінь йонності" складає 97%.
На відміну від ковалентного зв’язку, характеристиками йонного зв’язку є ненапрямленість і ненасичуваність. А характеристикою сполук йонного типу є добра розчинність в полярних розчинниках (вода, кислоти і т. д.).
Металевий зв’язок (рисунок 3.1). Відмінною характеристикою атомів металів є те, що число валентних електронів менше ніж число валентних орбіталей. У вузлах кристалічних ґраток металів знаходяться позитивні йони, а в міжвузлях – валентні електрони ("електронний газ"), які здійснюють зв’язок між йонами і легко пересуваються усередині кристалу. Навіть невелике збудження призводить до міграції електронів. Цим пояснюється висока тепло- і електропровідність металів.
Ван-дер-ваальсовий зв’язок – це найбільш універсальний вид міжмолекулярної взаємодії. Він відноситься до зв’язку невалентного типу, що виникає без передачі атомами електронів.
Міжмолекулярні взаємодії здійснюються за допомогою кулонівських сил взаємодії між електронами і ядрами однієї молекули і ядрами і електронами іншої.
Розрізняють такі види сил міжмолекулярної взаємодії: орієнтаційні (диполь-дипольна між полярними молекулами), індукційні, або поляризаційні (дія полярної молекули на неполярну) і дисперсійні (проявляються під час взаємодії будь-яких атомів і молекул в результаті виникнення миттєвих мікродиполів, індукованих рухом електронів і коливанням ядер). Міжмолекулярна взаємодія не призводить до розриву або утворення нових хімічних зв’язків валентного типу. Вона зумовлює перетворення речовини із газоподібного стану в рідкий і далі в твердий.
Водневий зв’язок (Н-зв’язок) є важливим типом міжмолекулярних взаємодій. Цей зв’язок виникає між молекулами, в яких атом Гідрогену зв’язаний з атомами, що мають велику електронегативність і малий радіус (F, O, N). Між такими молекулами виникають додаткові хімічні зв’язки невалентного типу, що називаються водневими. Здійснюються такі зв’язки за рахунок сил електростатичного притягання, але певний внесок має і донорно-акцепторна взаємодія, що визначає просторову напрямленість водневих зв’язків. Чим більшою є ЕН елемента-партнера і меншим його розмір, тим міцнішим є водневий зв’язок. Н-зв’язок є на порядок слабкішим за ковалентний і тому легко руйнується. Схематично водневий зв’язок представлений на рисунку 3.1.
У сполуках з водневими зв’язками утворюються асоціати, що призводить до зміни фізичних властивостей речовин: підвищуються теплоти випаровування, температури кипіння і плавлення.
Водневий зв’язок може бути як міжмолекулярним, так і внутрішньомолекулярним (рисунок 3.1), переважно в молекулах органічних сполук.
Він відіграє велику роль в хімії органічних сполук, полімерів і білків, в молекулах ДНК і РНК.
ХІМІЧНИЙ ЗВ’ЯЗОК В ТВЕРДИХ РЕЧОВИНАХ.
Властивості твердих речовин визначаються природою частинок, що знаходяться у вузлах кристалічної ґратки, їх розташуванням і типом зв’язків, між цими частинками (рисунок 3.2; таблиця 3.2).
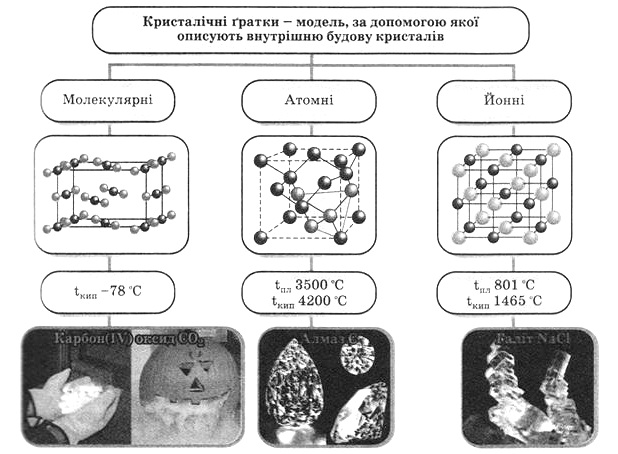
Рисунок 3.2 – Типи хімічних зв’язків
Таблиця3.2 – Класифікація кристалів за типом хімічного зв’язку
|
Тип кристалу |
Структурні частинки |
Сили між частинками |
Властивості |
Приклади |
|
Атомний |
Атоми |
Ван-дер-ваальсова (дисперсійна) взаємодія |
М’якість, низька температу-ра плавлення, погані тепло-, та електропровідність |
Благородні гази – Аr, Kr, та ін. |
|
Молекулярний |
Полярні або неполярні молекули |
Ван-дер-ваальсові та водневі зв’язки |
Помірна м’якість, температу-ра плавлення від низької до помірно високої, погані тепло- і електропровідність |
H2, N2, СН4, цукор, СО2 |
|
Йонний |
Позитивно і негативно заряджені йони |
Йонний зв’язок |
Твердість і крихкість, висока температура плавлення, погані тепло- і електропровідність |
Типові солі: NaCl, Ca(NО3)2 та ін |
|
Ковалентний |
Атоми |
Ковалентний зв’язок |
Висока твердість, дуже висока температура плавлен-ня, погані тепло- і електро-провідність |
Алмаз, BN, кварц SiО2, карбіди, силіциди |
|
Металевий |
Катіони металів у вузлах кристалічн. ґраток |
Металічний і ковалентний зв’язок |
Ступінь твердості – різна, температура пл. від низької до дуже високої, високі тепло- і електропровідність, ковкість, блиск, пластичність |
Усі метали (Fe, Al, Pb, Cu та ін.) |
Основні характеристики хімічного зв’язку
Хімічний зв’язок в молекулах зумовлений перекриванням валентних орбіталей взаємодіючих атомів і супроводжується зменшенням повної енергії системи. В залежності від способу перекривання і симетрії орбіталі, що утворюється, розрізняють σ-, π- і δ-зв’язки.
σ-Зв’язок (сигма-зв’язок) утворюється в результаті перекривання електронних орбіталей уздовж лінії, що з’єднує центри атомів. У випадку σ-зв’язку відбувається максимальне перекривання орбіталей і тому, саме σ-зв’язок відповідає за геометрію молекули.
Між двома атомами можливий тільки однин σ-зв’язок:
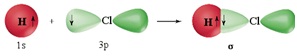
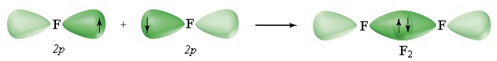
π-Зв’язок (пі-зв’язок) виникає в результаті перекривання атомних орбіталей вздовж ліній, перпендикулярних тій, що з’єднує центри атомів (тобто ділянка перекривання знаходиться над і під лінією, що з’єднує центри атомів):
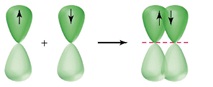
В результаті додаткового перекривання атомних орбіталей за рахунок π-зв’язку між атомами виникають кратні зв’язки: одинарний (F – F); подвійний (O=O); потрійний (N≡N).
Хімічний ковалентний зв’язок характеризується довжиною, валентним кутом і енергією.
Довжина зв’язку – відстань між ядрами атомів, що утворюють сполуку. Довжини зв’язків зазвичай знаходяться в межах від 0,1 до 0,27 нм (Н2 – 0,075; N2 – 0,110; О2 – 0,121, I2 – 0,267). Зміна довжин зв’язків в схожих сполуках пов’язана зі зміною ефективних радіусів елементів, що входять в ці сполуки, наприклад, для HF, HCl, HBr і HI довжини зв’язків змінюються відповідно: 0,100; 0,127; 0,141; 0,162 нм.
Валентний кут – кут між уявними лініями, що з’єднують центри атомів у напрямі дії хімічного зв’язку:
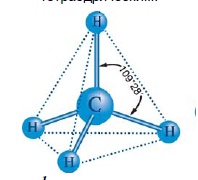
Валентні кути, як і довжини зв’язків, експериментально визначають з високою точністю.
Характеристикою міцності хімічного зв’язку є енергія зв’язку Езв – енергія, яка необхідна для розриву (дисоціації) зв’язків в молекулі з одержанням нейтральних атомів. Вимірюється в електронвольтах (еВ) для одного зв’язку або в кДж/моль для одного моля зв’язків. Так, енергія зв’язку Н-Н в молекулі Н2 рівна 435 кДж/моль, а середня енергія одного зв’язку С-Н у багатоатомній молекулі СН4 рівна Едисс (СН4 /4) = 1648/4 = 412 кДж/моль.
Обмінний і донорно-акцепторний механізми утворення зв’язку
Розрізняють два механізми утворення ковалентного зв’язку – обмінний і донорно-акцепторний.
У випадку обмінного (спінового) механізму в утворенні зв’язку беруть участь неспарені електрони взаємодіючих атомів. Кожен атом дає по одному неспареному електрону з антипаралельними спінами в загальну електронну пару, що забезпечує одинарний зв’язок:
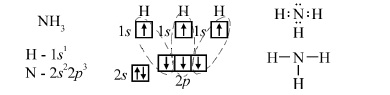
Число неспарених електронів може збільшитися в результаті збудження атома. Наприклад, атом Карбону за рахунок двох неспарених електронів може утворити тільки два ковалентні зв’язки. Але, якщо атому Карбону надати деяку додаткову енергію, то один з 2s-електронів перейде на вільну 2р-орбіталь і неспарених електронів стане вже чотири. У такому стані атом Карбону може утворити чотири ковалентні зв’язки, наприклад, з атомами водню.
У атомів N, O, F такої можливості немає через відсутність вакантних орбіталей на валентному рівні, тому їх максимальна валентність за обмінним механізмом (валентність) відповідно дорівнює 3, 2, 1.
Отже, валентність елемента за обмінного механізму утворення зв’язку визначається числом неспарених електронів в основному (Е) і збудженому станах (Е*) атома.
Донорно-акцепторний механізм. Один атом (донор) надає електронну пару, а інший атом (акцептор) надає для цієї пари вільну орбіталь.
Донорно-акцепторний механізм реалізується, наприклад, під час взаємодії молекули ВН3 з аніоном :Н-:
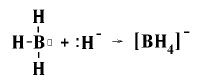
Молекула ВН3 виступає як акцептор електронної пари, а гідрид-йон :Н− в якості "постачальника" електронів – донора. Таким чином, в комплексному аніоні ВН4− атом Бору утворює ще однин четвертий ковалентний зв’язок за донорно-акцепторним механізмом.
Максимальна валентність (ковалентність) атомів проявляється у випадку використання обох механізмів утворення зв’язку і називається насичуваністю.
У елементів 2-го періоду насичуваність дорівнює сумі неспарених електронів, неподілених електронних пар і вакантних АО зовнішнього енергетичного рівня, тобто числу валентних АО. Оскільки в 2-му періоді є чотири такі АО – 2s, 2рх, 2ру, 2рz, то і насичуваність зв’язку усіх елементів цього періоду рівна чотирьом. У елементів III – VII періодів валентними можуть бути (n – 1)d-, ns- і np-орбіталі, а у f-елементів в утворенні зв’язку беруть участь електрони умовно валентної f- орбіталі.
Число загальних електронних пар між двома взаємодіючими атомами називається кратністю зв’язку (К). Так, в молекулі діоксиду вуглецю О=С=О обидва зв’язки є подвійними (1σ- і 1π-, К = 2); у молекулі оксиду вуглецю C≡О кратність зв’язку дорівнює 3 (1σ- і 2π-).
Гібридизація атомних орбіталей
Гібридизація – процес перебудови (вирівнювання) різних за формою і енергією валентних атомних орбіталей під час утворення зв’язків в молекулі. Гібридні орбіталі (ГО) мають однакову форму і енергію. В порівнянні з орбіталями хімічно незв’язаного атома вони є більш витягнутими у напрямі утворення хімічних зв’язків, що сприяє кращому перекриванню електронних орбіталей і утворенню міцнішого зв’язку.
Основні положення теорії гібридизації :
1. Гібридизуються валентні АО, близькі за енергією. Здатність до гібридизації в періоді і групі зменшується через те, що із зростанням заряду ядра (Z) зростає також і енергетична різниця між s- і р-орбіталями.
2. Орбіталі, що гібридизуються повинні мати приблизно однакову симетрію відносно напряму взаємодії.
3. Гібридні орбіталі, завдяки своїй формі, забезпечують максимальне перекривання АО у напрямі локалізованих σ-зв’язків і відповідають за геометрію молекули.
4. У гібридизації можуть брати участь вільні валентні орбіталі, орбіталі, заселені одним електроном і неподіленими електронними парами.
5. Гібридні орбіталі утворюють тільки σ-зв’язки.
6. Кількість гібридних орбіталей дорівнює кількості початкових АО, що беруть участь в гібридизації.
Геометрія молекул
Пояснити геометрію молекул допомагає теорія відштовхування електронних пар (метод Джілеспі), яка базуються на тому, що зв’язок здійснюється за рахунок пари електронів, а геометрична будова молекул та йонів визначається загальним числом електронних пар, що оточують центральний атом. Крім того повинні виконуватись наступні правила:
– електронні пари (поділені і неподілені) розташовуються навколо центрального атома так, щоб їх відштовхування було мінімальним, тобто на максимальній відстані одна вів одної;
– неподілена електронна пара займає більший об’єм, ніж поділена;
– дві електронні пари подвійного зв’язку займають більший об’єм, ніж одна електронна пара одинарного зв’язку.
В таблиці В 1 (додаток В) наведена просторова конфігурація молекули за методом Джілеспі.
Дипольний момент молекули
В залежності від характеру розподілу електронної густини, зв’язок між атомами в молекулі може бути неполярними і полярними. Неполярний зв’язок утворюється в гомоядерних молекулах типу А2, а також між різними атомами з однаковою електронегативністю. У випадку різної ЕН атомів зв’язок є полярним, так як спільна електронна хмара зміщена до більш електронегативного атома. Виникає диполь, тобто система з двох рівних за величиною і протилежних за знаком зарядів (+δ і – δ), відстань між центрами яких називають довжиною диполя (l).
Полярність зв’язку і двохатомної молекули залежить тільки від ΔЕН взаємодіючих атомів і оцінюється дипольним моментом μ:
μ = q×l, (3.1)
де q = │δ│.
Дипольний момент вимірюють в кулонметрах (Кл×м) або в Дебаях(D) 1D = 0,333×1029 Кл×м.
Полярні зв’язки за інших рівних умов (довжині і кратності зв’язку) є міцнішими за неполярні.
3.3 Експериментальна частина
Реактиви. Розчини FeSO4, FeCl3 (1). Розчини AgNO3, KI, KBr, KCl (2). Дист. вода, метали: літій, натрй, калій, магній, алюміній, спиртовий розчин фенолфталеїну (3). Розчини НCl і НNO3, цинк, плюмбум, мідь (4).
Посуд і прилади. Пробірки, пінцет, фільтрувальний папір, скляна паличка спиртівка або сухий спирт, пробіркотримач, сірники.
3.3.1 Вплив природи хімічного зв’язку на здатність солей до гідролізу
У окремі пробірки внести по 2 краплі розчинів ферум(ІІ) сульфату і ферум(ІІІ) хлориду. За допомогою універсального індикатору визначити рН цих розчинів. За значеннями рН зробити висновок, яка сіль більше піддається гідролізу, враховуючи, що для солей, які гідролізується за катіоном, чим менше значення рН розчину тим сильніше гідролізується сіль, що пов’язане зі збільшенням ковалентності зв’язку між катіоном та аніоном. Ковалентність зв’язку між Fe3+ і Cl–-йоном в молекулі FeCl3, є більшою в порівнянні з такою в молекулі FeSO4.
3.3.2 Вплив характеру хімічного зв’язку на розчинність солей Арґентуму
У чотири пробірки налити по 1 мл розчину арґентум(І) нітрату, потім послідовно у кожну добавити по 0,5 мл розчинів з Сн=2,0: калій йодиду, калій броміду, калій хлориду та калій флуориду. Зазначити, у яких пробірках утворилися осади та якого вони кольору. Найменш розчинним із утворених осадів є арґентум(І) йодид внаслідок більшої ковалентності хімічного зв’язку між атомами арґентуму і йоду, що пояснюється збільшенням радіусу атомів від Флуору до Йоду, а разом з цим і зростанням здатності до поляризації Йоду. Йонний зв’язок між атомами Арґентуму і Флуору у молекулі AgF пояснює причину помітної розчинності цієї сполуки у воді. У звіті написати рівняння відповідних реакцій.
3.3.3 Взаємодія молекул з різним типом хімічного зв’язку
У пробірку налити 1 мл розчину НСl з Сн=0,1 додати 1 мл розчину NH3Н2О з Сн=0,1.
Написати рівняння реакції, дати назву солі. Вказати тип хімічного зв’язку в катіоні амонію. Яка речовина утворюється в результаті взаємодії газоподібних НСl і NH3?
3.4 Контрольні питання та завдання (для підготовки до семінарської частини роботи)
- Ковалентний зв’язок (види, характеристика, приклади), механізми його утворення (обмінний і донорно-акцепторний).
- Йонний зв’язок та його характеристики
- Металевий зв’язок та його особливості.
- Міжмолекулярні зв’язки.
- Хімічний зв’язок в твердих речовинах.
- Основні характеристики хімічного зв’язку : енергія, довжина зв’язку, валентний кут, полярність.
- Гібридизація атомних орбіталей.
- Визначити тип хімічного зв’язку у наступних сполуках: СO2, BF3, NH3, SrBr2, Cl2, Ca3(PO4)2, ClO–. Для сполук із ковалентним полярним зв’язком визначити тип гібридизації.