Класифікація і номенклатура неорганічних сполук
Речовини поділяються на прості і складні. Прості речовини складаються з атомів одного хімічного елементу, а складні – з атомів різних елементів. Складні речовини називаються хімічними сполуками.
Прості речовини поділяються на метали і неметали. До неметалів відносяться речовини, утворені атомами двадцяти двох хімічних елементів: Гідрогену, благородних газів, галогенів, Оксигену, Сульфуру, Селену, Телуру, Нітрогену, Фосфору, Арсену, Карбону, Силіцію, Бору. Усі інші хімічні елементи і їх прості речовини – метали.
Основними класами неорганічних – сполук є оксиди, гідроксиди (основи і кислоти) і солі.
Оксидами називаються складні речовини, що складаються із двох елементів, одним із яких є Оксиген. Майже всі хімічні елементи (за виключенням Гелію, Неону і Аргону) утворюють оксиди.
За хімічними властивостями оксиди поділяються на три групи:
– основні (Na2O, CaO, FeO, Fe2O3), утворюються тільки металами;
– кислотні (CO2, P2O5, SO2, SO3), утворюються неметалами і деякими металами, що проявляють високий ступінь окиснення (Mn2O7, CrO3 );
– амфотерні (ZnO, Al2O3, Cr2O3), які проявляють двоїсті властивості – основні і кислотні, утворюються амфотерними елементами.
Основні, кислотні і амфотерні оксиди називаються солетворними – мають властивість утворювати солі в результаті взаємодії з кислотами або основами.
Є невелика група оксидів, які не проявляють солетворних властивостей: CO, N2O, NO, SiO.
Оксиди можуть бути отримані, в основному, трьома способами:
1. Безпосередня взаємодія простої речовини з киснем:
С + О2 → СО2; 2Са + О2 → 2СаО
2. Розкладання під час нагрівання оксигеновмісних сполук:
СаСО3 → СаО + СО2; 2Сu(NО3)2 → 2СО + 4NО2 + О2;
2Fе(ОН)3 → Fе2О3 + 3Н2О; Н2СО3 → СО2 + Н2О
3. Горіння складних органічних речовин:
СН4 + 2О2 → СО2 + 2Н2О
З точки зору фізичних властивостей оксиди бувають газоподібними (CO2, SO2, SO3, NO ); рідкими (N2O3, N2O4, Cl2O7 ); і твердими (всі основні і амфотерні оксиди, Р2О5 та ін.).
Окрему групу оксигеновмісних сполук елементів складають пероксиди. Їх розглядають як солі пероксиду Гідрогену Н2О2, що проявляє слабкі кислотні властивості. Наприклад: пероксид натрію Nа2О2 (перокси – назва групи –О–О–, структурна формула цього пероксиду Nа–О–О–Nа), ВаО2. Ступінь окиснення Оксигену в пероксидах – -1, валентність –ІІ.
Кислотами називаються складні речовини, утворені кислотним залишком і одним або декількома атомами Гідрогену, здатного заміщуватись під час хімічних реакцій на атоми металу. А за визначенням Ареніуса кислотами є сполуки, що дисоціюють у водному розчині (або розплаві) на позитивно заряджені йони гідроксонію і негативно заряджені йони кислотного залишку.
H2SO4 D 2H+ + SO42- сірчана кислота
CH3COOH D H+ + CH3COO– оцтова (етанова) кислота
Кислоти є досить різноманітними як за агрегатним станом (газоподібні, рідкі, тверді), так і за фізико-хімічними властивостями. Більшість кислот добре розчиняється у воді. Їх найважливішою хімічною властивістю є здатність утворювати солі в результаті взаємодії з основами і основними оксидами.
Основність кислоти визначається кількістю йонів Гідрогену, які утворюються в результаті дисоціації її молекул:
HCl, HNO3 – одноосновні кислоти,
H2S, H2SO4, H2CO3 – двохосновні кислоти,
H3PO4, H3AsO4 – трьохосновні кислоти.
Кількістю йонів Гідрогену, що утворюються кожною молекулою кислоти під час її дисоціації визначається валентність кислотного залишку (аніона).
Двох- і багатоосновні кислоти дисоціюють ступінчасто і утворюють кислі солі: сірчана кислота H2SO4 утворює два кислотних залишки – одновалентний HSO4– і SO42– двовалентний (відповідні солі NaHSO4 і Na2SO4); HCl, HNO3 – тільки одновалентні залишки Cl–, NO3– (утворюють тільки нейтральні солі NaCl, NaNO3). Розрізняють кислоти оксигеновмісні (H2SO4, HNO3, H3PO4, H2CO3, HNO2) і безоксигенові (не містять Оксиген у своєму складі: HCl, HBr, HI, H2S, HCN).
Згідно із теорією електролітичної дисоціації, всі загальні характерні властивості кислот (кислий смак, зміна кольору індикаторів, взаємодія з основами і основними оксидами, солями) зумовлені йонами гідроксонію H3O+.
Основами називаються хімічні сполуки, утворені атомами металу (або NH4+-йоном), з’єднаними з однією або декількома гідроксогрупами. За визначенням Ареніуса основами є складні речовини, які у водному розчині (або розплаві) дисоціюють на вільні позитивно заряджені йони металу і негативно заряджені гідроксид-йони.
NaOH D Na+ + OH–
Ca(OH)2 D Ca2+ + 2OH– (за Ареніусом)
Вони є твердими кристалічними речовинами. Основна хімічна властивість основ – здатність взаємодіяти з кислотами і кислотними оксидами з утворенням солей.
Основи, які є розчинними у воді називаються лугами. Це основи лужних і лужноземельних металів: LiOH, NaOH, KOH, RbOH, CsOH, Ca(OH)2, Sr(OH)2, Ba(OH)2.
Кислотність основи визначається кількістю гідроксильних груп в її молекулі.
Наприклад: NH4OH, NaOH, KOH, – однокислотні основи;
Ca(OH)2, Fe(OH)2, Mg(OH)2 – двокислотні основи;
Al(OH)3, Fe(OH)3, Cr(OH)3 – трикислотні основи.
Дво- і багатокислотні основи дисоціюють ступінчасто, утворюють основні солі (MgOHNO3, Cu2(OH)2CO3).
Луги NaOH і KOH є стійкими до нагрівання. Більшість основ під час нагрівання розкладаються: Cu(OH)2 → CuO + H2O.
З точки зору теорії електролітичної дисоціації, гідроксид-йонами ОН– зумовлені всі загальні властивості розчинів основ (зміна забарвлення індикаторів, взаємодія з кислотами, ангідридами кислот, солями).
Відомі також і гідроксиди, які під час дисоціації утворюють одночасно і катіони H3О+ і гідроксид-йони ОН– – це амфотерні гідроксиди
Al(OH)3 → Al3+ + 3OH–
Al(OH)3 + 2H2O → [Al(OH)4]– + H3О+
Такі гідроксиди проявляють як кислотні, так і основні властивості: Al(OH)3, Cr(OH)3, Zn(OH)2, Pb(OH)2, Sn(OH)2 та ін. У амфотерного гідроксиду, наприклад Al(OH)3 та йому подібних, в кислому середовищі рівновага зміщується в бік утворення солей; а в лужному – в бік утворення гідроксокомплексів:
Al(OH)3 + 3HCl → AlCl3 + 3H2O проявляє основні властивості
Al(OH)3 + 3NaOH → Na3[Al(OH)6] проявляє кислотні властивості
Солями називають складні хімічні сполуки, в результаті дисоціації яких утворюються катіони металу (або амонію NH4+) і аніони кислотних залишків.
NaCl → Na+ + Cl–; K3PO4 → 3K+ + PO43-
В залежності від складу розрізняють наступні типи солей:
– середні Na2SO4, KCl, Ba(NO3)2, ZnSO4, Na3PO4;
– кислі NaHSO4, Ca(HCO3)2, KH2PO4, K2HPO4;
– основні MgOHCl, Cu2(OH)2CO3, Al(OH)2Cl, AlOHCl2;
– подвійні KAl(SO4)2, KCr(SO4)2, (NH4)2Fe(SO4)2;
– комплексні K4[Fe(CN)6], [Ag(NH3)2]Cl.
Солі є твердими кристалічними речовинами. За розчинністю у воді їх можна розділити на розчинні, малорозчинні і практично нерозчинні. Всі солі азотної та оцтової кислоти є розчинними у воді. Розчинними також є майже всі солі соляної кислоти (AgCl, PbCl2, Hg2Cl2 – нерозчинні).
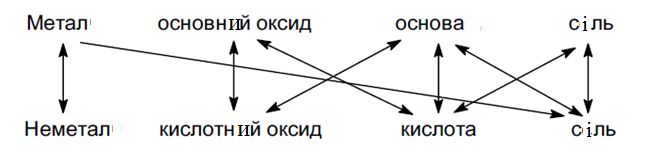
Взаємозв’язок простих речовин, оксидів, кислот, основ і солей
(реакції солетворення)
1. Взаємодія металу з неметалом
2Fe + 3Cl2 → 2FeCl3
2. Взаємодія основного оксиду з кислотним оксидом
CaO + CO2 → CaCO3
3. Взаємодія основи з кислотою
Ba(OH)2 + H2SO4 → BaSO4 ↓ + 2H2O
4. Взаємодія солі з сіллю
Na2SO4 + BaCl2 → BaSO4↓ + 2NaCl
5. Взаємодія металу з кислотою
Fe + H2SO4 → FeSO4 + H2↑
6. Взаємодія металу з сіллю
Zn + CuSO4 → ZnSO4 + Cu
7. Взаємодія основного оксиду з кислотою
MgO + H2SO4 → MgSO4 + H2O
8. Взаємодія кислотного оксиду з основою
CO2 + 2NaOH → Na2CO3 + H2O
9. Взаємодія основи з сіллю
Ba(OH)2 + Na2SO4 → BaSO4 ↓ + 2NaOH
10. Взаємодія кислоти з сіллю
AgNO3 + HCl → AgCl ↓ + HNO3
11. Взаємодія амфотерного оксиду
а) з кислотою ZnO + 2HCl → ZnCl2 + H2O
б) з лугом ZnO + 2NaOH → Na2ZnO2 + H2O
12. Взаємодія амфотерної основи
а) з кислотою Zn(OH)2 + 2HCl → ZnCl2 + 2H2O
б) з лугом Zn(OH)2 + 2KOH → K2[Zn(OH)4]
13. Взаємодія солі з розчином аміаку (надлишок)
CuSO4 + 4NH4OH → [Cu(NH3)4]SO4 + 4H2O
Реакції відбуваються до кінця, якщо один із продуктів виходить із сфери реакції, тобто випадає у вигляді осаду, виділяється у вигляді газу, або утворюється у вигляді слабкого електроліту чи комплексного йону.
Схема генетичного зв’язку основних класів неорганічних сполук
Сучасна номенклатура неорганічних речовин
Для створення назв хімічних сполук існують єдині правила, які розроблені Комісією з номенклатури Міжнародної Спілки Чистої та Прикладної хімії (IUPAC).
Назви більшості елементів походять від латинських назв. Наприклад: Borum – Бор, Natrium – Натрій, Kalium – Калій, Magnium – Маґній, Chlorum – Хлор, Phosphorum – Фосфор, Iodum – Йод. Систематичні назви елементів, які необхідно використовувати, наведені в додатку В.
Елементи, що у вигляді простих речовин були відомі давно (залізо, срібло, золото, мідь, пізніше ртуть, азот, вуглець тощо), у кожній мові отримували штучні назви, які не походять від латинських. У той же час вимова символів елементів-металів у західнослов'янських мовах, зокрема, в українській, традиційно відповідала їх латинській назві: Cu – купрум (Cuprum), Ag – арґентум (Argentum), Fe – ферум (Ferrum), Pb – плюмбум (Plumbum), Au – аурум (Aurum) тощо. Тому УНКоХіТерН схвалила уніфікувати цю практику термінотворення, поширивши її на назви самих елементів. Замість невдалих термінів, таких як миш'як, кремній, сурма, вісмут, марганець, вживають міжнародні, латинські за походженням назви Арсен (As), Силіцій (Si), Стибій (Sb), Бісмут (Bi), Манґан (Mn).
Паралельно можна використовувати і традиційні українські назви для таких елементів як Водень, Азот, Кисень, Сірка, Нікель тощо.
Назви простих речовин пишуть з малої літери. Називаючи прості речовини, можна надавати перевагу традиційним назвам елементів, що їх утворили, наприклад: водень, кисень, залізо, мідь, манґан, цинк, вуглець, азот, ртуть тощо.
Якщо число структурних одиниць є невизначеним, то використовують префікси полi- та цикло-. Приклад: S8 – цикло-октосульфур, цикло-октосірка; Pn – цикло-полiфосфор.
Для твердих поліморфних модифікацій можна використовувати їх позначення грецькими літерами, а також використовувати назви за однією з ознак: кольором, кристалічним станом або кристалічною структурою.
Наприклад:
α-Fe – альфа-залізо;
α-Sn – α-станум, α-олово, сірий станум;
β-Sn – β-станум, β-олово, білий станум;
γ-Sn – γ-станум, γ-олово, ромбічний (ромб) станум, крихкий станум;
S8 – кристалічна сірка.
Згідно з ДСТУ 2439-94 можна вживати також традицiйнi для української мови назви, наприклад, алмаз, графіт, озон.
Номенклатура оксидів
Назви оксидів можна будувати за допомогою латинських та грецьких числових множників (множних префіксів):
|
1 – (моно-(ген-); 2 – ди-(ді-); 3 – три-; |
4 – тетра-; 5 – пента-; 6 – гекса-; |
7 – гепта-; 8 – окта-; 9 – нона-; |
10 – дека-; |
Спочатку називають числовий множник атома металу чи неметалу, що утворює оксид, потім – систематичну назву цього атома в називному відмінку, далі називають числовий множник атома Оксисену і насамкінець додається слово "оксид".
Наприклад: N2O5 – динітроген пентаоксид; Al2O3 – діалюміній триоксид.
Якщо елемент утворює лише один оксид, то назва його може складатися лише з назви елемента та слова оксид: BaO – барій оксид; ZnO – цинк оксид.
Сполуки, що містять угрупування О22-, О2- та О3- називають відповідно: К2О2 – калій пероксид, КО2 – калій надпероксид, КО3 – калій озонід.
Сполуки оксигену з флуором (фтором): ОF2 –оксиген дифлуорид, О2F2 – диоксиген дифлуорид.
Номенклатура основ
Назви основних гiдроксидiв, як i оксидiв, можна будувати, використовуючи числові множники. Наприклад: Fe(OH)2 – феpум дигідpоксид, Ca(OH)2 – кальцій дигідроксид; Sr(OH)2 – стронцій дигідроксид; Ba(OH)2 – барій дигідроксид.
Якщо метал утворює тільки один основний гiдроксид, то назви таких гiдроксидiв утворюються з назви катioна i слова "гідроксид": LiOH – лiтiй гідроксид; KOH – калій гідроксид; CsOH – цезій гідроксид.
Якщо у складі сполуки, крім гідроксид-йонів є ще й оксид-йони, то в назві перераховують обидва аніони з відповідними числовими префіксами:
CrO(OH) – хром(Ш) гідроксид оксид;
Fe3O2(OH)5 – триферум пентагідроксид діоксид.
WO(OH)3 – вольфрам тригідроксидмонооксид, VO(OH)2 – оксованадій (IV) дигідроксид.
Номенклатура кислот
Кислоти мають назви двох типів – тривіальні (традиційні) і хімічні (систематичні, раціональні). Перші вживаються у промисловості, сільському господарстві, торгівельній мережі, в побуті (наприклад, H2SO4 – сірчана кислота, HNO3 – азотна кислота, H3PO4 – ортофосфорна кислота, HCl – соляна кислота), другі – здебільшого в науковій і навчальній літературі. Проте чіткого розподілу сфер їх вживання немає.
Систематичні назви складаються з двох слів. Перше слово відображає наявність атомів Гiдроґену. Кислотні атоми Гiдроґену називають "Гiдроґен". Якщо необхідно, то застосовують числова множники: моно-, ди-(ді-), три- , тетра- , пента i т.д. Друге слово – це назва анiона.
Назви одноелементних аніонів складаються з коренів латинських назв елементів (іноді скорочених) із суфіксом -ид (-ід) та групової назви "йон", що пишеться через дефiс: F– –флуорид-йон.
Складні Оксиґенвмісні аніони називаються в такій послідовності: числовий множник атома Оксигену (ди-, три-, тера- і т.д.), далі слово "оксо", і в кінці – до кореня латинської назви центрального атома додається суфікс ат.
Наприклад: H2SeO3 – дигідрогентриоксоселенат; H2SO4 – дигідроген тетраоксосульфат, HMnO4 – моногідрогентетраоксоманганат; HNO3 – гідроген триоксонітрат.
Для деяких кислот комісія IUPAC дозволяє використання традиційних назв, наприклад, Н2SO4 – сірчана, H3PO4 – фосфорна (ортофосфорна), HPO3 – метафосфорна, HNO3 – азотна та ін.
Для водних розчинів галогеноводнів та інших можна зберегти традиційні назви: HCl – хлороводнева кислота, хлоридна або соляна; HBr –бромоводнева кислота або бромідна; HCN – ціановоднева кислота або ціанідна; HN3 – азидоводнева кислота або азидна.
Номенклатура середніх солей
Назви солей легко утворюються з назв катіонів і аніонів, застосовуючи числовi множники: Hg2CrO4 – димеpкуpій хpомат(VI); димеpкуpій(I) хpомат(VI); Al2(SO4)3 – діалюмiнiй трисульфат(VI).
Номенклатура кислих солей
Кислі солі багатоосновних кислот називаються так, як i середні, але з додаванням до назви аніона слова "гiдроґен", якщо треба, то з числовими множниками: NaHSO4 – натрій гiдроґенсульфат(VI); Ba(HSO3)2 – барiй гiдроґенсульфат(IV); (NH4)2HPO4 – діамоній гiдроґенфосфат(V).
Номенклатура основних солей
Основні солі (гiдроксидо- та оксидосолі) можна називати як подвiйнi солі, вважаючи ОН– та О2– за гетероанiони. Аніони перелічуються в алфавітному порядку. Наприклад:
Fe(OH)SO4 – феpум(III) гідроксид сульфат(VI);
Al(OH)SO4 – алюміній гідроксид сульфат(VI);
Bi(NO3)O – бiсмут(III) нітрат(V) оксид;
Sb(NO3)O – стибiй(III) нітрат(V) оксид;
SbOBr – стибiй(III) бромiд оксид;
(CuOH)2CO3, Cu2CO3(OH)2 – дикупрум(II) дигiдроксид карбонат;
CaCl(OH) – кальцій гідроксид хлорид.
Номенклатура подвійних солей
У назві подвійних солей катiони перераховуються в алфавітному порядку (порядок назви солi може вiдрiзнятися від порядку запису формули). Наприклад: KAl(SO4)2 – алюміній калій дисульфат(VI);
NH4Fe(SO4)2 – амоній феpум(III) дисульфат(VI);
K2NaPO4 – дикалiй натрій фосфат(V);
LiNaKPO4 – калій лiтiй натрій фосфат(V);
NaNH4KPO4 – амоній калій натрій фосфат(V);
KCr(SO4)2 – калій хром(III) дисульфат(VI).
Змішані солі – солі, до складу яких входить один катіон металу або одна металоподібна група атомів, але два різних аніони, називаються змішаними, наприклад: Al(NO3)SO4, Cr(NO3)SO4.
Формули змішаних солей записуються i читаються в алфавітному порядку:
Al(NO3)SO4 – алюмiнiй нiтрат(V) сульфат(VI);
Bi(NO3)SO4 – бiсмут(III) нiтрат(V) сульфат(VI);
Cr(NO3)SO4 – хром(III) нітрат(V) сульфат(VI);
Fe(ClO4)SO4 – феpум(III) сульфат(VI) хлорат(VII).
Номенклатура комплексних сполук будується за тими ж принципами, що й назви простих, але враховується їх хімічна природа:
– сполуки, що містять комплексні катіони - [Ag(NH3)2]Cl – діамінаргентум (І) хлорид, [Cu(NH3)4](OH)2 – тетраамінкупрум (ІІ) дигідроксид;
– сполуки, що містять комплексні аніони – Na[Al(OH)4] – натрій тетрагідроксоалюмінат, K3[Fe(CN)6] – калій гексаціаноферат (ІІІ), K4[Fe(CN)6] – калій гексаціаноферат (ІІ),
– нейтральні комплекси – [Ni(CO)4] – тетракарбонілнікол, [Cr(H2O)3F3] – трифлуоротриаквахром (ІІІ).
Тривіальні і стандартні назви деяких неорганічних сполук наведені в додатку Г.
Контрольні завдання
- Написати формули оксидів, відповідних вказаним гідроксидам: H2SO4, Cu(OH)2, H3AsO3, H2TeO4, Fe(OH)3. Дати назви цим гідроксидам і відповідним оксидам за сучасною номенклатурою. Написати рівняння можливих реакцій між ними.
- Які солі можна одержати, якщо мати у своєму розпорядженні Na2SO4, AgNO3, Na3PO4, SrCl2? Написати рівняння реакцій і дати назву одержаним солям.
- Які із вказаних газів вступають в хімічну взаємодію з розчином лугу: HСl, H2S, NO2, N2, Cl2, CH4, SO2, NH3? Написати рівняння відповідних реакцій. Дати назви всім речовинам за сучасною номенклатурою.
- Які солі можна одержати, маючи у своєму розпорядженні СuSO4, AgNO3, K3PO4, BaCl2? Написати рівняння реакцій і дати назву одержаним солям.
- З якими із перерахованих нижче речовин буде реагувати соляна кислота: В2O3, Zn(OH)2, CaO, AgNO3, SiO2, H3PO4? Скласти рівняння відповідних реакцій. Назвати всі речовини за сучасною номенклатурою.
- Які із перерахованих нижче речовин реагують з натрій гідроксидом: HNO3, CaO, CO2, CuSO4, Cd(OH)2, P4O10? Скласти рівняння відповідних реакцій. Назвати всі речовини за сучасною номенклатурою.
- Написати рівняння реакцій, що свідчать про основні властивості наступних сполук: FeO, Сs2O, HgO, Bi2O3. Дати назви всім речовинам за сучасною номенклатурою.
- Написати рівняння реакцій, які свідчать про кислотний характер наступних сполук: SeO2, SO3, Mn2O7, P2O5, CrO3. Дати назви всім речовинам за сучасною номенклатурою.
- Написати формули ангідридів таких кислот: H2SO4, HClO, H2CO3, H3BO3, H4P2O7, HMnO4. Дати назву кислотам та їх ангідридам за сучасною номенклатурою.
- Написати рівняння реакцій утворення наступних сполук: Mg(NO3)2, Ca3(PO4)2, Mg(ClO4)2, Ba(NO3)2 в результаті взаємодії: а) основного і кислотного оксидів; б) основи і кислотного оксиду; в) основного оксиду і кислоти; г) основи і кислоти. Дати назви всім речовинам за сучасною номенклатурою.
- Написати рівняння реакцій, які відбуваються у водному розчині між а) FeS і HСl; б) (СuOH)2CO3 і H2SO4; в) Ca(HCO3)2 і NаOH; г) NaHSO4 і NH3; д) Al(H2PO4)3 і Са(OH)2. Дати назву всім сполукам за систематичною номенклатурою.
- Навести приклади оксидів, в результаті взаємодії яких з водою утворюються кислоти. Як взаємодіють з розчином гідроксиду кальцію наведені вами оксиди. Написати рівняння реакцій і дати назви всім речовинам за сучасною номенклатурою?
- Здійснити перетворення через проміжний продукт:
FeCl3 → ? → Fe2O3; Al(CH3COO)3 → ? → Al2O3;
CuSO4 → ? → CuO; MnBr2 → ? → MnO.
- Які речовини утворюються в результаті термічного розкладання наступних кислот або дії на них водовід’ємних засобів: HNO2; HClO; H3PO3; H2WO4; H3AsO4; HBO2; H2B4O7; HAsO3; H2SO3? Написати рівняння відповідних реакцій. Дати назву всім сполукам за систематичною номенклатурою.
- З якими із перерахованих нижче речовин реагує соляна кислота: СаO; N2O3; AgNO3; SO3; Pb(NO3)2; CuSO4; FeS; FeO; Cu; Zn? Написати рівняння відповідних реакцій та дати назву всім сполукам за систематичною номенклатурою.
- Написати рівняння реакцій, за допомогою яких перераховані нижче солі можуть бути переведені в середні: (СuOH)2SO4, Ca(HCO3)2, [Al(OH)2]2SO4, [Cr(OH)2]2SO4, FeOHSO4, (BiOH)SO4. Дати назву всім сполукам за систематичною номенклатурою.
- Які із наведених нижче солей ВаClNO3, KNa2PO4, Pb(CH3COO)2, Fe(OH)2NO3 взаємодіють з: а) H2SO4, б) NaOH? Назвати початкові солі і продукти можливих реакцій.
- Якими способами можна одержати із однієї солі іншу:
а) Pb(NO3)2 → РbSO4, б) CuCl2 →СuSO4,
в) Fe2(SO4)3 → FeСl3, г) K2CrO4 → BаСrO4,
д) NaAlO2 → Al2(SO4)3 е) BaCO3 → BаСl2?
Написати рівняння відповідних реакцій та дати назву всім сполукам за систематичною номенклатурою.
- Написати рівняння реакцій, які відбуваються у водному розчині між наступними речовинами: а) Са(OH)2 і NO2; б) NH3 і SO2; в) CaCl2 і Nа2HPO4; г) H2SO4 і FeOHSO4; д) NH4Cr(SO4)2 і BаСl2. Дати назву всім сполукам за систематичною номенклатурою.
- За допомогою яких реакцій можна добути наступні речовини: Al2O3, AlСl3, Fe2(SO4)3, FeСl3, FeСl2, Fe2O3, ZnS, ZnO. Написати рівняння відповідних реакцій. Дати назву всім сполукам за систематичною номенклатурою.