Кількісний склад розчинів
Розчином називають гомогенну систему змінного складу, що складається із двох або більше речовин. Речовини, які утворюють розчин, називають компонентами розчину. Розчини бувають газоподібними, рідкими і твердими.
Будь-який розчин складається із розчиненої речовини і розчинника, хоча ці поняття деякою мірою є умовними. Зазвичай розчинником вважають той компонент, який в розчині знаходиться в тому ж вигляді, що і до розчинення. У розчинах, компоненти якого знаходяться в однакових агрегатних станах розчинником вважається той компонент розчину, якого більше. Наприклад, у водному розчині глюкози (тверда речовина) розчинником є вода, а суміш спирту (рідина) і води (рідина) можна назвати в залежності від кількості компоненту розчином спирту у воді або води в спирті.
Властивості розчину визначаються якісним і кількісним складом розчину. На практиці кількісний склад розчинів виражають за допомогою наступних величин: а) безрозмірних – масова, об’ємна і молярна частки; б) розмірних – масова концентрація речовини, молярна концентрація речовини, молярна концентрація еківалента речовини та моляльність.
Масова частка (W) – це відношення маси розчиненої речовини до маси розчину:
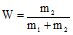 (3.1)
(3.1)
де m1 – маса розчинника, г; m2 – маса розчиненої речовини, г;
Молярна частка (N2) – це відношення кількості молів розчиненої речовини (n2) до загальної кількості молів у системі, тобто до суми молів розчинника (n1) і всіх розчинених у ньому речовин. Для бінарного розчину:
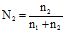 (3.2)
(3.2)
Масова концентрація речовини (С, %) – це виражене у відсотках відношення маси розчиненої речовини до маси розчину:
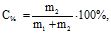 (3.3)
(3.3)
де m1 – маса розчинника, г; m2 – маса розчиненої речовини, г;
Молярна концентрація (СМ, моль/л) – це кількість молів розчиненої речовини в 1 л розчину:
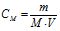 (3.4)
(3.4)
де М – молярна маса, г/моль; m – маса розчиненої речовини (г) в 1 л розчину; V – об’єм розчину в літрах.
Моляльна концентрація компоненту (Сm, моль/кг) – це кількість молів розчиненої речовини в 1 кг (1000 г) розчинника, наприклад, води:
 , (4.5)
, (4.5)
де m1 і m2 – маса розчинника і розчиненої речовини відповідно, М2 – молярна маса розчиненої речовини;
Молярна концентрація еквіваленту (СН, моль-екв/л) – це кількість молів еквівалентів розчиненої речовини в 1 л розчину
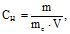 (3.6)
(3.6)
де me – еквівалентна маса, г/(мольекв); m – маса розчиненої речовини (г) в 1 л розчину; V – об’єм розчину в літрах.
Титр розчину (Т) – це маса розчиненої речовини, яка міститься у 1 мл розчину:
![]() або
або  (3.7)
(3.7)
де Сн – еквівалентна концентрація розчиненої речовини, (моль-екв/л); me – еквівалентна маса, (г/моль-екв); m – маса розчиненої речовини (г); V – об’єм розчину (мл).
Для переходу від одного способу вираження концентрації до іншого користуються наступними формулами:
![]() ;
; ![]() ;
; ![]() ;
; ![]()
Приклади розв’язування типових задач
Приклад 1 Скільки грамів 32%-ного розчину нітратної кислоти необхідно додати до 600 г 80%-ного розчину тієї самої кислоти, щоб одержати 64%-ний розчин?
Розв’язування:
Запишемо формулу для знаходження концентрації новоутвореного розчину:
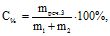
де mреч.3 – маса розчиненої речовини в новоутвореному розчині, яка складається із маси розчиненої речовини із першого розчину (mреч.1) і маси розчиненої речовини із другого розчину (mреч.2):
mреч.1= 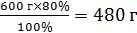
mреч.2= 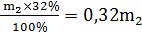 .
.
Маса новоутвореного розчину m3 = m1 + m2:
m3 = 600 + m2.
Підставимо отримані значення у вираз концентрації:
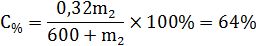
Розв’язавши рівняння дістанемо m2 = 300 г.
Приклад 2 У 250 г води розчинили 50 г FeSO47H2O. Обчислити відсотковий вміст в розчині кристалогідрату та безводної солі.
Розв’язування:
Масова частка ![]() ;
; ![]()
mрозчину = 250 + 50 = 300 г; W1 = ![]() = 16,7%
= 16,7%
Обчислимо вміст безводної солі FeSO4в 50 г кристалогідрату (FeSO47H2O):
М (FeSO47H2O) = 278 г/моль; М (FeSO4) = 152 г/моль;
Складаємо пропорцію:
в 278 г FeSO47H2O міститься 152 г FeSO4
в 250 г х г
![]() тоді
тоді ![]() .
.
Приклад 3 Обчислити молярну концентрацію 1 л 36,2% розчину HCl, густиною 1,18 г/мл.
Розв’язування:
Запишемо формулу для визначення молярної концентрації 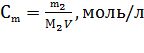
Знайдемо mрозчину за формулою m = V∙ρ: m(р-ну) = 1000∙1,18 = 1180 г;
Маса НCl, яка міститься в 36,2% розчині дорівнює
![]() г
г
Знаходимо кількість молів НСl: М (НСl) = 36,5 г/моль;
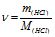
![]()
Звідки ![]() .
.
Приклад 4 Обчислити нормальність 15%-ного розчину H2SO4 об’ємом 1 л, густиною 1,10 г/мл.
Розв’язування:
Запишемо формулу для знаходження Сн: 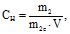
Масу H2SO4 (m2), яка міститься в 15% розчині знайдемо так:
m2= 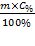
Масу розчину (m) знайдемо за формулою:
m = V∙ρ: m(р-ну) = 1000∙1,10 = 1100 г;
тоді ![]() г
г
Еквівалентна маса H2SO4 дорівнює ![]() г/моль
г/моль
Знаходимо кількість молів еквівалентів H2SO4:
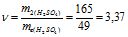 г/моль, тоді
г/моль, тоді 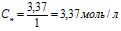
Контрольні завдання
- Скільки грамів калій хлориду потрібно додати до 450 г 8%-ного розчину тієї самої солі, щоб одержати 12%-ний розчин?
Відповідь: 20,45 г.
- Із 10 кг 20%-ного розчину в результаті охолодження виділилося 400 г солі. Чому дорівнює відсоткова концентрація охолодженого розчину?
Відповідь: 16,7%.
- У якій масі води необхідно розчинити 40 г калій броміду для одержання 4%-ного розчину?
Відповідь: 960 г.
- Із 400 г 50%-ного розчину сульфатної кислоти випарували 100 г води. Чому дорівнює відсоткова концентрація цього розчину?
Відповідь: 66,7%.
- До 3 л 10%-ного розчину HNO3 (густиною 1,054 г/см3) додали 5 л 2%-ного розчину тієї самої кислоти (густиною 1,009 г/см3). Обчислити відсоткову і молярну концентрації одержаного розчину, об’єм якого дорівнює 8 л.
Відповідь: 5%; СМ = 0,82.
- У якій масі води потрібно розчинити 67,2 л гідроген хлориду (н.у.), щоб одержати 9%-ний розчин хлоридної (соляної) кислоти?
Відповідь: 1107 г.
- Змішали 300 г 20%-ного розчину і 500 г 40%-ного розчину натрій хлориду. Чому дорівнює відсоткова концентрація одержаного розчину?
Відповідь: 32,5%.
- Який об’єм води необхідно додати до 100 мл 20%-ного розчину сульфатної кислоти (густина 1,14 г/см3), щоб одержати 5%-ний розчин?
Відповідь: 342 мл.
- Яку масу натрій нітрату необхідно розчинити у 400 г води, щоб приготувати 20%-ний розчин?
Відповідь: 100 г.
- До 950 г води додали 50 мл 48%-ного розчину сульфатної кислоти (густина 1,38 г/см3). Обчислити відсотковий вміст сульфатної кислоти в одержаному розчині.
Відповідь: 3,25%.
- Скільки грамів Na2SO4 10H2O необхідно розчинити у 250 г води, щоб одержати розчин, який містить 5%-тів безводної солі?
Відповідь: 32 г.
- Визначити відсоткову концентрацію розчину, одержаного змішуванням 300 г 25%-ного і 400 г 40%-ного розчинів.
Відповідь: 33,6%.
- Обчислити відсотковий вміст кристалогідрату і безводної солі у розчині, який містить 100 г FeSO4 7H2O у 900 г води.
Відповідь: 10,0%; 5,47%.
- Для приготування 5%-ного розчину магній сульфату взято 400 г MgSO4 7Н2О. Знайти масу одержаного розчину.
Відповідь: 3,9 кг.
- Скільки молів води необхідно додати до 1,6 кг 25%-ного розчину натрій гідроксиду для одержання 16%-ного розчину?
Відповідь: 450 г.
- Із 750 кг 48%-ного розчину сульфатної кислоти випарували 300 кг води. Визначити відсотковий вміст сульфатної кислоти в одержаному розчині.
Відповідь: 80%.
- Скільки грамів BaCl2 2Н2О необхідно для реакції обміну із 75 мл 2,3%-ного розчину сульфатної кислоти (густиною 1,015 г/см3)?
Відповідь: 4,36 г.
- У якій масі води необхідно розчинити 50 г сульфатної кислоти, щоб одержати 10%-ний розчин?
Відповідь: 25 моль.
- У якій масі води необхідно розчинити 25 г CuSO4 5Н2О, щоб одержати 8%-ний розчин CuSO4?
Відповідь: 175 г.
- Змішали 247 г 62%-ного і 145 г 18%-ного розчинів сульфатної кислоти. Яка відсоткова концентрація одержаного розчину?
Відповідь: 45,72%.