Гідроліз солей
Гідроліз солі – процес взаємодії солі з водою, що призводить до утворення малодисоціюючих частинок (молекул або йонів). Гідроліз солей якісно можна представити як результат поляризаційної взаємодії йонів солі з їх гідратною оболонкою і спрощено представити наступними схемами:
Kn+ + HOH D KOH(n–1)+ + H+, An– + HOH D HA(n–1)– + OH–
Гідроліз зумовлений утворенням малодисоціюючих частинок КОН(n–1)+ і НА(n–1)–.
Чим більшим є заряд і меншим радіус йонів солі, тим сильнішою є їх поляризаційна взаємодія з водою, слабкішою дисоціація частинок, що утворюються: КОН(n–1)+ і НА(n–1)–, і тим повніше відбувається гідроліз.
Поляризуюча дія на молекули води є невеликою у катіонів лужних та лужноземельних металів, однозарядних аніонів, наприклад Сl–, Br–, NO3−, у деяких двохзарядних, наприклад SO42−. Тому солі, що утворені аніоном сильної кислоти і катіоном сильної основи, гідролізу не піддаються.
В результаті гідролізу зміщується рівновага електролітичної дисоціації води, що призводить до зміни рH середовища, яке можна визначити за допомогою індикаторів.
Наприклад, в результаті розчинення ацетату натрію середовище стає лужним завдяки наступним процесам:
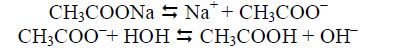
Зміна водневого показника рH під час розчинення солі у воді є основною ознакою гідролізу.
Можливість і характер гідролізу визначається природою кислоти і основи, якими утворена сіль. Можливі наступні випадки гідролізу солей: гідроліз за аніоном, за катіоном, за катіоном і аніоном одночасно.
Гідроліз за катіоном. Так гідролізуються солі, утворені слабкими основами і сильними кислотами. Катіон утворює з гідроксид-йонами слабку основу. Середовище розчину в цьому випадку є кислим (рН < 7).
Наприклад, гідроліз одноосновної солі за катіоном відбувається за наступною схемою:
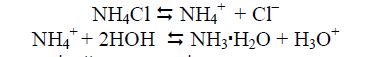
Якщо катіонами солі є йони металів, то у водних розчинах вони існують у вигляді аквакомплексів певного складу. Наприклад: [Cu(H2O)4]2+, [Cr(H2O)6]3+ тощо, у яких молекули води зв’язані з центральним атомом (катіоном металу) ковалентними зв’язками, утвореними за донорно-акцепторним механізмом (катіон – акцептор, молекули води – донори електронних пар). Далі гідратація таких аквакомплексів молекулами води здійснюється за рахунок водневих зв’язків.
Солі такого типу, але утворені багатокислотними основами, гідролізуються ступінчасто, наприклад:
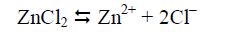
у водному розчині Zn2+
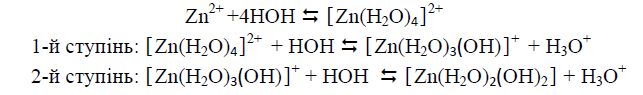
причому гідроліз відбувається в основному за першим ступенем.
Гідроліз відбувається тим глибше, чим менше Кb (або більше рКb) основи. Солі, утворені сильними основами, гідролізу за катіоном не піддаються.
Гідроліз за аніоном. Так гідролізуються солі, утворені сильними основами і слабкими кислотами, оскільки аніон утворює з йонами гідроксонію Н3О+ слабку кислоту. Гідратація аніонів здійснюється за рахунок водневих зв’язків, утворених негативно поляризованим атомом аніона і позитивно поляризованим атомом водню молекули води у гідратній оболонці невизначеного складу. Середовище розчину в цьому випадку є лужним (рН > 7):
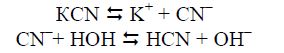
Солі цього типу, утворені багатоосновними кислотами, гідролізуються ступінчасто, наприклад:
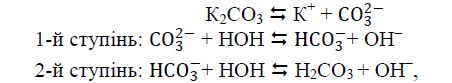
причому гідроліз відбувається в основному за першим ступенем
Чим більший заряд і менший розмір аніона, тим в більшій мірі сіль піддається гідролізу. Такі реакції найбільш характерні для аніонів CO32-, PO43-, SO32-, CN-, NO2-, CH3COO- та ін.
Гідроліз відбувається тим глибше, чим менше Ка (або більше рКа) кислоти.
Гідроліз за катіоном і за аніоном. Так гідролізуються солі, утворені слабкими основами і слабкими кислотами, наприклад:
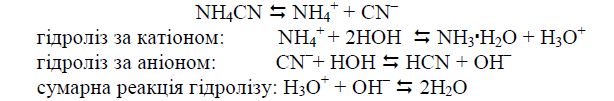
В даному випадку рН середовища залежить від сили слабких кислот, що утворюються, і основ (зазвичай рН дорівнює 6 – 8). Такі солі гідролізуються в більшій мірі, ніж розглянуті в п.п. 2 і 3. Гідроліз таких солей відбувається практично безповоротно, якщо виділяється газ або осад або якщо те і інше утворюється одночасно, наприклад:
Al2S3 + 3H2O = 2Al(OH)3↓ + 3H2S↑
Контрольні завдання
- Скласти йонно-молекулярні рівняння гідролізу і вказати реакцію середовища наступних сполук: AlCl3 (к.ч. 6), CuSO4 (к.ч. 4), NaCN, KNO3.
- Скласти йонно-молекулярні рівняння гідролізу і вказати реакцію середовища наступних сполук: ZnCl2 (к.ч. 4), MgSO4 (к.ч. 6), K3PO4, NaCl.
- Скласти йонно-молекулярні рівняння гідролізу і вказати реакцію середовища наступних сполук: FeCl3 (к.ч. 6), Cu(NO3)2 (к.ч. 4), KOCl, Na2S.
- Скласти йонно-молекулярні рівняння гідролізу і вказати реакцію середовища наступних сполук: Cr(NO3)3 (к.ч. 6), ZnSO4 (к.ч. 4), KNO2, NaHCO3.
- Скласти йонно-молекулярні рівняння гідролізу і вказати реакцію середовища наступних сполук: FeSO4 (к.ч. 6), NH4Cl, KCN, K2HPO4.
- Скласти йонно-молекулярні рівняння гідролізу і вказати реакцію середовища наступних сполук: Cr2(SO4)3 (к.ч. 6), MgBr2 (к.ч. 6), KOCl, KHS.
- Скласти йонно-молекулярні рівняння гідролізу і вказати реакцію середовища наступних сполук: AlCl3 (к.ч. 6), CuCl2 (к.ч. 4), CH3COONH4, NaBr.
- Скласти йонно-молекулярні рівняння гідролізу і вказати реакцію середовища наступних сполук: CrCl3 (к.ч. 6), ZnCl2 (к.ч. 4), Na2SO3, K2S.
- Скласти йонно-молекулярні рівняння гідролізу і вказати реакцію середовища наступних сполук: Al2(SO4)3 (к.ч. 6), CuSO4 (к.ч. 4), NaNO3, CH3COONH4.
- Скласти йонно-молекулярні рівняння гідролізу і вказати реакцію середовища наступних сполук: Cr(NO3)3 (к.ч. 6), MgCl2 (к.ч. 6), NaHSO3, CH3COOK.
- Скласти йонно-молекулярні рівняння гідролізу і вказати реакцію середовища наступних сполук: FeCl3 (к.ч. 6), ZnBr2 (к.ч. 4), Ca(OCl)2, KH2PO4.
- Скласти йонно-молекулярні рівняння гідролізу і вказати реакцію середовища наступних сполук: Cr2(SO4)3 (к.ч. 6), NH4Br, KCl, (NH4)2S.
- Скласти йонно-молекулярні рівняння гідролізу і вказати реакцію середовища наступних сполук: MgSO4 (к.ч. 6), ZnCl2 (к.ч. 4), Na2CO3, KHS.
- Скласти йонно-молекулярні рівняння гідролізу і вказати реакцію середовища наступних сполук: Fe2(SO4)3 (к.ч. 6), MgSO4 (к.ч. 6), NH4Br, CH3COONH4.
- Скласти йонно-молекулярні рівняння гідролізу і вказати реакцію середовища наступних сполук: AlCl3 (к.ч. 6), MgBr2 (к.ч. 6), NaBr, (NH4)2S.
- Скласти йонно-молекулярні рівняння гідролізу і вказати реакцію середовища наступних сполук: Cr(NO3)3 (к.ч. 6), ZnCl2 (к.ч. 4), K2HPO4, NaOCl.
- Скласти йонно-молекулярні рівняння гідролізу і вказати реакцію середовища наступних сполук: FeSO4 (к.ч. 6), MgSO4 (к.ч. 6), KCN, CH3COONH4.
- Скласти йонно-молекулярні рівняння гідролізу і вказати реакцію середовища наступних сполук: MgCl2 (к.ч. 6), Zn(NO3)2 (к.ч. 4), CH3COONa, NaCl.
- Скласти йонно-молекулярні рівняння гідролізу і вказати реакцію середовища наступних сполук: Fe2(SO4)3 (к.ч. 6), CuBr2 (к.ч. 4), (NH4)2S, KBr.
- Скласти йонно-молекулярні рівняння гідролізу і вказати реакцію середовища наступних сполук: Al(NO3)3 (к.ч. 6), ZnSO4 (к.ч. 4), NaNO2, Na2S.