6 Хімічна кінетика і рівновага
Кінетика – вчення про швидкість різних процесів, у тому числі хімічних реакцій. Критерієм принципової можливості реакції є нерівність ΔGр,Т < 0. Але ця нерівність не є ще повною гарантією фактичного перебігу процесу за даних умов, не є достатньою для оцінки кінетичних можливостей реакції. Наприклад, ΔGо298 , Н2О(г) = -228,59 кДж/моль, а ΔGо298 , АlІ3(к) = -313,8 кДж/моль і, відповідно, за Т = 298 К і р = 1,013 105 Па можливі реакції, які перебігають за рівняннями:
Н2(г) + 1,5О2 (г) = Н2О(г)
Аl(к) + 1,5І2 (к) = АlІ3 (к)
Але ці реакції за стандартних умов перебігають лише за наявності каталізатора (платини для першої і води для другої). Каталізатор неначе знімає кінетичне “гальмо”, і тоді проявляється термодинамічна природа речовини. Швидкість хімічної реакції залежить від багатьох факторів, основні із яких – природа реагуючих речовин, концентрація (тиск) реагентів, температура і дія каталізаторів. Ці ж фактори визначають і досягнення рівноваги у реагуючий системі.
При розв’язанні задач необхідно пам’ятати, що константа рівноваги КТ за температури Т хімічної реакції пов’язана зі стандартною зміною енергії Гіббса цієї реакції рівнянням:
ΔGоТ = -2,3RT lgKT (6.1)
За 298 К (25о С) це рівняння має вигляд:
ΔGо298 = -5,71 lgK298, (6.2)
де ΔGо298 виражено у кДж/моль
Приклади розв’язування типових задач
Приклад 1 Як зміниться швидкість реакції 2NO(г) + О2(г)![]() 2NO2(г), якщо зменшити об’єм посудини, у якій перебігає реакція, в 3 рази?
2NO2(г), якщо зменшити об’єм посудини, у якій перебігає реакція, в 3 рази?
Розв’язування: Початкова швидкість прямої реакції виражається рівнянням v = k [NO]2 [O2]. При зменшенні об’єму концентрація кожної з реагуючих речовин збільшується у 3 рази. Отже v1 = k1(3[NO]2) (3[O2]) =
= 27k1[NO]2 [O2]. Порівнюючи вирази для v і v1 видно, що швидкість реакції збільшиться у 27 разів.
Приклад 2 Обчислити, у скільки разів збільшиться швидкість реакції, яка відбувається у газовій фазі, при підвищенні температури від 30 до 70 оС, якщо температурний коефіцієнт реакції дорівнює 2.
Розв’язування: За правилом Вант-Гоффа:
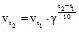 , звідки
, звідки ![]() .
.
Отже, швидкість реакції за 70 оС більша від швидкості реакції за 30 оС у 16 разів.
Приклад 3 Використавши довідкові дані (див. Додаток Д), знайти приблизне значення температури, за якої константа рівноваги реакції утворення водяного газу С(графіт) + Н2О(г) ![]() СО(г) + Н2(г) дорівнює одиниці. Залежностями ΔНо та ΔSо від температури знехтувати.
СО(г) + Н2(г) дорівнює одиниці. Залежностями ΔНо та ΔSо від температури знехтувати.
Розв’язування: Знаходимо значення ΔНо і ΔSо, використавши дані таблиці (Додаток Д).
![]() = -110,5 – (-241,8) = 131,3 кДж
= -110,5 – (-241,8) = 131,3 кДж
![]() = 130,5 + 197,5 -
= 130,5 + 197,5 -
– (188,7 + 5,7) = 133,6 Дж/К = 0,1336 кДж/К
Із рівняння ΔGоТ = -2,3RT lgKT виходить, що при КТ = 1 стандартна енергія Гіббса хімічної реакції дорівнює нулю. Отже, з рівняння
ΔGо= ΔНо- ТΔSо за відповідної температури ΔНо = ТΔSо, маємо: Т=ΔНо/ΔSо = 131,3/0,1336 = 983 К
Приклад 4 У системі СО(г) + Сl2(г)![]() СОСl2(г) рівноважні концентрації речовин [Cl2]р= 0,3 моль/л, [CO]p = 0,2 моль/л і [COCl2]р = 1,2 моль/л. Обчислити константу рівноваги і початкові концентрації Сl2 і СО.
СОСl2(г) рівноважні концентрації речовин [Cl2]р= 0,3 моль/л, [CO]p = 0,2 моль/л і [COCl2]р = 1,2 моль/л. Обчислити константу рівноваги і початкові концентрації Сl2 і СО.
Розв’язування: Константа рівноваги
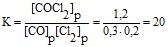
Оскільки за рівнянням реакції з 1 моль СО або Cl2 утворюється 1 моль СОСl2, то [CO]o=1,2+0,2=1,4 моль/л; [Cl2]o = 1,2+0,3=1,5 моль/л.
Контрольні завдання
- Обчислити значення константи швидкості реакції А + В → АВ, якщо за концентрації речовин А і В, що дорівнюють відповідно 0,5 і 0,1 моль/л, швидкість реакції становить 0,005 моль/(лхв).
Відповідь: 0,1 л/(мольхв).
- Реакція між речовинами А і В описується рівняннями А + 2В → С. Початкові (вихідні) концентрації становлять: [А]о = 0,3 моль/л; [В]о = 0,5 моль/л. Константа швидкості реакції дорівнює 0,4. Обчислити початкову швидкість реакції і швидкість на момент, коли концентрація речовини А зменшиться на 0,1 моль/л.
Відповідь: vo = 0,03; v1 = 0,0072.
- Реакція відбувається за рівнянням N2(г) + О2(г)
 2NО(г). Концентрації вихідних речовин: [N2]o = 0,049 моль/л; [О2]o = 0,01 моль/л. Обчислити концентрації цих речовин на момент, коли [NО] = 0,005 моль/л.
2NО(г). Концентрації вихідних речовин: [N2]o = 0,049 моль/л; [О2]o = 0,01 моль/л. Обчислити концентрації цих речовин на момент, коли [NО] = 0,005 моль/л.
Відповідь: [N2]p = 0,0465 моль/л; [О2]p = 0,0075 моль/л.
- Реакція відбувається за рівнянням N2(г) + 3Н2(г)
 2NH3(г). Концентрації речовин, які беруть участь в реакції, складали:
2NH3(г). Концентрації речовин, які беруть участь в реакції, складали:
[N2]o = 0,80 моль/л; [H2]o = 1,5 моль/л; [NH3]o = 0,10 моль/л. Обчислити концентрації водню і аміаку, коли [N2]p = 0,5 моль/л.
Відповідь: [NH3]p = 0,70 моль/л; [H2]p = 0,60 моль/л.
- Реакція перебігає за рівнянням Н2(г) + І2(г)
 2НІ(г). Константа шви-дкості цієї реакції за певної температури дорівнює 0,16. Початкові концентрації реагуючих речовин: [Н2]o = 0,04 моль/л; [І2]o =0,05 моль/л. Обчислити початкову швидкість реакції і її швидкість, коли [Н2]p = 0,03 моль/л.
2НІ(г). Константа шви-дкості цієї реакції за певної температури дорівнює 0,16. Початкові концентрації реагуючих речовин: [Н2]o = 0,04 моль/л; [І2]o =0,05 моль/л. Обчислити початкову швидкість реакції і її швидкість, коли [Н2]p = 0,03 моль/л.
Відповідь: vo = 3,2 10 -2; v1 = 1,92 10 -3.
- Константа швидкості реакції розкладу N2О, яка перебігає за рівнянням 2N2О(г)
 2N2(г) + О2(г), дорівнює 5 10-4. Початкова концентрація [N2О]o = 6 моль/л. Обчислити початкову швидкість реакції і її швидкість, коли розкладеться 50% N2О.
2N2(г) + О2(г), дорівнює 5 10-4. Початкова концентрація [N2О]o = 6 моль/л. Обчислити початкову швидкість реакції і її швидкість, коли розкладеться 50% N2О.
Відповідь: vo = 1,8 10 -2; v1 = 4,5 10 -3.
- У гомогенній системі А+2В
 С рівноважні концентрації реагуючих газів складають: [A]p = 0,06 моль/л; [B]p = 0,12 моль/л; [C]p = 0,216 моль/л. Обчислити константу рівноваги системи і початкові концентрації речовин А і В.
С рівноважні концентрації реагуючих газів складають: [A]p = 0,06 моль/л; [B]p = 0,12 моль/л; [C]p = 0,216 моль/л. Обчислити константу рівноваги системи і початкові концентрації речовин А і В.
Відповідь: К=250; [A]o = 0,276 моль/л; [B]o=0,552 моль/л.
- У гомогенній газовій системі А + В
 С + Д рівновага настає за концентрацій: [В]p = 0,05 моль/л і [C]p = 0,02 моль/л. Константа рівноваги системи дорівнює 0,04.Обчислити початкові концентрації речовин А і В.
С + Д рівновага настає за концентрацій: [В]p = 0,05 моль/л і [C]p = 0,02 моль/л. Константа рівноваги системи дорівнює 0,04.Обчислити початкові концентрації речовин А і В.
Відповідь: [A]o = 0,22 моль/л; [B]o=0,07 моль/л.
- У скільки разів зміниться швидкість реакції 2А + В
 А2В, якщо концентрацію речовини А збільшити вдвічі, а концентрацію речовини В зменшити вдвічі?
А2В, якщо концентрацію речовини А збільшити вдвічі, а концентрацію речовини В зменшити вдвічі?
Відповідь: vo = 1; v1 = 2.
- Обчислити константу рівноваги для гомогенної системи
СО(г) + Н2О(г) СО2 (г) + Н2 (г), якщо на момент рівноваги концентрації реагуючих речовин складали: [СО]p = 0,004 моль/л; [Н2О]p = 0,064 моль/л; [CО2]p = 0,016 моль/л, [Н2]p = 0,016 моль/л. Чому дорівнюють початкові концентрації води і СО?
СО2 (г) + Н2 (г), якщо на момент рівноваги концентрації реагуючих речовин складали: [СО]p = 0,004 моль/л; [Н2О]p = 0,064 моль/л; [CО2]p = 0,016 моль/л, [Н2]p = 0,016 моль/л. Чому дорівнюють початкові концентрації води і СО?
Відповідь: К = 1,0; [Н2О]o = 0,08 моль/л; [СО]o = 0,02 моль/л.
- Дві реакції перебігають за 25 оС з однаковою швидкістю. Температурний коефіцієнт швидкості першої реакції дорівнює 2,0, а другої – 2,5. Обчислити відношення швидкостей цих реакцій за 95оС.
Відповідь: v2 /v1 = 4,77.
- Константа рівноваги гомогенної системи:
СО(г) + Н2О(г)![]() СО2 (г) + Н2 (г),
СО2 (г) + Н2 (г),
за певної температури дорівнює 1,0. Обчислити концентрації усіх реагуючих речовин на момент рівноваги, якщо початкові концентрації становили: [СО]о = 0,1 моль/л; [Н2О]о = 0,4 моль/л.
Відповідь: [СО2]р = [Н2]р = 0,08 моль/л; [СО]o = 0,02 моль/л; [Н2О]р = 0,32 моль/л.
- Чому дорівнює температурний коефіцієнт швидкості реакції, якщо при збільшенні температури на 30 оС швидкість реакції збільшується у 25,6 рази?
Відповідь: γ = 2,9.
- Температурний коефіцієнт швидкості хімічної реакції дорівнює 2,3. У скільки разів збільшиться швидкість цієї реакції, якщо підвищити температуру на 25 оС?
Відповідь: у 8 разів.
- Константа рівноваги гомогенної системи:
N2(г) + 3Н2(г)![]() 2NH3(г),
2NH3(г),
за певної температури дорівнює 0,1. Рівноважні концентрації водню і аміаку дорівнюють 0,2 і 0,08 моль/л відповідно. Обчислити рівноважну і початкові концентрації N2.
Відповідь: [N2]р = 8 моль/л; [Н2]р = 8,04 моль/л.
- За 150 оС хімічна реакція перебігає за 16 хв. Враховуючи, що температурний коефіцієнт швидкості реакції дорівнює 2,5, обчислити, через який час ця реакція закінчиться, якщо здійснювати її: а) за 200 оС; б) за 80 оС.
Відповідь: а) 9,8 с; б) 162 год. 46 хв.
- За певної температури настала рівновага у гомогенній системи:
2NО(г) + О2(г) 2NО2(г). Концентрація реагуючих речовин на момент рівноваги становила: [NО]р = 0,2 моль/л; [О2]р = 0,1 моль/л; [NО2]р =
2NО2(г). Концентрація реагуючих речовин на момент рівноваги становила: [NО]р = 0,2 моль/л; [О2]р = 0,1 моль/л; [NО2]р =
= 0,1 моль/л. Обчислити константу рівноваги і початкові концентрації NО і О2.
Відповідь: К=2,5; [NО]о = 0,3 моль/л; [О2]o= 0,15 моль/л.
- Початкові концентрації [NО]о і [Cl2]о у гомогенній системі:
2NО(г) + Cl2 (г)![]() 2NОCl(г),
2NОCl(г),
становили 0,5 і 0,2 моль/л відповідно. Обчислити константу рівноваги, якщо до моменту встановлення рівноваги прореагувало 20% NО.
Відповідь: К = 0,416.
- Початкові концентрації [СО]о і [Н2О]о дорівнюють 0,03 моль/л. Обчислити рівноважні концентрації СО, Н2О і Н2 у гомогенній системі СО(г) + Н2О(г)
 СО2 (г) + Н2 (г), якщо рівноважна концентрація [СО2]р = 0,01 моль/л, а також константу рівноваги.
СО2 (г) + Н2 (г), якщо рівноважна концентрація [СО2]р = 0,01 моль/л, а також константу рівноваги.
Відповідь: К=0,25; [СО]р=[Н2О]р=0,02 моль/л; [Н2]р = 0,01 моль/л.
- У системі СО(г) + Cl2 (г)
 СОCl2(г), концентрацію СО збільшили з 0,3 до 1,2 моль/л, а концентрацію Сl2 – з 0,2 до 0,6 моль/л. У скільки разів збільшилась швидкість прямої реакції?
СОCl2(г), концентрацію СО збільшили з 0,3 до 1,2 моль/л, а концентрацію Сl2 – з 0,2 до 0,6 моль/л. У скільки разів збільшилась швидкість прямої реакції?
Відповідь: у 12 разів.
- Користуючись довідковими даними (див. Додаток Д), обчислити константу рівноваги за 298 і 1000 К для реакції: СО(г) + Н2О(г)
 СО2(г) + Н2(г) Залежностями ΔНо та ΔSо від температури знехтувати.
СО2(г) + Н2(г) Залежностями ΔНо та ΔSо від температури знехтувати.
Відповідь: К298 = 1,3 105; КТ = 0,908.
- Обчислити температуру, за якої константа рівноваги реакції 2NO2(г)
 N2O4(г) дорівнює одиниці. Залежностями ΔНо і ΔSо від температури знехтувати. У якому напрямку буде зміщена рівновага за нижчих температур, ніж обчислена?
N2O4(г) дорівнює одиниці. Залежностями ΔНо і ΔSо від температури знехтувати. У якому напрямку буде зміщена рівновага за нижчих температур, ніж обчислена?
Відповідь: Т = 325,8 К; вправо.
- Використавши довідкові дані (див. Додаток Д), обчислити константу рівноваги за 298 і 1000 К для реакції СО2(г) + С(графіт)
 2СО(г). Залежностями ΔНо та ΔSо від температури знехтувати.
2СО(г). Залежностями ΔНо та ΔSо від температури знехтувати.
Відповідь: К298 = 3,5 10 -22; КТ = 1,45.
- Враховуючи, що ΔНо та ΔSо реакції 4НCl(г) + О2(г)
 2Н2О(г) + 2Cl2(г) не залежать від температури, обчислити температуру, за якої константа рівноваги цієї реакції дорівнює одиниці.
2Н2О(г) + 2Cl2(г) не залежать від температури, обчислити температуру, за якої константа рівноваги цієї реакції дорівнює одиниці.
Відповідь: 902,3 К.
- Використавши довідкові дані (див. Додаток Д), обчислити константу рівноваги за 298 і 1000 К для реакції N2(г) + 3Н2(г)
 2NH3(г). Залежностями ΔНо та ΔSо від температури знехтувати.
2NH3(г). Залежностями ΔНо та ΔSо від температури знехтувати.
Відповідь: К298 = 3,35 10 5; КТ = 1,11 10 -6.
- Обчислити температуру, за якої константа рівноваги реакції
СО(г) + Н2О(г) СО2(г) + Н2(г) дорівнює одиниці. Залежностями ΔНо і ΔSо від температури знехтувати.
СО2(г) + Н2(г) дорівнює одиниці. Залежностями ΔНо і ΔSо від температури знехтувати.
Відповідь: Т = 980,95 К.
- Використавши довідкові дані (див. Додаток Д), обчислити константу рівноваги за 298 і 1000 К для реакції Pb(к) + CuO(к)
 PbO(к) + Сu(к). Залежностями ΔНо та ΔSо від температури знехтувати.
PbO(к) + Сu(к). Залежностями ΔНо та ΔSо від температури знехтувати.
Відповідь: 1,0097; 1,0069.
- Враховуючи, що ΔНо та ΔSо реакції:
Fe3O4(к) + СО(г)![]() 3FeО(к) + CО2(г)
3FeО(к) + CО2(г)
не залежать від температури, обчислити температуру, за якої константа рівноваги цієї реакції дорівнює 1,0.
Відповідь: 757,6 К.
- Використавши довідкові дані (див. Додаток Д), обчислити константу рівноваги за 298 і 1000 К для реакції Ni(к) + PbО(к)
 NiO(к) + Pb(к). Залежностями ΔНо та ΔSо від температури знехтувати.
NiO(к) + Pb(к). Залежностями ΔНо та ΔSо від температури знехтувати.
Відповідь: 1,0037; 1,0025.
- Обчислити температуру, за якої константа рівноваги реакції
СО(г) + Cl2 (г) СОCl2(г) дорівнює 1,0. Залежностями ΔНо і ΔSо від температури знехтувати.
СОCl2(г) дорівнює 1,0. Залежностями ΔНо і ΔSо від температури знехтувати.
Відповідь: 797 К.
- Використавши довідкові дані (див. Додаток Д), обчислити константу рівноваги за 298 і 1000 К для реакції Fe2O3(к)+3Н2(г)
 2Fe(к)+3Н2О(г). Залежностями ΔНо та ΔSо від температури знехтувати.
2Fe(к)+3Н2О(г). Залежностями ΔНо та ΔSо від температури знехтувати.
Відповідь: 0,9188; 0,9403.
- Обчислити температуру, за якої константа рівноваги реакції
СаСО3(к) CаО(к) + СО2(г) дорівнює 1,0. Залежностями ΔНо і ΔSо від температури знехтувати.
CаО(к) + СО2(г) дорівнює 1,0. Залежностями ΔНо і ΔSо від температури знехтувати.
Відповідь: 1080,75 К.
- Користуючись довідковими даними (див. Додаток Д), обчислити константу рівноваги за 298 і 1000 К для реакції:
Fe2O3(к) + 3СО(г)![]() 2Fe(к) + 3CО2(г).
2Fe(к) + 3CО2(г).
Залежностями ΔНо та ΔSо від температури знехтувати.
Відповідь: 1,005; 1,0037.
- Обчислити температуру, за якої константа рівноваги реакції
СО2(г) + C(графіт) 2СО(г) дорівнює 1,0. Залежностями ΔНо і ΔSо від температури знехтувати.
2СО(г) дорівнює 1,0. Залежностями ΔНо і ΔSо від температури знехтувати.
Відповідь: 982,34 К.
- Використавши довідкові дані (див. Додаток Д), обчислити константу рівноваги за 298 і 1000 К для реакції СO2(г)+4Н2(г)
 СН4(г)+2Н2О(р). Залежностями ΔНо та ΔSо від температури знехтувати.
СН4(г)+2Н2О(р). Залежностями ΔНо та ΔSо від температури знехтувати.
Відповідь: 1,021; 1,016.
- Обчислити температуру, за якої константа рівноваги реакції
N2(г) + 3Н2(г) 2NH3(г) дорівнює 1,0. Залежностями ΔНо і ΔSо від температури знехтувати.
2NH3(г) дорівнює 1,0. Залежностями ΔНо і ΔSо від температури знехтувати.
Відповідь: 448,1 К.
- Враховуючи, що ΔНо та ΔSо реакції:
СO2(г) + 4Н2(г)![]() СН4(г) + 2Н2О(р)
СН4(г) + 2Н2О(р)
не залежать від температури, обчислити температуру, за якої константа рівноваги цієї реакції дорівнює 1,0.
Відповідь: 963,1 К.
- Користуючись довідковими даними (див. Додаток Д), обчислити константу рівноваги за 298 і 1000 К для реакції:
СO(г) + 2Н2(г)![]() СН3ОН(р).
СН3ОН(р).
Залежностями ΔНо та ΔSо від температури знехтувати.
Відповідь: 1,0048; 1,0035.
- Обчислити температуру, за якої константа рівноваги реакції
2NO2(г) 2NO(г) + О2(г) дорівнює 1,0. Залежностями ΔНо і ΔSо від температури знехтувати.
2NO(г) + О2(г) дорівнює 1,0. Залежностями ΔНо і ΔSо від температури знехтувати.
Відповідь: 779,1 К.
- Враховуючи, що ΔНо та ΔSо реакції:
СН4(г) + Н2О(г)![]() СО(г) + 3Н2(г)
СО(г) + 3Н2(г)
не залежать від температури, обчислити температуру, за якої константа рівноваги цієї реакції дорівнює 1,0.
Відповідь: 963,1 К.