7 Розчини. Концентрація розчинів
Важливою характеристикою розчинів є їх концентрація – це вміст розчиненої речовини в певному об’ємі (масі) розчину або розчинника. Її виражають наведеними нижче способами.
Молярна концентрація (СМ) – це кількість молів розчиненої речовини в 1 л розчину;
Моляльна концентрація компоненту (Сm) – це кількість молів розчиненої речовини в 1 кг (1000 г) розчинника, наприклад, води:
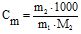 , (7.1)
, (7.1)
де m1 і m2 – маса розчинника і розчиненої речовини відповідно, М2 – молярна маса розчиненої речовини;
Молярна частка (N2) – це відношення кількості молів розчиненої речовини (n2) до загальної кількості молів у системі, тобто до суми молів розчинника (n1) і всіх розчинених у ньому речовин. Для бінарного розчину:
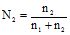 (7.2);
(7.2); ![]() або
або 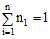 (7.3)
(7.3)
Масова частка (W) – це відношення маси розчиненої речовини до маси розчину:
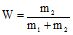 або
або 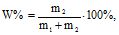 (7.4)
(7.4)
де m1 – маса розчинника, г; m2 – маса розчиненої речовини, г;
Молярна концентрація еквіваленту (СН) – це кількість молів еквівалентів розчиненої речовини в 1 л розчину, (мольeкв)/л:
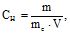 (7.5)
(7.5)
де me – еквівалентна маса, г/(мольекв); m – маса розчиненої речовини (г) в 1 л розчину; V – об’єм розчину в літрах.
Титр розчину (Т) – це маса розчиненої речовини, яка міститься у 1 мл розчину.
Приклади розв’язування типових задач
Приклад 1 У 450 г води розчинили 50 г CuSO4 5H2O. Обчислити масову частку кристалогідрату та безводної солі у розчині.
Розв’язування: Масова частка W = mречовини/mрозчину
W1 = mкристалогідр./mрозчину; W2 = ![]() /
/ ![]()
mрозчину = 450+50 = 500 г; W1=50/500=0,1
W2 = 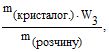 де W3 =
де W3 = 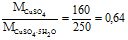
Звідки W2 = ![]() або у відсотках: W1 = 0,1 100% = 10%;
або у відсотках: W1 = 0,1 100% = 10%;
W2 = 0,064100%=6,4%.
Приклад 2 Обчислити: а) відсоткову, б) СМ, СН, Сm концентрації розчину H3PO4, одержаного при розчиненні 18 г кислоти у 282 мл води, якщо густина розчину 1,031 г/см3.
Розв’язування: W=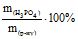 ; CM = ν/V , моль/л;
; CM = ν/V , моль/л;
СН = νекв/V, моль/л; m(р-ну) = 18+282=300 г
V(р-ну) = 300/1,031=291 мл або 0,291 л
Тоді W = ![]() ;
; 
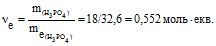 Звідки:
Звідки:
СМ = 0,184/0,290=0,63; СН = 0,552/0,291=1,90; 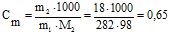
Приклад 3 Скільки грамів 32%-ного розчину нітратної кислоти необхідно додати до 600 г 80%-ного розчину тієї самої кислоти, щоб одержати 64%-ний розчин?
Розв’язування: Для розв’язання такого типу задач можна застосувати метод змішування (“правило хреста”). Записують концентрації вихідних розчинів і розчину, який потрібно одержати, як це показано на схемі:
80 32 ч (80%)
64
- 16 ч (32%)
48 ч (64%)
Як видно із наведеної схеми, на 32 частини 80%-ного розчину, необхідно взяти 16 ч 32%-ного розчину, тоді:
32 ч – 16 ч
600 ч – х г (32%-ного р-ну)
Маса нового розчину складає: m = 600 + 300 = 900 ч
Перевірка: в 900 ч 64%-ного розчину складає:
m = 900 0,64 = 576 г
Маса HNO3 в 600 г 80%-ного і 300 г 32%-ного розчинів дорівнює:
m = (600 0,8) + (300 0,32) = 480 + 96 = 576 г
Приклад 4 На нейтралізацію 20 мл розчину кислоти витрачено 10 мл розчину лугу (СН = 0,5). Чому дорівнює СН кислоти?
Розв’язування: Речовини взаємодіють між собою в однакових кількостях еквівалентів:
СН(лугу) V(лугу) = СН(к-та) V(к-та)
Тоді:
Приклад 5 Скільки грамів сульфатної кислоти міститься в 23,5 см3 розчину з СН = 0,542, враховуючи, що еквівалент сульфатної кислоти взято відносно до реакції повного заміщення водню в кислоті?
Розв’язування:

Контрольні завдання
- Скільки грамів калій хлориду потрібно додати до 450 г 8%-ного розчину тієї самої солі, щоб одержати 12%-ний розчин?
Відповідь: 20,45 г.
- Із 10 кг 20%-ного розчину при охолодженні виділилося 400 г солі. Чому дорівнює відсоткова концентрація охолодженого розчину?
Відповідь: 16,7%.
- У якій масі води необхідно розчинити 40 г калій броміду для одержання 4%-ного розчину?
Відповідь: 960 г.
- Із 400 г 50%-ного розчину сульфатної кислоти випарували 100 г води. Чому дорівнює відсоткова концентрація цього розчину?
Відповідь: 66,7%.
- До 3 л 10%-ного розчину HNO3 (густиною 1,054 г/см3) додали 5 л 2%-ного розчину тієї самої кислоти (густиною 1,009 г/см3). Обчислити відсоткову і молярну концентрації одержаного розчину, об’єм якого дорівнює 8 л.
Відповідь: 5%; СМ = 0,82.
- У якій масі води потрібно розчинити 67,2 л гідроген хлориду (н.у.), щоб одержати 9%-ний розчин хлоридної (соляної) кислоти?
Відповідь: 1107 г.
- Змішали 300 г 20%-ного розчину і 500 г 40%-ного розчину натрій хлориду. Чому дорівнює відсоткова концентрація одержаного розчину?
Відповідь: 32,5%.
- Який об’єм води необхідно додати до 100 мл 20%-ного розчину сульфатної кислоти (густина 1,14 г/см3), щоб одержати 5%-ний розчин?
Відповідь: 342 мл.
- Яку масу натрій нітрату необхідно розчинити у 400 г води, щоб приготувати 20%-ний розчин?
Відповідь: 100 г.
- До 950 г води додали 50 мл 48%-ного розчину сульфатної кислоти (густина 1,38 г/см3). Обчислити відсотковий вміст сульфатної кислоти в одержаному розчині.
Відповідь: 3,25%.
- Скільки грамів Na2SO4 10H2O необхідно розчинити у 250 г води, щоб одержати розчин, який містить 5%-тів безводної солі?
Відповідь: 32 г.
- Визначити відсоткову концентрацію розчину, одержаного змішуванням 300 г 25%-ного і 400 г 40%-ного розчинів.
Відповідь: 33,6%.
- Обчислити відсотковий вміст кристалогідрату і безводної солі у розчині, який містить 100 г FeSO4 7H2O у 900 г води.
Відповідь: 10,0%; 5,47%.
- Для приготування 5%-ного розчину магній сульфату взято 400 г MgSO4 7Н2О. Знайти масу одержаного розчину.
Відповідь: 3,9 кг.
- Скільки молів води необхідно додати до 1,6 кг 25%-ного розчину натрій гідроксиду для одержання 16%-ного розчину?
Відповідь: 50 моль.
- Із 750 кг 48%-ного розчину сульфатної кислоти випарували 300 кг води. Визначити відсотковий вміст сульфатної кислоти в одержаному розчині. Відповідь: 80%.
- Скільки грамів BaCl2 2Н2О необхідно для реакції обміну із 75 мл 2,3%-ного розчину сульфатної кислоти (густиною 1,015 г/см3)?
Відповідь: 4,36 г.
- У якій масі води необхідно розчинити 50 г сульфатної кислоти, щоб одержати 10%-ний розчин?
Відповідь: 25 моль.
- У якій масі води необхідно розчинити 25 г CuSO4 5Н2О, щоб одержати 8%-ний розчин CuSO4?
Відповідь: 175 г.
- Змішали 247 г 62%-ного і 145 г 18%-ного розчинів сульфатної кислоти. Яка відсоткова концентрація одержаного розчину?
Відповідь: 45,72%.
Водневий показник і гідроліз солей
Гідроліз – це окремий випадок реакції протолізу і його механізм для різних типів сполук буде різним залежно від того, катіон чи аніон солі, яка піддається гідролізу, бере участь у реакції.
Гідроліз за катіоном. Катіони металів існують у водних розчинах у вигляді аквакомплексів певного складу. Наприклад: [Cu(H2O)4]2+, [Cr(H2O)6]3+ тощо, у яких молекули води зв’язані з центральним атомом (катіоном металу) ковалентними зв’язками, утвореними за донорно-акцепторним механізмом (катіон – акцептор, молекули води – донори електронних пар). Далі гідратація таких аквакомплексів молекулами води здійснюється за рахунок водневих зв’язків.
Наприклад, сульфат міді у водному розчині дисоціює на іони:
CuSO4 →Cu2+ + SO42-
Іон Cu2+ утворює з молекулами води аквакомплекс
Cu2+ + 4Н2О ![]() [Cu(H2O)4]2+
[Cu(H2O)4]2+
Щоб пояснити механізм гідролізу за катіоном, необхідно з’ясувати вплив центрального атома Cu2+ на одну із координованих біля нього молекул води, яка зв’язана з іншою молекулою води у гідратній оболонці слабшим водневим зв’язком (за схемою):
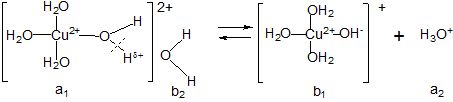
Центральний атом поляризує зв’язок –О Нδ+ у молекулі води, відштовхуючи від себе позитивно поляризований атом водню, що приводить до послаблення і розриву цього зв’язку зі зміцненням водневого зв’язку і переносом протону на молекулу води у гідратній оболонці (з утворенням Н3О+).
Таким чином, аквакомплекс у даній рівноважній системі виступає як донор протону, тобто як кислоти (а1), якій відповідає супряжена основа (b1). Основою (b2) є молекула води (розчинника), якій відповідає супряжена кислота Н3О+ (а2). Вона зумовлює кисле середовище розчину. Спрощено записують так:
І
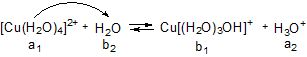
ІІ
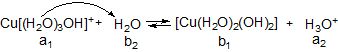
Слід пам’ятати, що гідролізу за катіоном піддаються солі, утворені слабкими основами, і тим більше, чим менше Кb (або більше рКb) основи. Солі, утворені сильними основами, гідролізу за катіоном не піддаються.
Гідроліз за аніоном. Гідратація аніонів здійснюється за рахунок водневих зв’язків, утворених негативно поляризованим атомом аніона і позитивно поляризованим атомом водню молекули води у гідратній оболонці невизначеного складу (залежить від ряду умов).
Наприклад, карбонат натрію у водному розчині дисоціює на іони
Na2CO3 →2Na+ + CO32-
Негативно заряджений СО32--іон притягує до себе позитивно поляризований атом водню молекули води, додатково поляризує її з перетворенням водневого зв’язку у ковалентний, при цьому протон переноситься від молекули води до аніона за схемою:
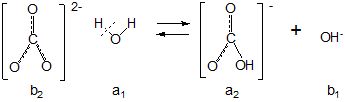
Скорочено записують так:
СО32 - + Н2О ![]() НСО3- + ОН
НСО3- + ОН![]()
b2 а1 а2 b1
Реакція середовища лужна, що зумовлено нагромадженням у розчині
ОН–-йонів.
Чим більший заряд і менший розмір аніона, тим в більше сіль піддається гідролізу. Такі реакції найбільш характерні для аніонів CO32-, PO43-, SO32-, CN-, NO2-, CH3COO- та ін., тобто гідролізу за аніоном піддаються солі, утворені слабкою кислотою і тим більше, чим менше Ка (або більше рКа) кислоти.
Контрольні завдання
- Скласти іонно-молекулярні рівняння гідролізу і вказати реакцію середовища наступних сполук: AlCl3 (к.ч. 6), CuSO4 (к.ч. 4), NaCN, KNO3.
- Скласти іонно-молекулярні рівняння гідролізу і вказати реакцію середовища наступних сполук: ZnCl2 (к.ч. 4), MgSO4 (к.ч. 6), K3PO4, NaCl.
- Скласти іонно-молекулярні рівняння гідролізу і вказати реакцію середовища наступних сполук: FeCl3 (к.ч. 6), Cu(NO3)2 (к.ч. 4), KOCl, Na2S.
- Скласти іонно-молекулярні рівняння гідролізу і вказати реакцію середовища наступних сполук: Cr(NO3)3 (к.ч. 6), ZnSO4 (к.ч. 4), KNO2, NaHCO3.
- Скласти іонно-молекулярні рівняння гідролізу і вказати реакцію середовища наступних сполук: FeSO4 (к.ч. 6), NH4Cl, KCN, K2HPO4.
- Скласти іонно-молекулярні рівняння гідролізу і вказати реакцію середовища наступних сполук: Cr2(SO4)3 (к.ч. 6), MgBr2 (к.ч. 6), KOCl, KHS.
- Скласти іонно-молекулярні рівняння гідролізу і вказати реакцію середовища наступних сполук: AlCl3 (к.ч. 6), CuCl2 (к.ч. 4), CH3COONH4, NaBr.
- Скласти іонно-молекулярні рівняння гідролізу і вказати реакцію середовища наступних сполук: CrCl3 (к.ч. 6), ZnCl2 (к.ч. 4), Na2SO3, K2S.
- Скласти іонно-молекулярні рівняння гідролізу і вказати реакцію середовища наступних сполук: Al2(SO4)3 (к.ч. 6), CuSO4 (к.ч. 4), NaNO3, CH3COONH4.
- Скласти іонно-молекулярні рівняння гідролізу і вказати реакцію середовища наступних сполук: Cr(NO3)3 (к.ч. 6), MgCl2 (к.ч. 6), NaHSO3, CH3COOK.
- Скласти іонно-молекулярні рівняння гідролізу і вказати реакцію середовища наступних сполук: FeCl3 (к.ч. 6), ZnBr2 (к.ч. 4), Ca(OCl)2, KH2PO4.
- Скласти іонно-молекулярні рівняння гідролізу і вказати реакцію середовища наступних сполук: Cr2(SO4)3 (к.ч. 6), NH4Br, KCl, (NH4)2S.
- Скласти іонно-молекулярні рівняння гідролізу і вказати реакцію середовища наступних сполук: MgSO4 (к.ч. 6), ZnCl2 (к.ч. 4), Na2CO3, KHS.
- Скласти іонно-молекулярні рівняння гідролізу і вказати реакцію середовища наступних сполук: Fe2(SO4)3 (к.ч. 6), MgSO4 (к.ч. 6), NH4Br, CH3COONH4.
- Скласти іонно-молекулярні рівняння гідролізу і вказати реакцію середовища наступних сполук: AlCl3 (к.ч. 6), MgBr2 (к.ч. 6), NaBr, (NH4)2S.
- Скласти іонно-молекулярні рівняння гідролізу і вказати реакцію середовища наступних сполук: Cr(NO3)3 (к.ч. 6), ZnCl2 (к.ч. 4), K2HPO4, NaOCl.
- Скласти іонно-молекулярні рівняння гідролізу і вказати реакцію середовища наступних сполук: FeSO4 (к.ч. 6), MgSO4 (к.ч. 6), KCN, CH3COONH4.
- Скласти іонно-молекулярні рівняння гідролізу і вказати реакцію середовища наступних сполук: MgCl2 (к.ч. 6), Zn(NO3)2 (к.ч. 4), CH3COONa, NaCl.
- Скласти іонно-молекулярні рівняння гідролізу і вказати реакцію середовища наступних сполук: Fe2(SO4)3 (к.ч. 6), CuBr2 (к.ч. 4), (NH4)2S, KBr.
- Скласти іонно-молекулярні рівняння гідролізу і вказати реакцію середовища наступних сполук: Al(NO3)3 (к.ч. 6), ZnSO4 (к.ч. 4), NaNO2, Na2S.