9 Електроліз
Електроліз – це окисно-відновний процес, який перебігає на електродах у розплаві чи розчині електроліту під дією постійного електричного струму. Електрод, з’єднаний з негативним полюсом джерела струму, називається катодом, а з’єднаний з позитивним полюсом – анодом. На катоді відбуваються процеси відновлення, а на аноді - окиснення.
Приклади розв’язування типових задач
Електроліз розплаву солей
Приклад 1 Які процеси окиснення-відновлення перебігають на катоді і на аноді при електролізі розплаву NaCl з графітовими електродами?
Розв’язування:
В розплаві NаСІ дисоціює на йони:
NаСІ → 2Na+ + 2Cl- .
Катіони під дією електричного струму будуть рухатись до катода і приймати від нього електрони (відновлюватись). На аноді буде відбуватися процес окиснення хлорид-йонів:
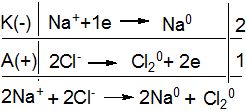
Таким чином, у результаті електролізу розплаву NaCl, одержують Na і Сl2.
Приклад 2 Які окисно-відновні процеси перебігають на інертних електродах при електролізі розплаву NaOH?
Розв’язування: У розплаві NaOH містяться Na+- і ОН--іони, які рухаються відповідно до катоду і аноду. Процеси, які перебігають при цьому, записують таким чином: NaОН → Na+ + ОН-.

Таким чином, біля катоду відновлюється натрій, а на аноді окиснюються ОН--іони (катодний і анодний простір – відокремлені!).
Електроліз у водному розчині
Внаслідок того, що вода може проявляти властивості як окисника, так і відновника, то при електролізі водних розчинів електролітів біля електродів можуть відновлюватися і окиснюватися не лише іони електроліту, а й сама вода. Це залежить від порівняльної величини електродних потенціалів води і іонів електроліту.
Приклад 3 Які процеси перебігають на електродах при електролізі водного розчину NaCl з графітовими електродами?
Розв’язування: В цьому розчині знаходяться йони Na![]() і Cl
і Cl![]() у вигляді гідратованих йонів, а також вільні молекули води. Якщо система, в якій проводять електроліз, містить різні окисники (в даному випадку Na
у вигляді гідратованих йонів, а також вільні молекули води. Якщо система, в якій проводять електроліз, містить різні окисники (в даному випадку Na![]() і Н2О), то на катоді буде відновлюватися найбільш активний із них, або – окиснена форма тієї електрохімічної системи, якій відповідає найбільше значення електродного потенціалу (за алгебраїчною величиною).
і Н2О), то на катоді буде відновлюватися найбільш активний із них, або – окиснена форма тієї електрохімічної системи, якій відповідає найбільше значення електродного потенціалу (за алгебраїчною величиною).
Порівняємо потенціали двох окиснених форм :
Na + 1![]() → Na
→ Na![]() ;
; ![]() = -2,71 В
= -2,71 В
2H2O + 2![]() → H2 + 2OH
→ H2 + 2OH![]() ;
; ![]() = -0,81 В.
= -0,81 В.
Отже, -0,81 В>-2,71 В. Це означає. що на катоді будуть розряджатися молекули води, а не йони натрію
2H2O + 2![]() → H2 + 2OH
→ H2 + 2OH![]() .
.
Аналогічно, за наявності в системі декількох відновників, на аноді буде окиснюватися найбільш активна із них, або – відновлена форма тієї електрохімічної системи, яка характеризується найменшим значенням електродного потенціалу. Наприклад:
2Cl![]() → Cl2 + 2
→ Cl2 + 2![]()
![]() = +1,36 В
= +1,36 В
2H2O → O2 + 4H![]() + 4
+ 4![]()
![]() = +1,23 В.
= +1,23 В.
Отже, під час електролізу водних розчинів хлоридів можливий перебіг двох процесів на інертному аноді, так як вони мають близькі значення ![]() . Однак, в даному відбувається перший процес: 2Cl
. Однак, в даному відбувається перший процес: 2Cl![]() → Cl2 + 2
→ Cl2 + 2![]() , не дивлячись на те, що
, не дивлячись на те, що ![]() >
>![]() , так як це зумовлено гальмівною дією матеріалу анода на другий процес. Таким чином, на катоді виділяється водень, а на аноді - хлор, а в катодному просторі накопичується NaOH. Склавши рівняння двох електродних процесів, одержують загальне рівняння процесу електролізу водного розчину NaCl:
, так як це зумовлено гальмівною дією матеріалу анода на другий процес. Таким чином, на катоді виділяється водень, а на аноді - хлор, а в катодному просторі накопичується NaOH. Склавши рівняння двох електродних процесів, одержують загальне рівняння процесу електролізу водного розчину NaCl:
NaCl → Na+ + Cl-
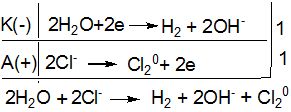
або в молекулярній формі 2NaCl + 2H2O → H2 + Cl2 + 2NaOH.
Приклад 4 Які процеси перебігають на електродах при електролізі водного розчину K2SO4 з інертними електродами?
Розв’язування: У водному розчині K2SO4 дисоціює на йони:
K2SO4 → 2K+ + SO![]()
Так як катіони лужних металів не відновлюються у водних розчинах, то процес електролізу буде зводитись до катодного відновлення і анодного окиснення молекул води:
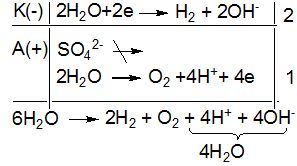
У навколо катодному просторі утворюється КОН, а біля анода H2SO4, але якщо катодний і анодний простори не розділені діафрагмою, то:
Н![]() + ОН
+ ОН![]() → H2O
→ H2O
Продуктами електролізу біля катоду є водень і ОН--іони, які з К+-іонами утворюють КОН, а біля аноду – виділяється кисень і Н+-іони, які з SO42--іонами утворюють Н2SO4 (при розділеному катодному і анодному просторах).
В цілому процес виражається рівнянням:
К2SO4 + 4Н2О ![]() 2Н2 + О2 + 2КOH + H2SO4
2Н2 + О2 + 2КOH + H2SO4
Якщо розчини біля катодного і анодного простору перемішують, то відбувається реакція нейтралізації: 2КOH + H2SO4 → К2SO4 + 2H2O і у результаті продуктами електролізу є лише Н2 і О2.
Приклад 5. Які процеси будуть відбуватися на електродах під час електролізу водного розчину сульфату цинку з інертними електродами.
Розв'язування: У водному розчині ZnSO4 будуть міститися такі йони:
ZnSO4 → Zn2+ + SO![]()
Під час електролізу поблизу катода будуть знаходитись катіони Zn2+ і вода. Так як стандартний електродний потенціал цинкового електроду дорівнює –0,76 В, то на катоді будуть відбуватися паралельно два процеси: відновлення катіонів Zn![]() і води. Йони SO
і води. Йони SO![]() будуть накопичуватись біля анода, але окиснюватись не будуть, замість них окиснюється вода, в результаті чого виділяється кисень:
будуть накопичуватись біля анода, але окиснюватись не будуть, замість них окиснюється вода, в результаті чого виділяється кисень:

після скорочень:
Zn2+ + 2Н2O → Zn0 + Н2 + О2 + 2Н+
або у молекулярному вигляді:
ZnSO4 + 2H2O ![]() Zn0 + Н2 + O2 + H2SO4
Zn0 + Н2 + O2 + H2SO4
Приклад 6 Які процеси перебігають на електродах при електролізі водного розчину CuSO4 з інертними електродами?
Розв’язування: У водному розчині містяться Сu2+-іони і SO42--іони. Стандартний електродний потенціал ![]() = 0,34 В, а
= 0,34 В, а ![]() = -0,81 В. Таким чином, на катоді будуть відновлюватися Сu2+-іони, а на аноді – окиснюватися вода.
= -0,81 В. Таким чином, на катоді будуть відновлюватися Сu2+-іони, а на аноді – окиснюватися вода.
Схематично ці процеси відображають таким чином:

або у молекулярному вигляді:
CuCl2 ![]() Cu0 + Cl20
Cu0 + Cl20
Електроліз з розчинним анодом
У випадку розчинного аноду електрони у зовнішній ланцюг посилає сам анод (виготовляють із Сu, Ag, Zn, Co, Ni, Fe і ін.), тоді як у випадку нерозчинного аноду (графіт, платина, вугілля і ін.) електрони надсилаються у зовнішній ланцюг в результаті окиснення аніонів і молекул води.
Приклад 6 Які процеси перебігають на електродах при електролізі водного розчину CuSO4 з мідним анодом?
Розв’язування: У даному випадку відновниками біля аноду можуть бути SO42--іони, Н2О або Сu0. Порівнюють стандартні електродні потенціали цих відновників:
2 SO42-![]() S2O82- + 2e Е0 = + 2,05 В
S2O82- + 2e Е0 = + 2,05 В
2 Н2О ![]() О2 + 4Н+ + 4е Е0 = + 1,23 В
О2 + 4Н+ + 4е Е0 = + 1,23 В
Cu ![]() Cu2+ + 2e Е0 = + 0,34 В
Cu2+ + 2e Е0 = + 0,34 В
Порівняння свідчать про те, що потенціал Купруму – найменший. Таким чином, Купрум є кращим відновником і тому на аноді відбувається окиснення мідного аноду, при цьому перебігає процес: Cu → Cu2+ + ![]() . .
. .
Схема електролізу водного розчину CuSO4 з мідним анодом:
CuSO4 → Cu2+ + SO42-
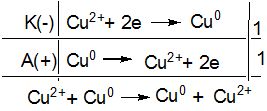
У результаті цього процесу мідь переноситься з аноду на катод (анодне розчинення металу).
Закони Фарадея
Приклад 7 Яка маса міді виділиться на катоді за 1 год електролізу розчину CuSO4 силою струму 4 А?
Розв’язування: Еквівалентна маса міді визначається рівнянням
Сu2+ + 2е =Сu0 і буде дорівнювати: me(Cu) = 63,54/2=31,77 г/моль. Відносно до законів Фарадея 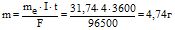
Приклад 8 Струм силою 2,5А виділив протягом 15 хв 0,72 г міді із розчину купрум (ІІ) сульфату. Знайти коефіцієнт корисної дії (ККД) струму.
Розв’язування: Вихід за струмом визначають із формули 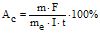 . Еквівалентна маса Купруму (me) 31,77 г/моль (див. Приклад 7).
. Еквівалентна маса Купруму (me) 31,77 г/моль (див. Приклад 7).
Тобто 
Перевірка: Обчислимо, скільки міді повинно виділитися згідно наведених умов: ![]()
Тоді: ![]()
Приклад 9 Знайти еквівалентну масу металу, якщо при електролізі розчину його хлориду затрачено 3880 Кл струму, а на катоді виділилося 11,742 г металу.
Розв’язування: Оскільки ![]() , то
, то ![]() , звідки
, звідки 
Приклад 10 В процесі електролізу водного розчину хром (ІІІ) сульфату струмом силою 2А маса катоду збільшилась на 8,0 г. Протягом якого часу проводили електроліз?
Розв’язування: Еквівалентна маса хрому визначається за рівнянням:
Cr3+ + 3e = Cr0 і дорівнює 51,996/3=17,332 г/моль. Із формули 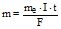 знаходимо t =
знаходимо t =![]() 22270,9 с або 22270,9/3600=6,186 год.
22270,9 с або 22270,9/3600=6,186 год.
Контрольні завдання
Завдання 1 Розв’язати задачу за наведеною умовою
- При електролізі розчину солі кадмію виділилося 2 г кадмію. Яка кількість електричного струму затрачена при цьому, якщо me(Cd) =
= 56,25 г/моль.
Відповідь: 3430 Кл.
- Як можна добути літій гідроксид електролітичним способом? Яку кількість електричного струму потрібно затратити для добування 1 тонни LiOH? Скласти схеми електродних процесів.
Відповідь: 4 109 Кл.
- При електролізі розчину купрум (ІІ) сульфату на аноді виділилося 168 см3 газу (н.у.). Скласти електродні рівняння процесів, які перебігають на інертних електродах, і обчислити, яка маса міді виділиться на катоді
Відповідь: 0,953 г.
- Визначити СН аргентум (І) нітрату, якщо для виділення всього срібла з 80 см3 цього розчину потрібно пропускати струм силою 0,8 А протягом 20 хв?
Відповідь: СН = 0,124.
- Якою силою струму можна протягом 15 хв виділити усю мідь з 120 см3 розчину купрум (ІІ) нітрату з СН = 0,2 ?
Відповідь: 2,57 А.
- При електролізі водного розчину станум (ІІ) хлориду на аноді виділилося 4,48 л хлору (н.у.). Знайти масу олова, яка виділилася на катоді.
Відповідь: 23,7 г.
- При проходженні струму силою 3,0 А через розчин солі тривалентного металу протягом 30 хвилин на катоді виділилося 2,142 г металу. Визначити атомну масу металу.
Відповідь: 114,82 а.о.м.
- Обчислити еквівалентну масу металу, знаючи, що при електролізі розчину хлориду цього металу затрачено 38606 Кл електричного струму і на катоді виділилося 11,742 г металу.
Відповідь: 29,35 г/моль.
- При електролізі розчинів магній сульфату і цинк (ІІ) хлориду, з’єднаних послідовно з джерелом струму, на одному із катодів виділилося 0,25 г водню. Яка маса речовини виділиться на другому катоді і на анодах?
Відповідь: 8,17 г; 2,0 г; 8,86 г.
- При електролізі солі тривалентного металу силою струму 1,5 А протягом 30 хв на катоді виділилося 1,071 г металу. Обчислити атомну масу металу.
Відповідь: 114,82 а.о.м.
- Протягом якого часу потрібно проводити електроліз 250 см3 6%-ного розчину меркурій (ІІ) хлориду, (ρ = 1,05 г/ см3? Сила струму 5,8 А.
Відповідь: 32,3 хв.
- Яка маса срібла виділиться при проходженні струму силою 6А через розчин аргентум (І) нітрату протягом 30 хв?
Відповідь: 12 г.
- Який об’єм водню (н.у.) виділиться при проходженні струму силою 3А протягом 1 год через водний розчин сульфатної (сірчаної) кислоти?
Відповідь: 1,25 л.
- Електроліз розчину цинк (ІІ) сульфату проводили протягом 5 год, у результаті виділилося 6 л кисню (н.у.). Скласти рівняння електродних процесів і обчислити силу струму.
Відповідь: 5,74 А.
- Для виділення 1,75 г деякого металу з розчину його солі потрібно пропустити струм силою 1,8 А протягом 1,5 год. Обчислити еквівалентну масу металу.
Відповідь: 17,37 г/моль.
- Струм силою 3,5 А протягом 25 хв виділив 0,92 г міді з розчину купрум (ІІ) сульфату. Обчислити коефіцієнт корисної дії струму.
Відповідь: 53,25%
- При електролізі розчину хлориду двовалентного металу на аноді виділилося 560 см3 газу (н.у.), а на катоді за цей же час – 1,6 г металу. Що це за метал?
Відповідь: Сu (мідь).
- Який об’єм кисню (н.у.) виділиться при пропусканні струму силою 6А протягом 30 хв через водний розчин КОН?
Відповідь: 0,627 л.
- На скільки зменшиться маса срібного анода, якщо електроліз розчину аргентум (І) нітрату проводити силою струму 2 А протягом 30хв 20 с? Скласти електронні рівняння процесів, які відбуваються на графітових електродах.
Відповідь: 5,148 г.
- Під час електролізу водного розчину хром (ІІІ) сульфату струмом силою 2 А маса катоду збільшилась на 8 г. Протягом якого часу проводили електроліз?
Відповідь: 6,186 год.
- Електроліз розчину калій сульфату проводили силою струму 5 А протягом 3 год. Скласти електронні рівняння процесів, що відбуваються на електродах. Яка маса води при цьому розклалася і чому дорівнює об’єм газів (н.у.), які виділилися на катоді і аноді?
Відповідь: 5,036 г; 6,266 л; 3,133 л.
- За 10 хв з розчину солі платини струм силою 5 А виділив 1,517 г платини. Обчислити еквівалентну масу платини.
Відповідь: 48,8 г/моль.
- Протягом скількох хвилин потрібно пропускати струм силою 0,5 А через розчин аргентум (І) нітрату, щоб виділити 0,27 г срібла?
Відповідь: 8 хв.
- Скільки грамів міді виділиться на катоді у результаті електролізу розчину купрум (ІІ) сульфату протягом 40 хв силою струму 1,2 А?
Відповідь: 0,948 г.
- Чому дорівнює еквівалентна маса кадмію, якщо для виділення 1 г кадмію із розчину його солі потрібно пропустити через розчин 1717Кл струму?
Відповідь: 56,2 г/моль.
- Скласти електронні рівняння процесів, які перебігають на електродах під час електролізу розчину КОН. Чому дорівнює сила струму, якщо протягом 1 год 15 хв 20 с на аноді виділилось 6,4 г газу (якого?). Скільки літрів газу (н.у.) виділилось на катоді (якого?).
Відповідь: 17,08 А; 8,96 л.
- Під час електролізу солі деякого металу протягом 1,5 год з силою струму 1,8 А на катоді виділилось 1,75 г цього металу. Обчислити еквівалентну масу металу.
Відповідь: 17,37 г/моль.
- Скільки годин доведеться витратити для повного розкладу 2 моль води струмом силою 2 А?
Відповідь: 53,6 год.
- Скільки літрів водню виділиться на катоді, якщо проводити електроліз розчину К2SO4 протягом 2,5 год з силою струму 1,2 А? Об’єм газу виміряно за 27 оС і 764 мм.рт.ст.
Відповідь: 1,37 л.
- Скласти електронні рівняння процесів, які перебігають на графітових електродах під час електролізу розчину натрій сульфату. Обчислити масу речовини, що виділиться на катоді, якщо на аноді виділяється
1,12 л газу (н.у.)? Яка маса сульфатної (сірчаної) кислоти утворюється при цьому біля аноду?
Відповідь: 0,2 г; 9,8 г.
- Електроліз розчину сульфату деякого металу проводили силою струму 6 А протягом 45 хв, у результаті на катоді виділилося 5,49 г металу. Обчислити еквівалентну масу металу.
Відповідь: 32,7 г/моль.
- Струм силою 10 А проходить через електролізер, у якому знаходиться 0,5 л 4,5%-ного розчину натрій гідроксиду, густиною 1,05 г/см3. Через скільки годин концентрація натрій гідроксиду у розчині досягне 10% ?
Відповідь: 86 год.
- Яка кількість електричного струму необхідна для виділення із розчину: а) 2 г водню; б) 2 г кисню?
Відповідь: а) 1,93 10 5 Кл; б) 2,45 10 4 Кл.
- Скласти електронні рівняння процесів, які перебігають на графітових електродах при електролізі розчину купрум (ІІ) хлориду. Обчислити масу міді, яка виділиться на катоді, якщо на аноді виділилось 560 см3 газу (н.у.).
Відповідь: 1,588 г.
- Електроліз розчину натрій йодиду проводили силою струму 6 А протягом 2,5 год. Обчислити маси речовин, які виділяться на катоді і аноді.
Відповідь: 0,56 г Н2; 71,06 г І2.
- Скласти електронні рівняння процесів, які перебігають на графітових електродах при електролізі розплавів і водних розчинів NaCl і КОН. Скільки літрів газу (н.у.) виділиться на аноді при електролізі розчину КОН, якщо електроліз проводили протягом 30 хв силою струму 0,5А?
Відповідь: 0,052 л.
- Електроліз розчину купрум (ІІ) сульфату проводили з мідним анодом протягом 15 хв силою струму 2,5 А, при цьому виділилося 0,72 г міді. Скласти електронні рівняння реакцій, які перебігають на електродах, якщо анод: а) мідний, б) графітовий. Обчислити вихід міді за струмом.
Відповідь: 97,3%.
- Скласти електронні рівняння процесів, які перебігають на графітових електродах при електролізу розчину аргентум (І) нітрату. Якщо електроліз проводити із срібним анодом, то його маса зменшиться на 5,4 г. Визначити витрати електричного струму при цьому.
Відповідь: ≈4830 Кл.
- Струм проходить послідовно через два електролізери, які містять відповідно 750 см3 розчину аргентум (І) нітрату (СН = 0,12) і розчин цинк (ІІ) сульфату. Скільки грамів цинку виділиться на катоді за час, необхідний для хімічного перетворення даної кількості аргентум (І) нітрату?
Відповідь: 2,94 г.
- Електроліз розчину купрум (ІІ) сульфату проводили з мідним анодом протягом 4 год силою струму 50 А, при цьому виділилося 224 г міді. Обчислити вихід міді за струмом. Скласти електронні рівняння процесів електролізу CuSO4, які перебігають на аноді: а) мідному, б) графітовому.
Відповідь: 94,49%.
Завдання 2 Скласти рівняння процесів, які перебігають на інертних електродах під час електролізу водних розчинів:
- KCl; Cd(NO3)2; AgNO3
- Na2SO4; FeSO4; CuSO4
- NaNO3; FeCl2; HgSO4
- MgCl2; ZnSO4; Cu(NO3)2
- LiNO3; ZnCl2; HgCl2
- AlCl3; MnSO4; AgNO3
- Ca(NO3)2; CdCl2; AuCl3
- Na2SO4; Ni(NO3)2; CuCl2
- Al2(SO4)3; МnCl2; Hg(NO3)2
- LiCl; NiSO4; AuCl3
- MgSO4; FeSO4; Cu(CH3COO)2
- AlCl3; Ni(NO3)2; AgNO3
- K2SO4; Pb(NO3)2; Hg(NO3)2
- CuCl2; SnSO4; AgNO3
- Li2SO4; MnSO4; AuCl3
- MgCl2; Pb(NO3)2; Cu(NO3)2
- LiNO3; SnCl2; Hg(NO3)2
- KNO3; MnSO4; AuCl3
- NaNO3; NiSO4; AgNO3
- MgSO4; Fe2(SO4)3; Hg(NO3)2