2 Стехіометричні розрахунки за основними газовими законами
Стан газу характеризується його температурою, тиском і об’ємом. Якщо температура газу дорівнює 0 оС, а тиск – нормальному атмосферному (101,325 кПа або 760 мм рт. ст.), то такі умови, за яких знаходиться газ, називаються нормальними. Об’єм, який займає газ за даних умов, прийнято позначати через V0, а тиск – через Р0.
Згідно закону Бойля-Маріотта, за постійної температури тиск, який здійснюється даною масою газу, обернено пропорційний об’єму газу:
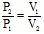 або PV = const (2.1)
або PV = const (2.1)
Залежність між об’ємом газу, тиском і температурою можна виразити загальним рівнянням, яке об’єднує закони Бойля-Маріотта і Гей-Люссака:
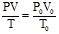 (2.2)
(2.2)
де P і V – тиск і об’єм газу за даної температури Т; Р0 і V0 – тиск і об’єм газу за нормальних умов (н.у.), Т0 = 273 К.
Приклади розв’язування типових задач
Приклад 1 За 27 оС об’єм газу дорівнює 600 мл. Який об’єм займає газ за 57 оС, якщо тиск залишиться постійним?
Розв’язування: Позначають об’єм, який необхідно обчислити, через V2, а відповідну йому температуру через Т2. За умовою задачі V1=600 мл, Т1 = 273 + 27 = 300 К і Т2 = 273 + 57 = 330 К. Тоді за законом Бойля-Маріотта:
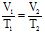 ;
;  , звідси
, звідси 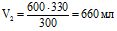
Приклад 2 За 15 оС тиск у балоні з киснем дорівнює 91,2 102 кПа. За якої температури він стане рівним 101,33 10 2 кПа?
Розв’язування: Позначають температуру, яку обчислюють, через Т2. За умовою задачі Т1 = 273 + 25 = 288 К, Р1 = 91,2 102 кПа, Р2 = 101,33 102 кПа. Тоді, за законом Гей-Люссака:
 , звідси
, звідси 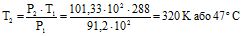
Приклад 3 За 25 оС і тиску 99,3 кПа (745 мм рт.ст.) деяка кількість газу займає об’єм 152 мл. Знайти, який об’єм займе ця ж кількість газу за 0оС і тиску 101,33 кПа.
Розв’язування: Підставляють дані із умови задачі в рівняння (1.2) і одержують:
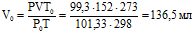
Приклад 4 Змішують 2 л О2 і 4 л SO2, взятих за однакового тиску, який дорівнює 100 кПа (750 мм рт. ст.); об’єм суміші 6 л. Визначити парціальний тиск газів у суміші.
Розв’язування: Парціальний тиск газу у суміші – це тиск, який здійснював би цей газ, займаючи за тих же фізичних умов об’єм усієї газової суміші.
За умовою задачі об’єм кисню збільшився після змішування в 6/2=3 рази, об’єм сульфур діоксиду – в 6/4=1,5 рази. У стільки ж раз зменшиться парціальний тиск газів:
![]() ,
, ![]()
Приклад 5 Змішують 3 л СО2, 4 л О2 і 6 л N2. До змішування тиск СО2, О2 і N2 складав відповідно 96; 108 і 90,6 кПа. Загальний об’єм суміші 10 л. Визначити тиск газової суміші.
Розв’язування: Згідно закону парціальних тисків, загальний тиск суміші газів, що не вступають у хімічну взаємодію між собою, дорівнює сумі парціальних тисків газів, які складають суміш.
Знаходять парціальний тиск окремих газів (див. приклад 4):
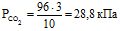
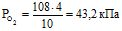
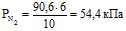
Звідси: Рзаг. = 28,8 + 43,2 + 54,4 = 126,4 кПа
Приклад 6 Обчислити молекулярну масу бензену С6Н6, якщо відомо, що маса 600 мл його пари за 87 оС і тиску 83,2 кПа дорівнює 1,3 г.
Розв’язування: Виражають дані задачі у одиницях СІ (Р=8,32104Па;
V = 6 10–4 м3; m = 1,3 10–3 кг; Т = 360 К) і підставляють їх у рівняння Клапейрона-Менделєєва:
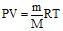 ,
, 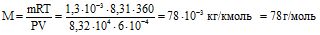
Відносна молекулярна маса бензену дорівнює 78 а.о.м.
Контрольні завдання
- Обчислити мольну масу газу, якщо маса 600 мл його за нормальних умов дорівнює 1,714 г.
Відповідь: 64 г/моль.
- Маса 0,001 м3 газу (0 оС, 101,33 кПа) дорівнює 1,25 г. Обчислити:
а) мольну масу газу; б) масу однієї молекули газу.
Відповідь: а) 28 г/моль; б) 4,65 10–23 г.
- За температури 17 оС і тиску 104 кПа (780 мм рт. ст.) маса 624 мл газу дорівнює 1,56 г. Обчислити молекулярну масу газу.
Відповідь: 58 а. о. м.
- Який об’єм займає 1 кг повітря за температури 17 оС і тиску 101,33кПа?
Відповідь: 820 л.
- Обчислити масу 1 м3 повітря за температури 17 оС і тиску 83,2 кПа (624 мм рт. ст.).
Відповідь: 1 кг.
- Маса 0,001 м3 газу за нормальних умов дорівнює 0,0021 кг. Обчислити мольну масу газу і його густину за повітрям.
Відповідь: 47 г/моль; 1,62.
- Обчислити мольну масу ацетону, якщо маса 500 мл його пари за 87оС і тиску 96 кПа (720 мм рт. ст.) дорівнює 0,93 г.
Відповідь: 58 г/моль.
- Газова суміш виготовлена із 2 л Н2 (Р = 93,3 кПа) і 5 л СН4 (Р = =112кПа). Об’єм суміші дорівнює 7 л. Знайти парціальний тиск газів і загальний тиск суміші.
Відповідь: ![]() = 26,7 кПа;
= 26,7 кПа; ![]() = 80 кПа, Рзаг = 106,7 кПа.
= 80 кПа, Рзаг = 106,7 кПа.
- Газова суміш складається із NO і СО2. Обчислити об’ємний вміст газів у суміші (у %), якщо їх парціальний тиск дорівнює відповідно 36,3 і 70,4 кПа (272 і 528 мм рт. ст.).
Відповідь: 34% NO, 66% СО2.
- У закритій посудині ємністю 0,6 м3 знаходиться за 0 оС суміш, яка складається із 0,2 кг СО2, 0,4 кг О2 і 0,15 кг СН4. Обчислити: а) загальний тиск суміші; б) парціальний тиск кожного із газів; в) відсотковий склад суміші за об’ємом.
Відповідь: 100 кПа, 17,2% СО2; 47,3% О2; 35,5% СН4.
- Тиск газу, який займає об’єм 2,5 л, дорівнює 121,6 кПа (912 мм рт. ст.). Чому буде дорівнювати тиск, якщо не змінюючи температуру, стиснути газ до об’єму в 1л?
Відповідь: 304 кПа.
- Маса 344 мл газу за 42 оС і 772 мм рт. ст. дорівнює 0,865 г. Обчислити молекулярну масу газу.
Відповідь: 64 а. о. м.
- Маса 85,5 мл пари метилового спирту за 91 оС і 768 мм рт. ст. дорівнює 0,0925 г. Обчислити молекулярну масу спирту.
Відповідь: 32 а. о. м.
- Балон ємністю 20 л містить 3 кг кисню. Обчислити тиск у балоні за
20 оС.
Відповідь: 112,62 атм.
- Газометр ємністю 20 л наповнено газом, густина якого за повітрям дорівнює 0,40, тиск 103,3 кПа (774,8 мм.рт.ст.), температура 17 оС. Обчислити масу газу.
Відповідь: 9,94 г.
- Маса 1 л азоту за нормальних умов дорівнює 1,251 г. Обчислити густину азоту за воднем.
Відповідь: 14.
- За 17 оС деяка кількість газу займає об’єм 580 мл. Який об’єм займе ця ж кількість газу за 100 оС, якщо тиск залишиться незмінним?
Відповідь: 746 мл.
- На скільки градусів необхідно нагріти газ, який знаходиться у закритій посудині за 0 оС, щоб тиск його збільшився вдвічі?
Відповідь: на 273 градуси.
- За тиску 98,7 кПа і температури 91 оС деяка кількість газу займає об’єм 608 мл. Знайти об’єм газу за нормальних умов.
Відповідь: 444 мл.
- Тиск газу у закритій посудині за 12 оС дорівнює 100 кПа (750 мм рт. ст.). Яким стане тиск газу, якщо нагріти посудину до 30 оС?
Відповідь: 106,3 кПа.