3 Основні хімічні поняття і закони. Еквіваленти і еквівалентні маси речовин
Хімічним еквівалентом елементу називається така його кількість, яка сполучається з одним молем атомів Гідрогену або заміщує таку саму кількість атомів Гідрогену в хімічних реакціях.
Еквівалентною масою називається маса одного еквівалента елементу (речовини). Таким чином, еквіваленти виражають у молях, а еквівалентні маси – у г/моль.
Приклади розв’язування типових задач
Приклад 1 Визначити еквіваленти (Е) та еквівалентні маси (me) Хлору, Оксигену та Нітрогену в сполуках HCl, H2O і H3N (NH3).
Розв’язування: Маса і кількість речовини – це не ідентичні поняття, оскільки маса речовини виражається у кілограмах (грамах), а кількість речовини – у молях.
У наведених сполуках з одним молем атомів Гідрогену сполучається один моль атомів Хлору, 1/2 моль атомів Оксигену і 1/3 моль атомів Нітрогену. Таким чином, згідно з визначенням, еквіваленти Хлору, Оксигену та Нітрогену дорівнюють відповідно 1 моль, 1/2 та 1/3 моль, тоді як їх еквівалентні маси складають: mе(Cl) =35,45 г/моль; mе(O) =16/2 = 8 г/моль;
mе(N) = 14/3 = 4,67 г/моль.
Приклад 2 Із 3,85 г нітрату металу одержано 1,6 г його гідроксиду. Обчислити еквівалентну масу металу me.
Розв’язування: При розв’язанні задачі потрібно мати на увазі, що: а) еквівалентна маса гідроксиду дорівнює сумі еквівалентних мас металу та гідроксильної групи; б) еквівалентна маса солі дорівнює сумі еквівалентних мас металу та кислотного залишку.
Еквівалентну масу будь-якої зарядженої частинки можна визначити, поділивши молекулярну масу її на заряд. Наприклад:
![]() г/моль;
г/моль; ![]() г/моль
г/моль
Тобто, за законом еквівалентів:
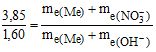 або
або 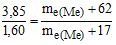
Звідки me(Me) = 15 г/моль.
Приклад 3 На нейтралізацію 0,943 г фосфітної кислоти Н3РО3 витрачено 1,288 г КОН. Обчислити еквівалент, еквівалентну масу і основність кислоти. На підставі розрахунку написати рівняння реакції.
Розв’язування: Еквівалентна маса КОН дорівнює його молярній масі – 56 г/моль. За законом еквівалентів 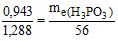 . Звідки
. Звідки 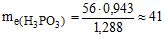 г/моль.
г/моль.
Молярна маса Н3РО3 дорівнює 82 г/моль. Тобто, еквівалент Н3РО3 дорівнює 41/82 = 0,5 моль; основність кислоти n дорівнює М/me, тобто n = 82/41 = 2. Отже при взаємодії з КОН заміщується два атома водню у кислоті:
Н3РО3 + 2КОН = К2НРО3 + 2Н2О
Приклад 4 Скільки грамів металу, еквівалентна маса якого 12,16 г/моль, взаємодіє з 310 мл кисню (н.у.)?
Розв’язування: Об’єм еквівалентної маси кисню (8 г/моль) дорівнюватиме:
![]() л або 5600 мл
л або 5600 мл
За законом еквівалентів:
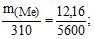
![]() г
г
Контрольні завдання
- При взаємодії 2,7 г оксиду металу з нітратною кислотою одержано 6,3 г його нітрату. Обчислити еквівалентну масу цього металу.
Відповідь: 32,5 г/моль.
- На нейтралізацію 1,96 г Н3РО4 витрачено 2,4 г натрій гідроксиду. Обчислити еквівалент, еквівалентну масу та основність Н3РО4 у цій реакції. На підставі розрахунку написати рівняння реакції.
Відповідь: 1/3 моль; 32,666 г/моль; 3.
- На відновлення 3,18 г оксиду двовалентного металу витрачено 0,896 л водню (н.у.). Обчислити еквівалентну, молярну та атомну масу металу.
Відповідь: 31,75 г/моль; 63,5 г/моль; 63,5 а.о.м.
- На нейтралізацію 2,829 г Н3РО3 витрачено 3,864 г КОН. Обчислити еквівалент, еквівалентну масу та основність кислоти. На підставі розрахунку написати рівняння реакції.
Відповідь: 0,5 моль; 41 г/моль; 2.
- При взаємодії 3,24 г тривалентного металу з кислотою добуто 4,03 л водню (н.у.). Обчислити еквівалентну, молярну і атомну маси металу.
Відповідь: 9 г/моль; 27 г/моль; 27 а.о.м.
- До розчину, який містить 4,1 г Н3РО3, додали 2 г натрій гідроксиду. Обчислити еквівалент, еквівалентну масу і основність Н3РО3 у цій реакції. На підставі розрахунку написати рівняння реакції.
Відповідь: 1 моль; 82 г/моль; 1.
- При відновленні воднем 10,17 г оксиду двовалентного металу утворилося 2,25 г води. Обчислити еквівалентні маси оксиду та металу. Чому дорівнює атомна маса металу?
Відповідь: 40,68 г/моль; 32,68 г/моль; 65,36 а.о.м.
- На нейтралізацію 2,45 г кислоти витрачено 2 г натрій гідроксиду. Обчислити еквівалентну масу кислоти.
Відповідь: 49 г/моль.
- При взаємодії 2,6 г гідроксиду металу з сульфатною кислотою одержано 5,7 г сульфату цього металу. Обчислити еквівалентну масу металу.
Відповідь: 9 г/моль.
- До розчину, який містить 1,96 г Н3РО4, додали 2,24 г КОН. Обчислити еквівалент, еквівалентну масу і основність Н3РО4 у цій реакції. На підставі розрахунку написати рівняння реакції.
Відповідь: 0,5 моль; 49 г/моль; 2.
- Оксид тривалентного металу містить 31,58% кисню. Обчисліть еквівалентну і атомну маси металу.
Відповідь: 17,33 г/моль; 51,99 а.о.м.
- На нейтралізацію 1,64 г Н3РО3 витрачено 1,6 г натрій гідроксиду. Обчислити еквівалент, еквівалентну масу і основність Н3РО3. На підставі розрахунку написати рівняння реакції.
Відповідь: 0,5 моль; 41 г/моль; 2.
- При відновленні воднем 2,4 г оксиду металу одержано 0,54 г води. Обчислити еквівалентні маси оксиду і металу.
Відповідь: 40 г/моль; 32 г/моль.
- На нейтралізацію 0,98 г Н3РО4 витрачено 0,8 г натрій гідроксиду. Обчислити еквівалент, еквівалентну масу і основність Н3РО4 у цій реакції. На підставі розрахунку написати рівняння реакції.
Відповідь: 0,5 моль; 49 г/моль; 2.
- При взаємодії 3,31 г нітрату металу з хлоридною кислотою одержано 2,78 г його хлориду. Обчислити еквівалентну масу цього металу.
Відповідь: 103,5 г/моль.
- На нейтралізацію 2,64 г Н3РО2 витрачено 1,6 г натрій гідроксиду. Обчислити еквівалент, еквівалентну масу і основність Н3РО2. На підставі розрахунку написати рівняння реакції.
Відповідь: 1 моль; 66 г/моль; 1.
- На окиснення 3,24 г тривалентного металу витрачено 2,019 л кисню. Обчислити еквівалентну, молярну і атомну маси металу.
Відповідь: 9 г/моль; 27 г/моль; 27 а.о.м.
- До розчину, який містить 4,9 г Н3РО4, додали 3,7 г кальцій дигідроксиду Са(ОН)2. Обчислити еквівалент, еквівалентну масу і основність Н3РО4 у цій реакції. На підставі розрахунку написати рівняння реакції і знайти, скільки грамів солі утворилося при цьому.
Відповідь: 0,5 моль; 49 г/моль; 2; 6,8 г.
- Знайти еквівалентні маси металу і сірки, якщо 3,24 г металу утворюють 3,48 г оксиду і 3,72 г сульфіду.
Відповідь: 108 г/моль; 16 г/моль.
- На нейтралізацію 2,94 г H2SO4 витрачено 1,68 г КОН. Обчислити еквівалентну масу і основність кислоти. На підставі розрахунку написати рівняння реакції.
Відповідь: 1 моль; 98 г/моль; 1.