2.2 Теоретичні відомості
Білки – це високомолекулярні азотовмісні органічні сполуки, молекули яких побудовані із залишків амінокислот, з’єднаних пептидним зв’язком.
КЛАСИФІКАЦІЯ БІЛКІВ
Відома велика кількість білків рослинного і тваринного походження, що відрізняються за своїм складом та біологічною роллю в організмі. Задовільної універсальної системи класифікації білків не існує. Є лише декілька загальновживаних систем класифікацій, що ґрунтуються на походженні, функціях, формі молекул, фізико-хімічних властивостях. Для систематизації та вивчення їх запропоновано декілька класифікацій:
1. За походженням: рослинні, тваринні, вірусні, бактеріальні; з позицій органів та клітинних органел: білки плазми, м’язові білки, білки молока, яєць, рибосомні білки, білки клітинного ядра і т.д.
2. За функціями: ферментативні, структурні, скорочувальні, транспортні, резервні та рецепторні.
До структурних білків належить колаген – основна складовою частина з’єднувальної тканини. Більшість його знаходиться в сухожиллях, зв’язках, шкірі, кістках, хрящах. Колаген є у всіх багатоклітинних організмах, крім рослин. Його молекула витримує навантаження, вага якого в десятки тисяч разів більша від ваги білкової молекули. Тобто ці молекули міцніші, ніж сталевий дріт. Під час кип’ятіння м’язової тканини (м’яса) частина пептидних зв’язків у колагені піддається гідролізу, утворюється суміш пептидів, що називається желатином. Тривалість приготування м’ясних страв визначається умовами руйнування волокон колагену. Кератин – входить до складу сполучної і покривної тканин, волосся, пір’я, рогів. Еластин – входить до складу еластичних тканин і виконує структурні функції. З нього побудовані внутрішні оболонки судин.
Скорочувальні білки. Найкраще вивчені скорочувальні комплекси м’язових клітин. Вони складаються з білків двох типів – актину і міозину.
Транспортні білки утворюють комплекси з речовинами, які вони транспортують між тканинами або через мембрану. До таких білків належать дихальні білки, що переносять кисень. Дихальні білки поширені в багатьох живих організмах, починаючи від дріжджів і до вищих хребетних. В бульбочках бобових також знайдений дихальний білок. Всі вони зворотно приєднують молекули кисню (зв’язують його за високого вмісту в середовищі і віддають за пониженого). Дихальні білки містять йон Феруму, рідше Купруму (молюски і більшість членистоногих), який бере участь у зв’язуванні кисню. Гемоглобіни і міоглобіни містять йониFe2+ у складі небілкової частини – гему.
Захисні білки – антитіла відіграють важливу роль в захисті організму від чужорідних речовин і клітин. Антитіла – це імуноглобуліни, які виробляються клітинами імунної системи лімфоцитами і входять до складу сироватки крові та інших позаклітинних рідин, а також поверхні деяких клітин, наприклад, лімфоцитів. Організм виробляє антитіла на чужорідні білки, полісахариди, інші речовини, наприклад, нітрофенол, на ракові клітини, пилок рослин тощо. Антитіла проявляють високу специфічність до свого антигену.
3. За будовою молекул: глобулярні, (сферопротеїни), фібрилярні (склеропротеїни) та мембранні.
Фібрилярні білки – це білки, які утворені поліпептидними ланцюгами, що розташовані паралельно один одному уздовж однієї осі і утворюють довгі волокна (фібрили) або шар. Довжина молекул таких білків в декілька разів перевищує їх діаметр. Вони є нерозчинними у воді і розчинах солей. Фібрилярні білки – це велика група білків, що є основними структурними елементами сполучної тканини (колаген, кератин, еластин та ін.): білок волосся – кератин, білок шовку – фіброїн, білок м’язів – міозин, білок крові – фібрин.
Глобулярні білки – це білки, в молекулах яких поліпептидні ланцюги щільно згорнуті в компактні кулясті структури (глобули). До глобулярних білків відносяться ферменти, антитіла, деякі гормони і інші білки, що виконують в клітках динамічні функції. Це альбуміни та глобуліни сироватки крові, білки молока, яєць, які мають форму кулі. Правильної форми глобули не бувають, найчастіше вони мають еліпсоїдну або овальну форму.
Між двома крайніми формами білків є велика кількість перехідних форм – від кулеподібної до веретеноподібної і волокнистої.
4. За хімічним складом: прості і складні.
Прості білки, які утворюють під час гідролізу тільки амінокислоти або їх похідні. Складні білки – мають білкову частину, що складається із залишків амінокислот, і небілкову, що може бути представлена йонами металів, ліпідами, вуглеводами, залишком фосфорної кислоти.
До простих білків належать:
– альбуміни дуже поширені в тваринних та рослинних організмах, є основною частиною цитоплазми більшості клітин, складовою частиною крові, м’язів, молока, в крові вищих тварин і людей альбуміни складають більшу частину білків плазми; мають відносно малу молекулярну масу 60 кД; приймають участь у підтримці осмотичного тиску крові, транспортують у крові різні речовини (вітаміни, іони металів, гормони), виконують антитоксичну функцію;
– глобуліни, на відміну від альбумінів є більш грубо дисперсними, мають більшу молекулярну масу 160–180 кД; в організмі людини та тварин виконують роль антитіл;
– гістони і протаміни є основними білками ядра клітини і утворюють основну масу білкової частини нуклеопротеїдів; гістони стабілізують молекулу ДНК, підтримують унікальну структуру ДНК в ядрі, що є умовою для біосинтезу білку;
– склеропротєїни – білки опорних тканин (хрящів, кісток), вовни, волосся. Не розчинні у воді, слабких кислотах і лугах. колагени; еластини; кератин; фіброїн; проламіни і глютеніни (білки рослинного походження, містять велику кількість глютамінової кислоти і лізину).
Складні білки складаються з простого білку та небілкової частини. Їх класифікують за небілковою частиною:
– нуклеопротеїди – небілкова частина – нуклеїнові кислоти РНК та ДНК; білкова – протаміни та гістони;
– хромопротеїди в небілковій частині містять пігменти, до таких білків належать гемоглобін, міоглобін (білок м’язів), деякі ферменти каталази, пероксидази, цитохроми, а також хлорофіл);
– фосфопротеїди в небілковій частині мають залишок фосфорної кислоти: казеїн молока, вінелін (білок жовтка яєць), іхтулін (білок ікри риб);
– ліпопротеїди – небілкова (простетична) група – ліпід: ліпопротеїди (розчинні у воді), – протеоліпіди (жиророзчинні);
– глікопротеїди – небілкова частина – вуглеводи та їх похідні (гексуронова кислота, глікогенні амінокислоти). Група сполук, в яких білкова частина відносно слаба слабо зв’язана з вуглеводною називається мукопротеїдами (хондроітинсульфати, гіалуронові кислоти).
– металопротеїди – комплекси білків з важкими металами: феритин – кристалічний білок, розчинний у воді, містить до 20% Fе, є основною формою запасу заліза в організмі і синтезується в печінці, там він відкладається про запас; церулоплазмін містить 0,34% міді.
5. За розчинністю прості білки поділяють:
– альбуміни – розчинні у воді і сольових розчинах, нерозчинні в концентрованих розчинах солей, характеризуються високою гідрофільністю та дисперсністю, мають кислі властивості (ізоелектрична точка (ІЕТ) ≈ 4,7); не мають особливостей щодо вмісту окремих амінокислот; входять до складу молока, яєць, зерна злакових та бобових культур;
– глобуліни – слаборозчинні у воді, добре розчинні в розчинах солей; під час їх вилучення (екстракції) із різноманітних об’єктів використовують 2...10%-ний розчин хлориду натрію; слабокислі або нейтральні білки (ІЕТ 6,0...7,0); до них належать лактоглобулін молока, фібриноген крові, більша частина білків насіння бобових – легумін гороху, фазеолін квасолі, гліцидин сої;
– проламіни – розчинні в 70...80%-ному етанолі, нерозчинні у воді і абсолютному етанолі, багаті аргініном (гліадин пшениці, гордеїн ячменю, зеїн кукурудзи, орозеїн рису);
– глютеліни – не розчиняються ні в сольових розчинах, ні в спирті, але екстрагуються гідроксидами лужних металів (0,2%-ним розчином) (ІЕТ 5...7) знаходяться, як правило, спільно з проламінами (глютенін пшениці);
– гістони і протаміни розчинні в сольових розчинах; мають яскраво виражені основні властивості через великий вміст аргініну (ІЕТ 10,5...13,5);
– склеропротеїни (протеноїди) – нерозчинні у воді і сольових розчинах, багаті гліцином, аланіном і проліном.
ФУНКЦІОНАЛЬНІ ВЛАСТИВОСТІ БІЛКІВ
Завдяки унікальним функціональним властивостям білки знаходять своє застосування у виробництві харчових продуктів не тільки в якості поживної складової, а і як необхідний технологічний компонент, і як лікувально-профілактична добавка.
Функціональні властивості білків – це такі фізико-хімічні характеристики білків, що визначають їх поведінку під час переробки в харчові продукти і що забезпечують певну структуру, технологічні і споживчі властивості.
До найбільш важливих функціональних властивостей білків відносяться розчинність, водо- та жирозв'язувальна здатність, здатність стабілізувати дисперсні системи (емульсії, піни, суспензії), утворювати желе, плівкоутворювальна здатність, адгезійні і реологічні властивості (в'язкість, еластичність), здатність до текстурування.
Особливості функціональних властивостей білків зумовлюються специфічною послідовність амінокислотних залишків в поліпептидних ланцюгах, нерівномірним розташуванням гідрофобних і гідрофільних груп на поверхні білків, наявністю або відсутністю спіралізуючих ділянок, що в свою чергу впливає на наявність нековалентних взаємодій: гідрофобних, електростатичних і водневих зв'язків.
1. Розчинність є первинним показником оцінки функціональних властивостей білків, характеризується кількістю білка, що переходить в розчин і визначається коефіцієнтом розчинного азоту (КРА) і коефіцієнтом диспергованості білка (КДБ). У першому випадку визначають кількість азоту (у відсотках від загального), що перейшов у розчин; в другому – кількість білка (у відсотках від загального змісту його в продукті), що перейшов в розчин.
Білки з високою гідрофобністю добре взаємодіють з ліпідами, з високою гідрофільністю добре взаємодіють з водою. Внесок електростатичних сил в розчинність білків залежить від рН середовища і присутності солей. За рН, що відповідає ІЕТ, білки мають найменшу розчинність, оскільки сумарний заряд на їх молекулах дорівнює нулю і частинки позбавлені здатності відштовхуватися за рахунок електростатичних взаємодій з молекулами розчинника. У кислому або лужному середовищі, навпаки, забезпечується взаємодія протилежно заряджених іонів розчинника (Н+ або ОН- відповідно) з поверхнями білкових часток, заряджених позитивно в кислому середовищі і негативно в лужному, а значить і перехід білків в розчин. У кислому середовищі білок має позитивний заряд внаслідок пригнічення дисоціації карбоксильних (-СООН) груп, в лужній – негативний за рахунок пригнічення дисоціації основних (- NH2) груп.
Залежність розчинності білків від концентрації солей носить нелінійний характер. Під час додавання невеликих кількостей солей розчинність збільшується, оскільки іони перешкоджають електростатичній взаємодії бічних груп білка між собою. Високі концентрації солей, що знижують гідратацію поліпептидних ланцюгів, навпаки, посилюють гідрофобні білок-білкові взаємодії і призводять до випадання білка в осад (висолювання). Використання як розчинника води, розбавлених розчинів солей, лугів і водно-спиртових розчинів забезпечує перехід гетерогенних сумішей в розчин, відповідно, альбуміну, глобулінів, глютелінів і проламінів і отримання білкових фракцій, що розрізняються за амінокислотним складом, молекулярними масам і функціональними властивостями.
Водозв'язувальна здатність білків (або гідратація) характеризується адсорбцією води за участю гідрофільних залишків амінокислот. Білки здатні зв’язувати воду, тобто проявляють гідрофільні властивості. При цьому білки набухають, збільшуються їх маса і об’єм. Гідрофільність клейковинних білків – одна із ознак, що характеризує якість зерна і борошна. Цитоплазма клітини представлє собою стабілізовану суспензію із молекул білка. В процесі технологічної переробки сировини відбувається зв’язування води, продукти збільшуються в об’ємі – набухають.
Жирозв’язувальна – здатність білків характеризується адсорбцією жиру за рахунок гідрофобних залишків. За невисокої вологості гідрофільні групи, взаємодіючи з молекулами води, утворюють мономолекулярний шар, за високої – навколо глобул білка формується багатошарова структура з одночасним проникненням води в западини і виступи. Загальна кількість води і жиру на поверхні досягає 0,2...0,4 г на 1 г білків.
Здатність білків утримувати жир і воду залежить не лише від особливостей амінокислотного складу і структури, але і від фракційного складу, способу обробки, рН середовища, температури і присутності вуглеводів, ліпідів і інших білків. Висока здатність білків утримувати воду в харчових продуктах (м'ясних, хлібобулочних і так далі) підвищує вихід останніх, подовжує терміни зберігання і покращує текстуру. Денатуровані білки мають знижену водозв'язувальну здатність, і їх застосування негативно позначається на якості хліба. Висока жироутримувальна здатність білків забезпечує ніжну і однорідну текстуру виробів, виключає відділення жиру, зморщування виробів, зменшує втрати під час варіння і смаження.
Жироемульгувальна властивості білка – утворення білком на поверхні крапель жиру (за рахунок гідрофобної взаємодії) тонкої плівки, яка притягує воду (за рахунок полярних груп) і протидіє злипанню жирових частинок. Присутність в одному білковому ланцюзі гідрофобних і гідрофільних угрупувань забезпечує розподіл молекул певним чином на межі поділу фаз вода-олія і вода-газ. Орієнтація гідрофільних груп білка до води, а гідрофобних – до олії на межі поділу фаз у вигляді міцного адсорбційного шару знижує поверхневий натяг в дисперсних системах і робить їх агрегативно стійкими і одночасно в'язкими. Найбільш поширеними є харчові емульсії "олія у воді" і "вода в олії", що називаються, відповідно, прямими і зворотними. Усі види емульсій з білком отримують механічним диспергуванням однієї рідини в іншій за допомогою мішалок, гомогенізаторів, що забезпечують деформацію дисперсійного середовища з утворенням дрібних часток. На основі жироемульгувальних властивостей рослинні і тваринні білки застосовуються у виробництві хлібобулочних, борошняних кондитерських виробів, низькокалорійного маргарину, майонезу, паст, м'ясних продуктів, а піноутворювальні властивості є основою виробництва збитих кондитерських виробів (бісквітів, десертів, кремів і т. д.).
Піноутворення пов’язане зі здатністю білків утворювати висококонцентровані системи рідина – газ, тверде тіло – газ у вигляді піни. Білки виконують функцію піноутворення в кондитерській промисловості (суфле, пастила), у випіканні хліба, у виробництві пива. Поверхня газових пухирців покриває рідка або тверда оболонка, що складається із білків. У випадку, коли ця оболонка стоншується газові пухирці лопаються, відбувається коалесценція або з’єднання пухирців, піна стає пухкою, менш стійкою.
Піни (дисперсні системи з газоподібною фазою і рідким або твердим середовищем) отримують механічним розподілом повітря в розчині білка шляхом збивання або за рахунок закипання води, зниження тиску, забезпечення хімічних і мікробіологічних процесів у білкововмісних харчових системах. Так, білки клейковини утворюють піну в хлібному тісті під дією діоксиду вуглецю в ході бродіння, а в кондитерському – за рахунок хімічних розпушувачів під час виділення аміаку і діоксиду вуглецю. Піноутворювальні властивості білків характеризуються пінотворною здатністю і стабільністю піни. Перший показник вимірюється об'ємом піни, віднесеним до маси білку, другий – періодом її напіврозпаду, тобто часом, необхідним для руйнування половини об'єму піни. Обидва показники залежать від рН середовища, концентрації білку, солей, температури, присутності ліпідів, сахарози, харчових волокон, фракційного складу і будови білків. Стійкість структури піни є важливим фактором підвищення якості харчових продуктів, в том числі і пива.
Желеутворювальні властивості білків характеризуються здатністю їх колоїдного розчину із вільнодиспергованого стану переходити у зв’язанодисперсний (з утворенням систем, що мають властивості твердих тіл). Пружні властивості желе, що зумовлені утворенням просторової сітки взаємодіючих молекул білка, залежать від мінімальної його концентрації, за якої настає желеутворення (желе-точки), від рН, від присутності інших білків, солей, полісахаридів. Білок як желеутворювач повинен утворювати желе в широкому діапазоні рН, іонної сили, за мінімальної концентрації і з необхідними фізико-хімічними властивостями. До останніх відносяться міцність, твердість, еластичність, тиксотропія (здатність зворотно переходити в текучий стан за механічної обробки і знову утворювати нетекуче желе після зняття навантаження), температура розм'якшення і плавлення, ступінь набрякання, здатність до синерезису (відділення дисперсійного середовища із скороченням об'єму желе), сорбція барвників і ароматичних речовин і так далі. До подібного роду "універсальних" желеутворювачів відноситься желатин, що дозволяє в широких межах забезпечити регулювання хімічного складу і біологічну цінність харчових продуктів.
В'язко-еластично-пружні властивості. Характерною властивістю деяких харчових білків є низький рівень полярності функціональних груп. Молекули води, оточуючи частинки білків, відштовхуються, а молекули білків, навпаки, агрегуються з утворенням комплексів з притаманними їм властивостями (в'язкість, еластичність, пружність) реологій. Найбільш виражений комплекс таких властивостей мають білки пшеничної клейковини, хліби, що зумовлюють текстуру, і що створюють суцільну фазу у виробах з наповнювачами (зерно, висівки, родзинки). Пружність і еластичність білків зумовлена глютеніновою фракцією білків.
З метою забезпечення стабільності технологічного процесу, поліпшення якості і розширення асортименту харчових виробів здійснюють регулювання функціональних властивостей. Функціональні властивості білків визначаються їх структурою. Наприклад, в'язкість і желеутворювальні властивості співвідносяться з розміром і формою молекул, а водозв'язувальна здатність, піноутворювальні й емульгувальні властивості корелюють з співвідношенням на поверхні полярних і гідрофобних груп. Усі чинники, які змінюють структуру білків, призводять і до регулювання (модифікації) їх властивостей.
Регулювання функціональних властивостей білків досягається зміною умов їх виділення, висушування, фізичним, фізико-хімічним впливом, ферментативною і хімічною модифікацією. Параметри обробки можуть змінювати амінокислотний і фракційний склад білків, спричиняти денатурацію, агрегацію або взаємодію з іншими компонентами (ліпідами, вуглеводами).
ЯКІСНЕ І КІЛЬКІСНЕ ВИЗНАЧЕННЯ БІЛКІВ
Присутність білків в харчових продуктах встановлюється за допомогою якісних реакцій, які умовно розділяють на дві групи : а) кольорові реакції; б) реакції осадження.
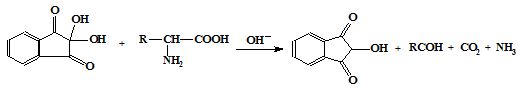
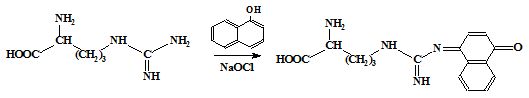
Серед першої групи розрізняють універсальні реакції (біуретова на пептидні зв'язки і нінгидринова на α-амінокислоти) і специфічні, зумовлені присутністю у білках залишків певних амінокислот. Так, ксантопротеїнова реакція свідчить про наявність у білках залишків ароматичних амінокислот, реакція Паулі – гістидину і Тирозину, Адамкевича і Вуазене – триптофану, нітропрусидна – цистеїну, а реакція Сакагучі – аргініну. За результатами специфічних реакцій орієнтовно можна зробити висновок про харчову цінність білків.
У другій групі реакцій білки осаджують дією солей, органічних розчинників, концентрованих кислот, лугів, іонів важких металів, температури і в ізоелектричній точці. Білки в розчиненому стані є вкрай нестійкими, тому під час додавання органічних розчинників (спирт, ацетон), концентрованих розчинів нейтральних солей лужних металів і дії фізичних факторів (нагрівання, опромінення, ультразвук) оболонка гідрату руйнується і білки випадають в осад.
Оскільки білкові речовини сировини (борошна, крупи, молока, м'яса), включаючи ферменти, часто є визначальними в забезпеченні якості харчових виробів, то для вивчення фізико-хімічних, біохімічних і фізіологічних властивостей цих сполук обов'язковою умовою є отримання білків в індивідуальному і, за можливістю, неденатурованому стані.
Таблиця 2.1 – Кольорові реакції на білки
|
Назва реакції |
Реактив |
Ділянка, яка реагує |
Забарвлення |
|
Біуретова |
Біуретовий реактив (Cu2+ в лужному середовищі) |
Пептидний зв’язок |
Пурпурово-фіолетове |
|
Нінгидринова |
Нінгідрин
|
Аміногрупи в α-положенні |
Синьо-фіолетове |
|
Ксантопротеїнова |
HNO3(конц.) |
Тирозин, Фенілаланін, Триптофан, Гістидин |
Жовте (+NaOH – померанчеве) |
|
Фоля |
Реактив Фоля (CH3COO)2Pb+NaOH |
Цистеїн, Метіонін |
Чорне |
|
Адамкевича |
Гліоксилова кислота конц. +Н2SО4 (конц.) |
Триптофан |
Червоно-фіолетове кільце |
|
Сакагучі |
α-нафтол + гіпоброміт (NaClO)
|
Аргінін |
Померанчево-червоне |
|
Мілона |
Реактив Мілона (НgNO3 + Нg(NO2)2 в HNO3 розб. з домішками HNO2) |
Тирозин |
Пурпурово-червоне |
МЕТОДИ ВИДІЛЕННЯ І ОЧИЩЕННЯ БІЛКІВ
Загальну схему операцій з виділення білків можна представити так:
– подрібнення біологічного матеріалу (гомогенізація);
– екстрагування;
– відділення від низькомолекулярних сполук, тобто очищення білка;
– отримання білка в індивідуальному стані.
Подрібнення біологічного матеріалу
Руйнування клітинної структури здійснюється ретельним подрібненням матеріалу в гомогенізаторах, млинах (валкові або кульові млини), поперемінним заморожуванням і відтаванням, застосуванням ультразвукових високочастотних коливань (ультразвукові дезінтегратори), прес-методов з використанням високих тисків і методу "азотної бомби". У останньому випадку клітини насичуються азотом під тиском, який потім знижується і клітини руйнуються. Ефективність гомогенізації залежить не лише від способу руйнування клітинних структур, але й від виду аналізованого матеріалу. Тваринні клітини руйнуються відносно легко, особливо за відсутності судинної і сполучної тканини, тоді як рослинні і мікробні – через присутність клітинних стінок – важко. У такому разі застосовують методи розтирання матеріалу з твердими речовинами (пісок, абразивний порошок) або обробку клітинних стінок лізоцимом або ферментними препаратами, що містять целюлазу, хітиназу і ліпазу. Гомогенізацію рекомендується проводити в холодних кімнатах або з використанням льоду. Класифікація методів руйнування (дезінтеграції) матеріалу, що використовуються в процесі виділення білків й інших сполук, наведена в таблиці 2.2.
Таблиця 2.2 – Класифікація методів дезінтеграції матеріалів за їх природою
|
Фізичні |
Хімічні |
Ензиматичні |
Біологічні |
|
|
Механічні |
Немеханічні |
|||
|
Балістичні, екструзії, ультразвукові, газодекомпре-сорні, гідроударні, електрогідро-ударні, комбіновані. |
Осмотичний, заморожування, дегідратація, повільна газова декомпресія, фазові переходи за високих тисків. |
Дія лугів, кислот, солей, детергентів, хелатних агентів, органічних розчинників |
Дія бактеріологіч-них, дріжджолітич-них, мікролітичних ферментів |
Дія фагів, бактеріоцинів, плазмідоподібних чинників, інгібування синтезу клітинної оболонки, автоліз. |
Екстракція білків може бути поєднана з гомогенізацією клітин і тканин або проведена окремо, якщо продукт заздалегідь подрібнений. Вибираючи різні екстрагенти і підбираючи режими екстракції (час, температура і тому подібне) можна вибірково перевести в розчин різні групи білків.
Так, наприклад, проводячи екстракцію водою, ми переводимо в розчин альбумін; глобуліни – солерозчинні білки, екстрагуються розчинами солей, наприклад, 5...10%-ним NaCl; проламіни – спирторозчинні білки, екстрагуються 60...80% етанолом, а глютеліни – розбавленим розчином лугів (0,1...0,2%); виділенню білків сприяє обробка детергентами: додецилсульфатом натрію (ДДС-Na), дезоксихолатом натрію, тритоном х-100, алкілглікозидами.
Більшість білків тваринних тканин є добре розчинними в 5...10%-них розчинах солей, тоді як для переведення в розчин білків зернових культур застосовують ширший набір розчинників. Для цього використовуються буферні системи зі значеннями рН від кислих до слаболужних (фосфатні, борат, цитратні, HCl), органічні розчинники і неіонні детергенти. Детергенти послабляють гідрофобні білково-ліпідні і білок-білкові взаємодії, сприяють розриву цих зв'язків.
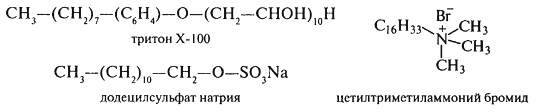
Розчинники підбираються з урахуванням розриву у білках певних типів зв'язків. Так, оцтова кислота послаблює іонні зв'язки, надаючи молекулі однойменних позитивних зарядів, сечовина – водневі і гідрофобні, саліцилат натрію і ДДС-Na – гідрофобні й іонні, а водні розчини спиртів – водневі і гідрофобні взаємодії. Органічні розчинники розривають білок-ліпідні зв'язки.
Відділення білків від низькомолекулярних сполук
Методи фракціонування і очищення від небілкових сполук засновані на відмінностях таких властивостей білків, як розмір молекул, розчинність, заряд і спорідненість до специфічних хімічних груп (таблиця 2.3, рисунок 2.1).
Таблиця2.3 – Методи фракціонування білків
|
Властивість в основі методу |
Метод |
|
Розділення білків за різною розчинністю |
Осадження: ізоелектричне, розчинниками, солями |
|
Протитечійний розподіл |
|
|
Розподільна хроматографія |
|
|
Відділення білків від низькомолекулярних домішок |
Діаліз (метод мембранних сит) |
|
Розділення білків за молекулярною масою |
Гель-фільтрація (гель-хроматографія) |
|
Ультрацентрифугування |
|
|
Розділення білків за зарядом |
Іонообмінна хроматографія |
|
Електрофорез (електрофорез без носія, електрофорез на носії: диск-електрофорез, ізоелектричне фокусування, ізотахоелектрофорез, імуноелектрофорез) |
|
|
Розділення білків за зарядом і молекулярною масою. |
Гель-електрофорез |
|
Ізоелектричне фокусування |
|
|
Розділення білків за здатністю до специфічних взаємодій |
Афінна хроматографія |
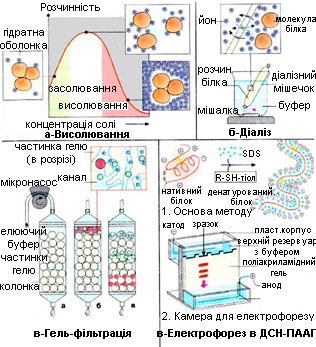
Рисунок 2.1 – Методи фракціонування і очищення білків
Розділення білків за різною розчинністю
Для виділення нативних білків (без зміни просторової структури) із біологічного розчину використовують такі методи як висолювання, осадження органічними розчинниками. У випадку використання цих методів білки позбавляються гідратної оболонки і випадають в осад.
Висолювання – осадження білків солями лужних і лужноземельних металів ((NH4)2SO4, NH4Cl, KCl, NaCl, Na2SO4, MgSO4 та ін.). Висолювання зумовлюється дегідратацією макромолекул білка з одночасною нейтралізацією зарядів протилежно зарядженими іонами солі. Різні білки висолюються за різного насичення нейтральними солями і за різних значень рН розчину, що залежить від різниці в молекулярній масі, ступеня дисперсності білка, іонної сили осаджувача. Білки з найменшою розчинністю випадають в осад за невеликих концентрацій солей. При цьому первинна структура білка не порушується. Це грубий метод розділення білків на групи. Так, глобуліни, які мають більшу молекулярну масу порівняно з альбумінами, випадають в осад за напівнасичення, а альбуміни – за повного насичення розчину сульфатом амонію.
Осадження органічними розчинниками (спиртом, ацетоном та ін.) за низьких температур використовуються для щадного групового розділення білків. Основний механізм процесу: в міру зростання концентрації органічного розчинника знижується здатність води до сольватації заряджених гідрофільних молекул білка. Відбувається зниження розчинності білків, за якої починається агрегація і осадження. Важливим параметром, що впливає на осадження є розмір молекули: чим більше молекула, тим нижчою є концентрація органічного розчинника, що спричиняє осадження білка. Розчинник, який використовується повинен повністю змішуватись з водою, не реагувати з білками і мати гарну осаджуючу дію. Однією із переваг фракціонування за допомогою органічних розчинників є те, що його можна проводити за температур нижче нуля, так як всі розчинники, що змішуються з водою, утворюють суміші, що замерзають за температури значно нижчої за 0ºС. Це є дуже важлива властивість, так як в процесі фракціонування необхідно підтримувати низьку температуру. Найбільш часто для осадження білків використовують ацетон. Він справляє меншу денатурувальну дію, ніж етанол, тому що за низьких температур необхідні дещо більш низькі його концентрації, аби отримати таке ж осадження, як і у випадку використання етанолу. Він також є більш летким, що дозволяє легко видаляти його із розчиненого осаду за зниженого тиску.
Крім цих методів використовують й інші методи осадження:
– осадження за допомогою трихлороцтової кислоти;
– осадження в ізоелектричній точці, шляхом зміни рН білкового екстракту;
– осадження шляхом теплової коагуляції та ін.
Відділення білків від низькомолекулярних домішок
Очищення білків від низькомолекулярних сполук (солей, цукрів, амінокислот) здійснюється методами діалізу, гель-фільтрації на сефадексі G-25, кристалізації, ультрафільтрації і за допомогою порожнистих волокон.
Діаліз (метод мембранних сит) базується на нездатності білків проходити через напівпроникну мембрану на відміну від низькомолекулярних речовин. Використовують діалізну мембрану, яка є полімером і має пори певної величини. Малі молекули (низькомолекулярні домішки) проходять через пори в мембрані, а крупні (білки) затримуються. Таким чином білки відмивають від низькомолекулярних домішок, наприклад, від солей після висолювання.
Під час діалізу використовують напівпроникні мембрани (целофан, колодійна плівка), через які білки не дифундують і залишаються усередині діалізного мішечка (рисунок 2.2). Дрібніші молекули проходять через пори діалізної мембрани і виходять в діалізат, так як в процесі дифузії молекули намагаються перейти в зону з більш низькою їх концентрацією. Замінюючи декілька разів водну фазу в діалізаті на дистильовану воду, можна знизити концентрацію низькомолекулярних сполук в розчині білка до скільки завгодно малої величини.
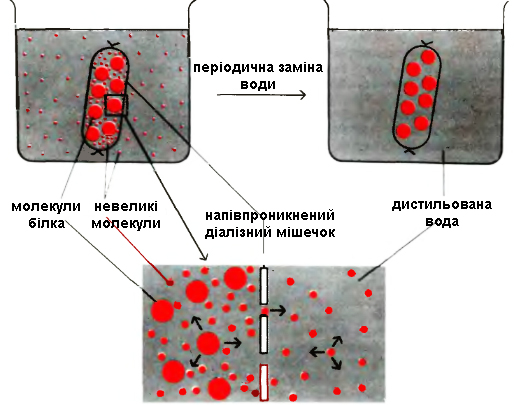
Рисунок 2.2 – Діаліз
Гель-фільтрація, або метод молекулярних сит. Гель-фільтрацію проводять на хроматографічних колонках, заповнених гранулами набряклого гелю (сефадекс) або іншими типами гелів (агарозних, полістиролових). Застосовуються також пористі скляні кульки і пористий кварц (порасил). Найбільшого поширення отримали декстранові гелі (сефадекс), що є продуктом поперечного зшивання полісахаридних ланцюжків декстрану. Зерна сефадексів різних номерів містять пори різних розмірів, в які можуть проникати білки з певною молекулярною масою. В залежності від розмірів пор випускають ряд марок сефадексів: G-200, G-100, G-75 та ін.
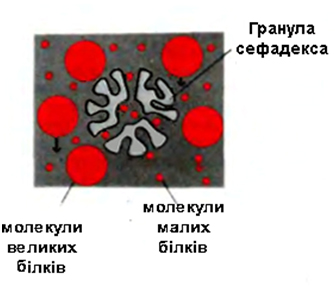
Рисунок 2.3 – Гранула сефадекса
У колонку вносять суміш білків (рисунок 2.4). Швидкість проходження білків через колонку, заповнену сефадексом, буде залежати від їхньої молекулярної маси: чим менша маса молекул білка, тим легше вони проникають всередину гранул сефадексу й довше там затримуються. Білки ж із більшою молекулярною масою не проникають через пори у гранули гелю, а тому вони швидше виходять із колонки разом із розчинником, що знаходиться між гранулами. Оскільки ступінь дифузії у гранули гелю залежить від розмірів молекул, то елюція речовин із колонки відбувається в порядку зменшення їх молекулярної маси. У результаті білки розподіляються за молекулярною масою і можуть бути зібрані у вигляді окремих хроматографічних фракцій. Молекулярну масу досліджуваного білка визначають шляхом порівняння його об’єму елюювання з аналогічним параметром для білків-маркерів.
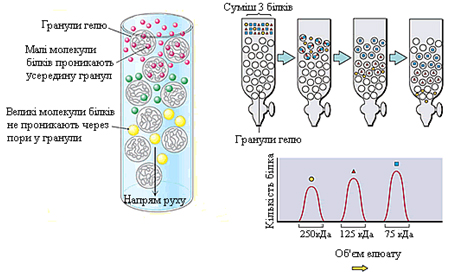
Рисунок 2.4 – Схема розділення білків методом гель-фільтрації
Ультрацентрифугування. Цей метод базується на різній швидкості седиментації (осадження) білкових молекул у розчині хімічно інертної речовини (сахарози або хлориду цезію). Для покращання роздільної здатності ультрацентрифуги використовують розчин із різним градієнтом густини, тобто концентрація розчину а отже і його густина збільшуються в напрямку від поверхні до дна центрифугувальної пробірки. Для створення градієнта використовують солі важких металів і розчини сахарози. У міру переміщення молекул білка в центробіжному полі вони розділяються за молекулярною масою: фракції важчих білків під час ультрацентрифугування розміщуються ближче до дна пробірки, легші білки – ближче до поверхні. При цьому утворюються межі білок-розчинник, які реєструють і розраховують швидкість їх переміщення. Метод широко застосовується для визначення молекулярних мас білків за константою седиментації (S), яка залежить від маси і форми білкових частинок:
![]() , (2.1)
, (2.1)
де v – швидкість переміщення межі розчинник-білок, см/с; ω – кутова швидкість ротора, рад/с; r – відстань від центру ротора до середини чарунки з розчином білка, см.
Величина S = 1×10-13 с прийнята за одиницю і названа сведбергом (S) на честь Т. Сведберга, що уперше сконструював ультрацентрифугу в 1923 р. Величина молекулярної маси М обчислюється за рівнянням Сведберга
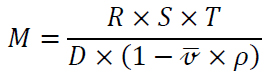 , (2.2)
, (2.2)
де R – універсальна газова стала, Дж/(моль×К); T – абсолютна температура, К; S – константа седиментації; ρ – густина розчинника; ύ – парціальний питомий об’єм молекули білка; D – коефіцієнт дифузії.
Розділення білків за зарядом
Для фракціонування білків в залежності від їх заряду широко використовують хроматографічні методи: адсорбційна, розподільна, іонообмінна, методи ізоелектричного фокусування, електрофоретичне розділення білків та ін.
Адсорбційна хроматографія ґрунтується на відмінностях в полярності білків, в залежності від якої вони вибірково адсорбуються на твердих фазах різноманітних типів. Застосування цих методів дозволяє отримати найбільший ступінь очищення білків. Найважливішими адсорбентами білків є іонообмінники і фосфат кальцію (гідроксилапатит).
У розподільній хроматографії, на відміну від адсорбційної, нерухомою фазою виступає водний шар, що утримується твердою фазою (силікагель, папір). Речовини, що розділяються, багаторазово розподіляються між водним шаром і фазою розчинника, що рухається, і з різною швидкістю переміщаються по довжині колонки або паперу. Розподільну хроматографію на папері часто використовують для аналізу пептидів й амінокислот. Адсорбентом служать нитки целюлози, а розчинником – суміш органічних розчинників, наприклад: бутиловий спирт-оцтова кислота-вода. Хроматограму проявляють, висушують і аналізують місцезнаходження компонентів, що розділяються, тим або іншим способом.
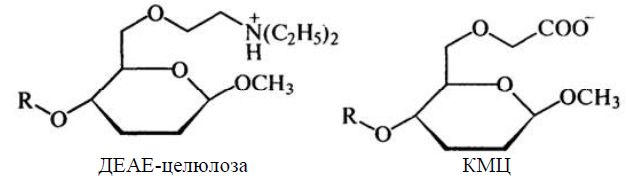
Методом іонообмінної хроматографії білки або амінокислоти розділяють на основі відмінностей в загальному заряді молекул (рисунок 2.5). Метод базується на зв’язуванні іонізованих груп білків із протилежно зарядженими групами іонообмінників (катіонообмінників чи аніонообмінників). Міцність зв’язування білка із смолою пропорційна заряду білка. Для розділення кислих і нейтральних білків використовують аніонообмінник, в якому використовуються аміни або органічними основи. Для розділення основних білків – катіонообмінник, що містить фенольні, сульфо- і карбоксильні групи.
Для розділення білків використовуються іонообмінники на основі целюлози (карбоксиметилцелюлоза (КМЦ) і діетиламіноетилцелюлоза (ДЕАЕ-целюлоза), декстранів і агароз, похідних полістиролу, що мають "пухку" структуру, завдяки якій білок може проникати всередину частинки іонообмінника.
У колонці разом з буферним розчином упаковують адсорбент (іонообмінник), на який в невеликий об'єм розчинника наносять досліджуваний зразок. Компоненти білкової суміші, що розділяється, зв’язуються із іонообмінником за допомогою електростатичних сил між зарядженими поверхнями білків і кластерами заряджених груп на іонообміннику.
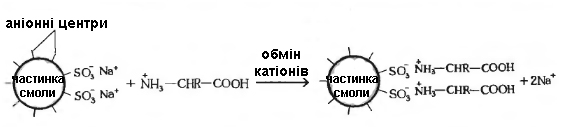
Рисунок 2.5 – Схема іонообмінної хроматографії
Білки, адсорбовані на іонообмінному полімері, можна змити буферним розчином із наростаючими концентраціями солі (як правило для цього використовують хлориди калію і натрію). Під час елюції іони натрію конкурують з позитивно зарядженими групами білків. Білки з меншим позитивним зарядом вимиваються з колонки першими, з великим зарядом – останніми. Крім того для вивільнення білка із іонообмінника (елюція) використовують і метод зміни рН буфера до величини, за якої зв’язування з адсорбентом послаблюється (для катіонообмінників використовують більш високі значення рН, а для аніонообмінників – більш низькі). Фракції білка збирають за допомогою автоматичного колектора фракцій.
Розділення білків за зарядом і молекулярною масою.
У хімії харчового білка застосовують різні види електрофоретичного розділення гель-електрофорез, імуноелектрофорез, ізотахофорез та ін.
Електрофорез (за дослідження електрофорезу А. Тизеліус був удостоєний Нобелівської премії з хімії) – метод розділення заряджених частинок в електричному полі. Принцип методів електрофоретичного розділення білкових сумішей полягає в здатності молекул пептидів і амінокислот, знаходячись в зарядженій формі у вигляді катіонів(+) або аніонів(-), пересуватися в електричному полі з певною швидкістю (рисунок 2.6). Крім того, молекули з близькими зарядами, але різними розмірами, відрізняються відношенням заряду до маси. Усі ці відмінності і зумовлюють високу роздільну здатність електрофоретичних методів.
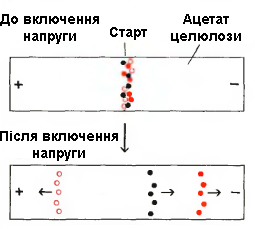
Рисунок 2.6 – Схема електрофоретичного розділення білків
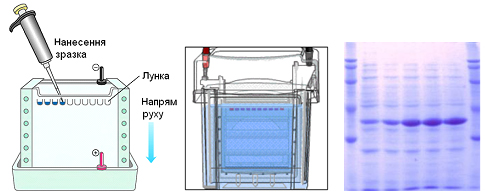
Гель-електрофорез (рисунок 2.7). Цей метод базується на різній швидкості міграції білків і пептидів в електричному полі в залежності не лише від знака заряду, а й від молекулярної маси. Носіями для гель-електрофорезу можуть бути поліакриламідний гель, крохмальний гель, агароза та ін. Молекули, що розділяються, рухаються в гелі в залежності від їх розміру: ті з них, які мають великі розміри, будуть затримуватися при проходженні через пори гелю. Менші молекули зустрічатимуть менший опір і відповідно рухатимуться швидше. У результаті після проведення електрофорезу великі молекули знаходитимуться ближче до старту порівняно з меншими.
Поширеним методом фракціонування білків є диск-електрофорез (від англ., discontinuous – переривчастий) в ПААГ, під час якого використовується пара буферних розчинів з різними значеннями рН за присутності ДДС-Na і гелів різної пористості. Для виявлення білків гелі обробляють барвниками: амідовим чорним 10В, кумасі синім R-250. Інтенсивність забарвлення, а за нею і кількісний вміст білкових фракцій, визначають скануванням на денситометрі.
|
|
||
|
а |
б |
в |
|
а – нанесення зразків у гель; б – камера для електрофорезу; в – електрофореграма білків |
||
|
Рисунок 2.7 – Схема розділення білків методом гель-електрофорезу |
||
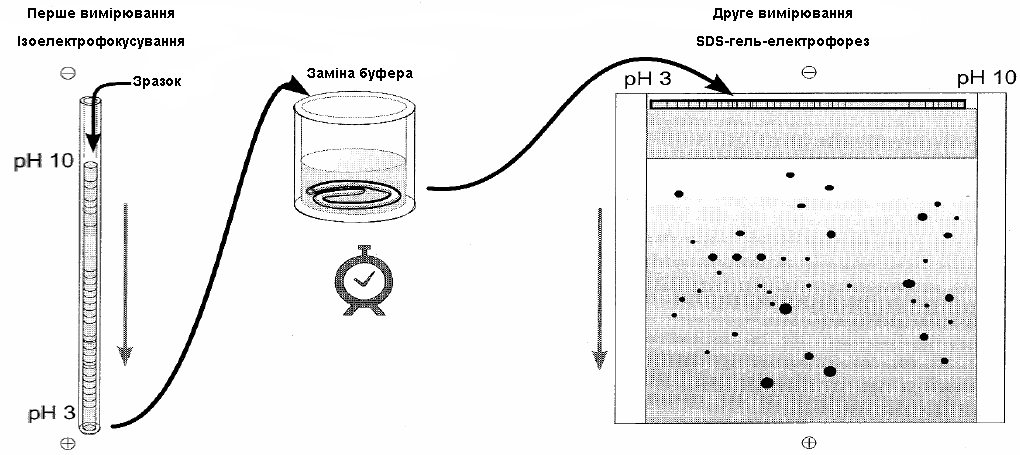
Ізоелектричне фокусування (ІЕФ) (рисунок 2.8 а). Це один із найефективніших і найпоширеніших методів фракціонування та очищення білків. Цей метод дозволяє розділити білки, що відрізняються за ізоелектричною точкою лише на 0,01. Суміш білків, яку піддають розділенню, вносять у колонку або наносять на пластину, заповнену електропровідною рідиною.
|
|
|
|
а |
б |
|
а – схема ізоелектричного фокусування; б – схема гель-електрофорезу |
|
|
Рисунок 2.8 – Схема двовимірного електрофорезу в ПААГ |
|
Метод (ІЕФ) ґрунтується на розділенні білків, що мають різні ізоелектричні точки. ІЕФ здійснюється в процесі їх електрофоретичного розділення на колонці, по висоті якої створюється градієнт рН. Даний градієнт створюється за допомогою синтетичних сумішей поліамінополікарбонових кислот (амфолітів) під дією електричного поля. Білок рухається під дією електричного поля, доки не досягне тієї ділянки колонки, де рН дорівнює ізоелектричній точці даного білка. Сумарний електричний заряд білка стає рівним нулю; білок втрачає рухливість і концентрується в цій ділянці у вигляді вузької зони. Молекули різних білків будуть утворювати зони в тій або іншій частині колонки у відповідності до значень їх ізоелектричних точок. ІЕФ дозволяє розділяти білки, що відрізняються значеннями ізоелектричних точок на 0,02 одиниці.
Для електрофоретичного розділення білків і пептидів успішно застосовується двовимірний електрофорез в ПААГ (рисунок 2.8). Відповідно до цього методу суміш компонентів розділяють спочатку в стовпчиках гелю електрофорезом в горизонтальному напрямі, в результаті чого білки розділяються в залежності від величини заряду (рисунок 2.8 а). Потім розділення проводять в пластинах гелів у вертикальному напрямі (рисунок 2.8 б), під час цього процесу білки розділяються в залежності від молекулярної маси.
Виявлення білків після їх розділення ізоелектричним фокусуванням і гель-електрофорезом здійснюють шляхом фарбуванням спеціальними барвниками з урахуванням того, що амфоліти здатні утворювати з білками комплекси.
Розділення білків гороху за допомогою двовимірного електрофорезу дало змогу отримати більше 150 різних компонентів.
Розділення білків за здатністю до специфічних взаємодій
Афінна хроматографія (або хроматографія за спорідненістю) ґрунтується на принципі вибіркового зв'язування білків із специфічними речовинами (лігандами), прикріпленими до носія. До носія (інертний полімер) ковалентно приєднують ліганд (глюкозу), іммобілізуючи останній (рисунок 2.9 (А)). Досліджувану білкову суміш наносять на колонку. Під час проходження розчину білків через колонку з полімером на колонці адсорбується лише специфічний для даного ліганду білок за рахунок комплементарного з’єднування білка з лігандом.
Білки, що не зв'язалися, видаляють відповідним буфером (рисунок 2.9 (Б)), а потрібний білок вимивають (елюють) розчином, що містить вільний ліганд в дуже високій концентрації (рисунок 2.9 (В, Г)). Часто в якості вільного ліганду використовують ліганд, що має вищу спорідненість до білка, ніж у фіксованого на полімері ліганду.
Цей високочутливий метод дозволяє виділити в чистому вигляді дуже малі кількості білка з клітинного екстракту, що містить сотні інших білків. Одним із варіантів цього методу є імуноафінна хроматографія: до частинок полімеру приєднують антитіла до певного білка, що забезпечує з дуже високою специфічністю затримку на колонці цього білка.
Гомогенність білку визначається на останньому етапі виділення і очищення із застосуванням щонайменше двох методів, що оцінюють ту або іншу фізико-хімічну властивість. Найбільш достовірними є ультрацентрифугування в градієнті густини, диск-електрофорез в ПААГ і розчинність.
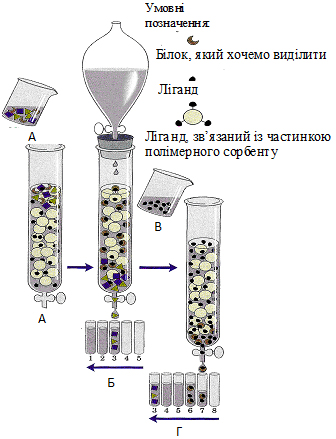
Рисунок 2.9 – Схема розділення білків методом афінної хроматографії
Для проведення очищення і фракціонування білків за допомогою вищеописаних методів існують сучасні прилади (рисунок 2.10)
|
|
|
|
|
а |
б |
в |
|
а – прилад для рідинної хроматографії; б – препаративний хроматограф;
|
||
|
Рисунок 2.10 – Прилади для очищення і фракціонування білків |
||