3.2 Теоретичні відомості
Харчова цінність продуктів значною мірою залежить від вмісту в них азотистих речовин, в основному, білків. Їх основне значення полягає в незамінності іншими компонентами їжі. Білки складають основу процесів життєдіяльності організму. Необхідність їх постійного оновлення лежить в основі обміну речовин. Дефіцит білка в харчовому раціоні знижує стійкість організму до інфекційних захворювань, порушує процеси кровотворення, обмін ліпідів, вітамінів та ін. У дітей у разі білкової недостатності уповільнюється ріст та розвиток розумових здібностей. Тривалий надлишок білка в харчуванні також негативно впливає на життєдіяльність організму, викликаючи надмірне збудження нервової системи, порушення обмінних процесів, перевантаження печінки та нирок.
В щоденному раціоні дорослої людини білки повинні складати приблизно 14 % загальної калорійності, поєднуючись в певному співвідношенні з іншими харчовими речовинами.
Рослинні білки засвоюються організмом не повністю в порівнянні з тваринними. Так, білки молока та яєць засвоюються на 96%, білки риби та м'яса – на 95%, білки хліба з борошна пшеничного І та ІІ сортів – на 85%, білки картоплі, хліба з обойного борошна, бобових – на 70%. Враховуючи, що рослинні білки є менш повноцінними за вмістом незамінних амінокислот, ніж тваринні, споживання певної кількості тваринних білків є цілком необхідним. Для дорослої людини частка тваринних білків в середньому повинна складати 55 % від загальної кількості білка в раціоні.
Склад білків є непостійним. Зазвичай білки складаються з вуглецю (50...55%), кисню (25...30%), азоту (9...15%), сірки (0,5...2,5%). Під час аналізу продуктів харчування часто під словом "білок" мається на увазі кількість загального азоту, визначеного за методом Кьєльдаля, помножене на відповідний коефіцієнт перерахунку, вказаний в таблицях (в середньому – 6,25). Прийнятий він тому, що більшість білків містять 16% азоту (100:16 = 6,25). Для пшениці отриманий коефіцієнт 5,7, оскільки її білки містять 17,5% азоту. Для жита, ячменю, вівса, насіння соняшнику також 5,7; сої – 5,8; кукурудзи – 6,25; молока – 6,38 і так далі.
Визначення загального білка методом Кьєльдаля
Метод Кьєльдаля – один з найбільш поширених методів аналізу. Він дає точні результати, але дуже трудомісткий та тривалий. Суть методу полягає в тому, що аналізований зразок окиснюють гарячою концентрованою сірчаною кислотою; в процесі окислення зв'язаний азот перетворюється на іон амонію. Потім розчин обробляють надлишком сильної основи, внаслідок чого виділяється аміак, який визначають різними методами: титриметричним або фотоколориметричним.
Найважливішою стадією в методі Кьєльдаля є окиснення сірчаною кислотою. Вуглець і водень, що містяться в зразку, перетворюються відповідно на вуглекислий газ і воду. Але ступінь перетворення азоту залежить від його стану в початковій сполуці. Якщо він є присутнім у вигляді аміду або аміну, як, наприклад, у білкових речовинах, перетворення його на іон амонію відбувається завжди майже повністю. Якщо ж азот є присутнім у високих ступенях окиснення, наприклад, у вигляді нітро-, азо- і азоксигруп, на стадії окислення зразка він перетворюється на молекулярний азот або оксиди азоту і не утримується сірчаною кислотою. Це призводить до заниження результатів, і щоб запобігти втратам, зразок піддають попередній обробці відновником (саліциловою кислотою або тіосульфатом натрію). За такої обробки азот переходить в сполуки з нижчими ступенями окиснення, з яких він легше перетворюється на іон амонію в результаті обробки сірчаною кислотою. Стадія окиснення є найбільш тривалою в методі Кьєльдаля – година і більше. Для прискорення намагаються підвищити температуру кипіння сірчаної кислоти а, отже, і температуру процесу окиснення, шляхом додавання нейтральної солі, наприклад, сульфату калію. Спроби прискорити стадію окислення введенням таких сильних окисників, як хлорна кислота, перманганат калію і пероксид водню, виявилися невдалими, оскільки іон амонію частково окиснюється до летких оксидів азоту.
Стадію окислення каталізують багато речовин: ртуть, мідь і селен – як в зв'язаному стані, так і в елементному. Головний ефект селену полягає в тому, що він скорочує час розкладання до утворення прозорого розчину, хоча утворення абсолютно прозорого розчину не завжди рівнозначне кількісному розкладанню речовини. Слід застосовувати незначну кількість селенового каталізатора, оскільки у випадку його збільшення зростає втрата азоту. Тривалість нагрівання теж не має бути занадто великою. Таким чином, кількість каталізатора і тривалість нагріву мають оптимум, який необхідно враховувати.
Послідовність реакцій під час визначення загального азоту за методом Кьєльдаля:
1) до точно зваженої наважки аналізованої проби підливають сірчану кислоту (для видалення піни, що утворюється, додають шматочок парафіну);
2) колбу поміщають на плитку і нагрівають, під час цієї стадії відбуваються наступні реакції:
RCHNH2COOH + H2SO4 → CO2 + SO2 + H2O + NH3;
2NH3 + H2SO4 → (NH4)2SO4;
3) після завершення окиснення (рідина стане світлою) вміст колби розбавляють водою і додають луг (30% NaOH) для виділення аміаку:
(NH4)2SO4 + 2NaOH → 2NH3 + Na2SO4 + 2H2O;
4) аміак відганяють (часто з водяною парою) в колбу з розчином кислоти;
5) аміак поглинають надлишком 0,1 н розчину H2SO4 і титрують надлишок H2SO4 0,1 н розчином NaОН у присутності фенолфталеїну:
H2SO4 + NaOH → Na2SO4 + H2O;
6) розраховують вміст азоту в %.
За способом визначення кількості аміаку, що виділився, метод Кьєльдаля може мати титрометричне або фотометричне закінчення.
Титриметричне визначення азоту за методом Кьєльдаля. Існують два титриметричні способи визначення зібраного аміаку. У одному з них в приймач поміщають відому кількість стандартного розчину кислоти. Після закінчення відгону надлишок кислоти титрують стандартним розчином лугу. Інший зручний спосіб, що вимагає застосування тільки одного стандартного розчину, полягає в тому, що в приймач вводять деякий надлишок борної кислоти:
HBO2 + NH3 → NH4+ + BO2–
Борат, що утворюється, кількість якого еквівалентна кількості аміаку, є досить сильною основою і його можна титрувати стандартним розчином HCl:
BO2– + H3O+ → HBO2 + H2O.
Метод Кьєльдаля знайшов широке застосування у біохімії і аналізі харчових продуктів. Метод відносно простий, легко піддається автоматизації і добре відтворюється. Нині процедура визначення білка за методом Кьєльдаля стандартизована в міжнародному масштабі і випускається устаткування, що дозволяє швидко і точно визначати вміст загального азоту. Таке устаткування включає блок розкладання проб – дигестер; систему для видалення і нейтралізації парів; систему дистиляції – парові дистилятори; для визначення у відігнаній пробі амонійного азоту методом титрування використовується автоматичний титратор.
Дигестори (рисунок 3.1 а) призначені для мінералізації зразків в сірчаній кислоті і забезпечені потужними інфрачервоними нагрівальними елементами, максимальна температура процесу може досягати 450ºС, що значно скорочує час на проведення реакції. Якісне виготовлення і правильне розміщення нагрівальних елементів забезпечують рівномірне нагрівання зразків за однаковими стадіями й ідентичність температур в усіх посудинах. Дигестери дозволяють одночасно розкладати до 12 проб різного об'єму.
До складу автоматизованої установки входить система для видалення і нейтралізації парів – скрубер (рисунок 3.1 б), що дає змогу експлуатувати прилад без витяжної шафи. Скрубер оснащений вакуумним насосом, який висмоктує гази з дигестерів і пропускає їх через розчин лугу. За рахунок взаємодії пари кислот з лугом відбувається нейтралізація і забезпечується повне очищення газів, що відходять.
Для відгону і поглинання аміаку після розкладання проб використовуються парові дистилятори (рисунок 3.1 в), вони є доповненням до дигестерів. Дистилятор має високу продуктивність – 3 кг водяної пари за годину, тому відгонка зразка відбувається за лічені хвилини.
Кінцевою стадією аналізу є визначення у відігнаній пробі амонійного азоту методом титрування, яку здійснюють за допомогою автоматичного титратора, який дозволяє повністю автоматизувати процес титрування і помітно покращити відновлюваність отриманих результатів аналізу.
|
|
|
|
|
а |
б |
|
|
|
|
|
|
в |
г |
|
|
а – дигестер; б – скрубер; в – парові дистилятори; г – автоматичний титратор |
||
|
Рисунок 3.1 – Устаткування для автоматизованої системи методу Кьєльдаля |
||
Існують такі системи дистиляції, які дають можливість не тільки відганяти аміак з парою але і визначати його кількість титриметрично, з використанням скляного електроду (рисунок 3.1 в). В таких системах дистиляція і титрування проводяться в автоматичному режимі і робота, як системи дистиляції, так і блоку розкладання контролюється мікропроцесором, а результати аналізу можуть реєструватися за допомогою персонального комп'ютера.
Слід зазначити, що вартість визначення вмісту білку за допомогою автоматизованої установки є високою.
Фотометричне визначення азоту за методом Кьєльдаля. Для прискорення визначення аміаку використовується його фотометричне визначення. Фотометрично аміак може бути визначений або за реакцією з реактивом Несслера, або за реакцією утворення індофенолу.
Під час визначення першим способом, до розчину, що містить іони амонію, додають реактив Несслера, що є лужним розчином K2[HgI4]. Продукт реакції забарвлений в червоно-коричневий колір (ε = 106). Оптичну густину отриманого розчину вимірюють за 436 нм. Концентрацію аміаку знаходять за калібрувальним графіком, побудованому за стандартними розчинами сульфату амонію.
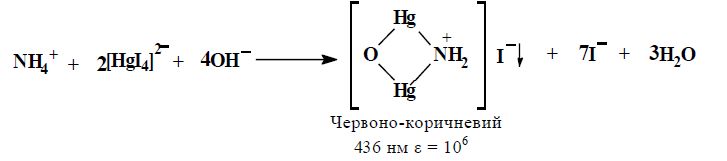
Визначення, яке ґрунтується на утворенні індофенолу, полягає в спільному окисненні фенолу і аміаку.
NH3 + NaOCl → NH2Cl + NaOH
C6H5OH + NH2Cl + NaOH → H2NC6H4OH + NaCl
H2NC6H4OH + C6H5OH + NH2Cl → HOC6H4NHC6H4OH + NH4Cl
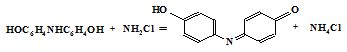
Отриманий індофенол забарвлює розчин в інтенсивно синій колір (λ = 620 нм, ε = 4,5·104) за оптичною густиною якого і визначають вміст аміаку. Як окисники використовують NaClO, хлорну або бромисту воду, пероксид водню.
Варто нагадати, що методом Кьєльдаля визначають не чистий білок, а так званий "сирий протеїн", оскільки разом з азотом білка одночасно визначається азот й інших сполук: амінокислоти, аміди, алкалоїди (кофеїн та ін.), неорганічні азотовмісні сполуки. Вміст небілкових речовин може досягати 10%. Використання перевідного коефіцієнта під час розрахунку кількості білка в методі Кьєльдаля робить його дещо умовним. Проте, незважаючи на недоліки, метод Кьєльдаля є уніфікованим, він включений в ДСТУ, ГОСТи на багато харчових продуктів.
Є і інші методи визначення азоту, такі як Дюма, нейтронно-активаційний, фотоколориметричне визначення на приладі "Технікон".
Метод Дюма полягає в розкладанні органічної сполуки в атмосфері оксиду вуглецю до газоподібного стану з подальшим виміром об'єму азоту(N2).
У нейтронно-активаційному методі атоми азоту аналізованого зразка бомбардуються нейтронами в ядерному реакторі з отриманням ізотопу 13N. Вміст білка розраховується за кількістю гама-променів.
Усі ці вище описані методи за точністю аналізу не поступаються методу Кьєльдаля, проте вони є досить дорогими.
Колориметричні та рефрактометричні вимірювання
З розвитком фото- та спектрофотометрії були розроблені методи кількісного визначення білка, які базуються на здатності білка утворювати кольорові сполуки з деякими реагентами. Серед них слід виділити метод Лоурі, біуретовий метод. У основі біуретового методу лежить біуретова реакція, в основі методу Лоурі – відновлення фосфоромолібденової кислоти Тирозином і триптофаном з одночасним перебігом біуретової реакції. За оптичною густиною з використанням калібрувальних графіків знаходять концентрацію білка в розчинах.
Визначення азоту на приладі "Технікон" теж здійснюється фотоколориметричним способом. Вимірюється інтенсивність синьо-блакитного забарвлення, що утворюється в процесі мінералізації зразка з лужним розчином фенолу і гіпохлориту.
Знаходять застосування також фізико-хімічні методи, в основу яких покладено специфічні властивості білків:
– утворення різних ступенів помутніння в залежності від концентрації білка в розчині сульфосаліцилової кислоти (нефелометричний метод);
– здатність білка адсорбувати деякі барвники (кумаси синій R-250, амідочорний та ін.) і заломлювати промені світла (рефрактометричний метод).
Такі фізико-хімічні методи можна віднести до прискорених. За відносно невеликих затратах часу вони характеризуються достатньо високою точністю, простотою та швидкістю визначення.
Поширеним є метод інфрачервоної спектроскопії, в основі якого лежить поглинання білками світла з певною довжиною хвилі і вимірювання інтенсивності його відображення в спеціальних приладах-аналізаторах. Прилади калібрують за зразками (еталонам) з відомим вмістом білку, визначеним за методом Кьєльдаля.
Колориметрія (від лат. color – колір і грец. μετρεω – вимірюю) – метод хімічного аналізу, заснований на визначенні концентрації речовини за інтенсивністю забарвлення розчинів (більш точно – за поглинанням світла розчинами). Визначають інтенсивність забарвлення за допомогою приладів, наприклад колориметрів. Більш досконалі прилади – спектрофотометри – відрізняються можливістю дослідження оптичної густини в широкому діапазоні довжин хвиль видимого спектра, а також у ІЧ і УФ-діапазонах. Фотоколориметри – прилади для кількісного визначення концентрації речовини за поглинанням світла у видимій та ближній ультрафіолетовій ділянці спектра.
Фотометр фотоелектричний (фотоелектроколориметр) КФК-3 (рисунок 3.2 а) призначений для вимірювання коефіцієнтів пропускання і оптичної густини прозорих розчинів, а також для вимірювання швидкості зміни оптичної густини речовини і визначення концентрації речовини в розчинах. За допомогою колориметра вимірюються також коефіцієнти пропускання розсіювальних суспензій, емульсій і колоїдних розчинів у світлі, що проходить через них.
Нефелометрія и турбідиметрія (від грец. nephele – хмара, лат. turbidus-мутний і грец. metreo – вимірюю), методи кількісного хімічного аналізу, що ґрунтуються на вимірюванні інтенсивності світла, що розсіюється досліджуваною дисперсною системою (суспензія або аерозоль) і яке пройшло через неї. Для турбідиметричних вимірювань можна використовувати практично будь-який фотоелектроколориметр або спектрофотометр (рисунок 3.2 б)
Нефелометр (від грец. nephele – хмара; metreo – вимірюю) – оптичний прилад (рисунок 3.2 в) для вимірювання ступеня мутності рідин і газів за інтенсивністю розсіювання ними світла. Дія нефелометра ґрунтується на зіставленні інтенсивності світла, розсіяного середовищем, з інтенсивністю розсіювання еталону (мутне скло та ін.). Нефелометри бувають візуальні і фотоелектричні. Використовуються у дослідженнях дисперсних систем (синоніми: гідронефелометр, спектрогідронефелометр турбідиметр, мутномір).
|
|
|
|
|
а |
б |
|
|
|
|
|
|
в |
u |
|
|
а – фотоелектроколориметр КФК-3; б – спектрофотометр настільний Unico; в – нефелометр портативний; г – рефрактометр лабораторний цифровий WAY-2SE |
||
|
Рисунок 3.2 – Прилади для колориметричних і рефрактометричних вимірювань |
||
Рефрактометрія – (від лат. refractus – заломлений і грец. metreo – вимірюю) метод дослідження речовин, що ґрунтується на визначенні показника заломлення (коефіцієнта рефракції) та деяких його функцій.
Рефрактометр (рисунок 3.2 г) – прилад для вимірювання коефіцієнта заломлення прозорих матеріалів, тобто ступеня заломлення світла, що проходить через них. Коефіцієнт заломлення хімічного розчину змінюється в залежності від його складу.







