4.3 Експериментальна частина
4.3.1 Визначення кислотного числа
Кислотне число – це кількість міліграмів гідроксиду калію або натрію, необхідна для нейтралізації вільних жирних кислот, що містяться в 1 г жиру:
RCOOH + KOH → RCOOK + H2O
Кількість вільних жирних кислот в жирі є непостійною та залежить від кількості жирової сировини, способу отримання жирів, тривалості та умов зберігання, інших факторів. Їх накопичення зумовлено гідролітичним розщепленням гліцеридів на дигліцериди, моногліцериди, гліцерин та жирні кислоти. Частково вільні жирні кислоти утворюються і внаслідок окиснювальних перетворень жиру на більш пізніх стадіях його окиснення.
Гранично допустимі норми кислотного числа окремих олій та жирів (мг/г жиру) наведено в табл. 4.1.
Таблиця 4.4 – Гранично допустимі норми кислотного числа окремих олій та жирів
|
Вид харчового жиру |
Кислотне число, мг/г жиру |
|
|
Соняшникова олія |
рафінована |
0,4 |
|
нерафінована вищого сорту |
1,5 |
|
|
нерафінована І сорту |
2,25 |
|
|
Соєва олія |
рафінована |
0,3 |
|
гідратована І сорту |
1,0 |
|
|
Кукурудзяна олія |
рафінована |
0,4 |
|
нерафінована |
5,0 |
|
|
Топлений харчовий жир (баранячий, яловичий, свинячий) |
вищого сорту |
1,2 |
|
І сорту |
2,2 |
|
|
Збірні жири (без покажчика сорту) |
3,5 |
|
Кислотне число є одним з основних якісних показників, що характеризують ступінь свіжості жиру, та регламентується стандартами на всі види харчових жирів. У разі неправильного зберігання кількість вільних жирних кислот зростає і подальше їх окиснення призводить до появи дефектів смаку та запаху, а у разі більш глибоких процесів – до непридатності жиру для харчових цілей.
Визначення кислотного числа полягає в розчиненні певної маси рослинної олії в суміші розчинників з подальшою нейтралізацією вільних жирних кислот спиртовим розчином гідроксиду калію або натрію згідно з ГОСТ 5476-80 «Масла растительные. Метод определения кислотного числа».
Прилади, обладнання, матеріали: технічні ваги, конічна колба місткістю 150...200 см3, бюретка місткістю 50 см3, водяна баня.
Реактиви: 1 %-ний спиртовий розчин фенолфталеїну або тимолфталеїну, 0,1 М розчин КОН або NaOH, нейтральна суміш спирту та ефіру*.
Примітка.*Нейтральна суміш спирту та ефіру готується так: суміш з двох частин діетилового ефіру та однієї частини етилового спирту нейтралізують 0,1 М розчином КОН або NaOH у присутності п’яти крапель фенолфталеїну (індикатор) до ледь помітної зміни забарвлення суміші.
Техніка визначення – в конічну колбу, місткістю 150...200 см3 відважують 3...5 г досліджуваної олії з точністю до 0,01 г, додають 50 см3 нейтралізованої суміші етанолу й етилового ефіру (1:2) і збовтують вміст. Якщо олія не розчиниться, то колбу необхідно підігріти на водяній бані і охолодити до температури 15...20ºС. Додають 3...5 крапель 1% спиртового розчину фенолфталеїну і за постійного перемішування титрують пробу 0,1 н спиртовим розчином гідроксиду калію або натрію до появи слабо-малинового забарвлення, що не зникає протягом 30 с.
Послідовність дій під час визначення кислотного числа харчових жирів наведена на рисунку 4.4.
Кислотне число (мг/г олії) розраховують за формулою:
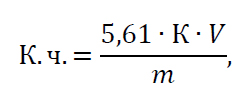 (4.1)
(4.1)
де 5,61 – кількість NaOH або KOH, що міститься в 1 см3 розчину концентрації 0,1 н. Цей множник є постійним незалежно від виду застосованого лугу; К – коефіцієнт поправки до 0,1 н розчину NaOH або KOH; V – об’єм 0,1 н NaOH або KOH, що використаний на нейтралізацію вільних жирних кислот в масі наважки жиру, см3; m – маса взятої для аналізу наважки, г.
За кінцевий результат приймають середнє арифметичне двох паралельних визначень. Зробити висновок про якість жиру за кислотним числом
Дані спостережень та розрахунків записують у процесі виконання роботи в табл. 4.5.
Таблиця 4.5 – Результати спостережень та розрахунків для визначення кислотного числа жиру
|
Назва параметру |
Значення |
|
Маса порожньої колби, m1, г |
|
|
Маса жиру з колбою, m2, г |
|
|
Маса наважки жиру, m, г |
|
|
Об’єм 0,1 М розчину лугу, що витрачається на нейтралізацію вільних жирних кислот в харчовому жирі, V, см3 |
|
|
Коефіцієнт поправки до 0,1 н розчину лугу, К |
|
|
Титр 0,1 М розчину NaOH або KOH, мг/см3 |
5,611 |
|
Кислотне число, Х, мг/г жиру |
|

Рисунок 4.4 – Схема визначення кислотного числа харчових жирів
4.3.2 Визначення йодного числа
Йодне число – це показник, що характеризує ненасиченість жирних кислот, які входять до складу жиру. Визначення йодного числа ґрунтується на здатності ненасичених жирних кислот приєднувати молекули галогену (хлор, бром, йод) в умовах, за яких ця реакція не супроводжується заміщенням водню на галоген. На кожен подвійний зв'язок витрачається одна молекула галогену. Таким чином йодне число залежить від кількості етиленових (подвійних) зв’язків в жирних кислотах: з їх збільшенням йодне число зростає.
Крім того, чим більше у жирі міститься ненасичених жирних кислот, тим також вищим є його йодне число. Рослинні олії внаслідок більшого вмісту ненасичених жирних кислот порівняно з тваринними жирами мають більш високі значення йодних чисел.
Під йодним числом розуміють кількість грамів йоду, що приєднується до 100 г жиру. Йодне число використовують для визначення виду харчового жиру, його здатності до висихання, розрахунку потрібної кількості водню для його гідрогенізації. За величиною йодного числа жирів та олій роблять висновок про їх здатність до різноманітних хімічних перетворень, оскільки ненасичені жирні кислоти можуть приєднувати кисень по місцю розриву подвійних зв’язків, що обумовлює процеси згіркнення та висихання жирів. У процесі окиснення жирів кількість ненасичених жирних кислот знижується і як наслідок зменшується йодне число. Зменшення йодного числа є показником псування жиру.
Йодне число для деяких жирів та олій наведено в таблиця 4.6.
Таблиця 4.6 – Йодне число для деяких рослинних олій і тваринних жирів
|
Вид харчового жиру |
Йодне число, % І2 |
|
|
Олія: |
соняшникова |
125-145 |
|
соєва |
120-140 |
|
|
гірчична |
102-108 |
|
|
бавовняна |
102-117 |
|
|
оливкова |
75-85 |
|
|
кукурудзяна |
111-133 |
|
|
Жир |
яловичий |
32-47 |
|
баранячий |
35-40 |
|
|
Вершкове масло |
30-50 |
|
Для визначення йодного числа олій та жирів використовують декілька методів, що відрізняються в основному галогеновмісним реагентом, та умовами проведення досліду. Найпоширенішими методами є метод Гюбля (із застосуванням йодно-ртутного розчину), Кауфмана, Війса, Гануса, Вобурна. Три перших з перерахованих методів є стандартизованими.
Стандартні методи визначення йодного числа мають порівняно високу точність, проте вони є неприйнятними у виробничих умовах внаслідок їх тривалості, необхідності складних токсичних та дефіцитних реактивів, високої кваліфікації виконуючого персоналу. В цьому відношенні є більш зручним метод Маргошеса, за яким визначення йодного числа здійснюється за допомогою надлишку спиртового розчину йоду (тому що повне насичення подвійних зв’язків відбувається лише тоді, коли кількість галоїду є на 50…60% вища за теоретичний).
Визначення йодного числа методом Маргошеса
За точністю отриманих результатів цей метод поступається стандартним методам. Він ґрунтується на реакції ненасиченої кислоти жиру з йоднуватою кислотою, що утворюється під час взаємодії йоду з великою кількістю води за рівнянням:
І2 + Н2О D НІ + НІО
Реакція жиру з йоднуватою кислотою відбувається за наступною схемою:
СН3(СН2)7СН=СН(СН2)7СООН + НОІ → СН3(СН2)7СНОН–СНІ(СН2)7СООН Надлишок йоду, що не приєднався, титрують тіосульфатом натрію за присутності індикатора крохмалю:
2Na2S2O3 + I2 → 2NaI + Na2S4O6
Щоб дізнатися про кількість йоду, яка приєдналася до ненасичених жирних кислот досліджуваної олії, слід провести в аналогічних умовах контрольний дослід (без наважки жиру). Різниця між кількістю 0,1 н розчину тіосульфату, використаного на титрування контрольної та дослідної проб, є показником кількості йоду, зв’язаного наважкою жиру.
Прилади, обладнання, матеріали: технічні та аналітичні ваги, колба з шліфованою пробкою місткістю 500 см3, бюретка місткістю 25 см3; піпетки місткістю 10, 15, 20 см3, мірна колба місткістю 100 см3, водяна баня, годинник.
Реактиви: 0,1 н розчин тіосульфату, 0,2 н розчин йоду (25 г йоду у 1000 см3 96%-ного спирту), етиловий спирт, 1%-ний розчин крохмалю, дистильована вода.
Техніка визначення – на попередньо зважене з точністю до 0,0002 г годинникове скло наносять декілька крапель (3...5) досліджуваного жиру і зважують. Опускають скло з жиром в хімічний стакан і додають стократну (за об’ємом кількість 96%-ного етанолу). Бажано, щоб маса жиру знаходилась в межах 0,2...0,3 г, тоді кількість спирту, що додається складе 20...30 см3. Суміш підігрівають для кращого розчинення на водяній бані за температури 45...50ºС, закривши стакан годинниковим склом або чашкою Петрі і перемішуючи вміст круговими рухами до отримання однорідного розчину (до зникнення жирових кульок). Далі відмірюють із бюретки 20 см3 спиртового розчину йоду (25 г кристалічного йоду в 1 л 96%-ного етанолу) і приливають циліндром 200 см3 дистильованої води. Під час внесення води суміш постійно перемішують скляною паличкою, потім, закривши стакан, залишають у спокої на 5 хв., після чого відтитровують надлишок йоду, що не зв’язався з ненасиченими кислотами 0,1 н розчином Na2S2O3 за присутності 1%-ного розчину крохмалю до зникнення синього забарвлення. Послідовність дій наведена на схемі рисунка 4.5. Паралельно проводять контрольний дослід (без жиру) зі збереженням всіх умов основного досліду. Йодне число (в г на 100 г жиру або в %) розраховують за формулою:
![]() (4.2)
(4.2)
де V – об’єм 0,1 н розчину Na2S2O3, витраченого на титрування в контрольному досліді см3, V1 – об’єм 0,1 н розчину тіосульфату, що витрачається на титрування основного досліду, см3; 0,01269 – кількість йоду, що відповідає 1 см3 0,1 н тіосульфату, г; К – поправковий коефіцієнт до 0,1 н розчину тіосульфату;m – маса наважки жиру, г.
Дані спостережень та розрахунків записують у процесі виконання роботи в таблиці 4.7 і роблять висновок про якість жиру за йодним числом.
Таблиця 4.7 – Результати спостережень та розрахунків для визначення йодного числа жиру
|
Назва параметру |
Значення |
|
Маса порожньої колби, m1, г |
|
|
Маса жиру з колбою, m2, г |
|
|
Маса наважки жиру, m, г |
|
|
Кількість 0,1 н розчину тіосульфату Na2S2O3, що витрачається на титрування під час проведення контрольного досліду (без жиру), V, см3 |
|
|
Кількість 0,1 н розчину тіосульфату Na2S2O3, що прореагувала з жиром, см3 |
|
|
Кількість 0,1 н розчину тіосульфату Na2S2O3, що витрачається на титрування надлишку йоду після приєднання його до жиру, V1, см3 |
|
|
Поправковий коефіцієнт до 0,1 н розчину тіосульфату Na2S2O3, К |
|
|
Йодне число, Й.ч., % І2 |
|
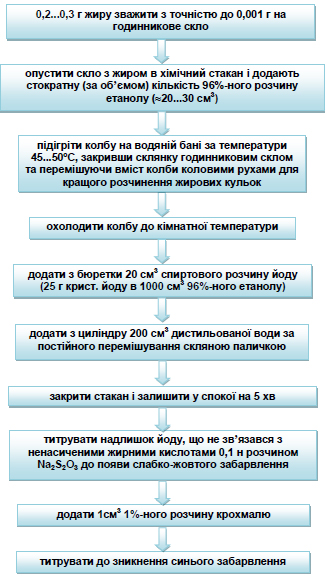
Рисунок 4.5 – Схема визначення йодного числа жиру методом Маргошеса
4.3.3 Рефрактометричний метод визначення йодного числа
Цей метод дає змогу визначити йодне число за показником заломлення олії. Необхідною умовою для отримання відтворюваності результатів та їх кореляції з даними, отриманими за допомогою хімічних методів, є суворе дотримання температури під час заміру показника заломлення. Визначення показника заломлення здійснюють на рефрактометрі ИРФ-454Б2М (рисунок 4.6). Величину йодного числа (в г на 100 г жиру) обчислюють за формулою, в яку підставляють середню величину показника заломлення (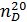 ), отриману для двох паралельних проб:
), отриману для двох паралельних проб:
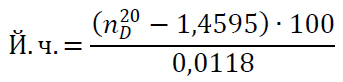 (4.3)
(4.3)

Рисунок 4.6 – Рефрактометр ИРФ-454Б2М