3.2 Властивості води
Фізичні властивості води і льоду
Вода має молекулярну масу приблизно рівну 18,02 і може існувати в станах рідини, пари і льоду, що характеризуються наступними показниками фазових переходів:
|
Точка замерзання (плавлення) за 101,3 кПа, °С........ |
0,00 |
|
Кипіння............................................................................ |
100,00 |
|
Потрійна точка............................................................... |
|
|
температура, °С.............................................................. |
0,0099 |
|
тиск, Па (мм рт. ст.)....................................................... |
610,4 (4,579) |
|
Теплота, кДж/моль (ккал/моль).................................... |
|
|
плавлення за 0°С............................................................ |
6,01 (1,435) |
|
Пароутворення за 100°С................................................ |
40,63 (9,704) |
|
Сублімації за 0°С............................................................ |
50,91 (12,16) |
Як видно з цих даних для води характерні висока температура кипіння і плавлення, високі значення теплоти фазових переходів (плавлення, пароутворення, сублімації) в порівнянні з гідридами деяких елементів, розташованих близько до Оксигену в періодичній системі (СН4, NH3, HF, H2S, HC1).
Воду виявляє незвичайна властивість розширюватися під час замерзання, внаслідок чого густина льоду нижча, ніж води за тієї ж температури, що нехарактерно для інших речовин під час переходу з рідкого стану в твердий. Серед інших аномалій води слід зазначити високе значення поверхневого натягу і діелектричної сталої та високу теплопровідність. Теплопровідність води вища, ніж інших рідин, а льоду – більше, ніж інших неметалічних твердих речовин. Слід також відмітити, що теплопровідність льоду за 0°С приблизно в чотири рази більше, ніж води за тієї ж температури, тобто лід проводить тепло значно швидше, ніж іммобілізована (нерухома) вода, що знаходиться в тканинах. Якщо врахувати, що темературопровідність льоду на порядок вище, ніж води, стає зрозумілим, чому тканини замерзають швидше, ніж відтають, якщо задається однакова різниця температур.
Будова молекули і властивості води. Взаємодія води з розчинними речовинами
Аномальні властивості води дають змогу зробити припущення про існування міцних сил між молекулами води.
Молекула води (sp3-гібридизація) має два частково негативних і два частково позитивних заряди в кутах тетраедра. Внаслідок цього, кожна молекула води, тетраедрично координована з чотирма іншими молекулами води завдяки водневим зв'язкам (рисунок 3.2):
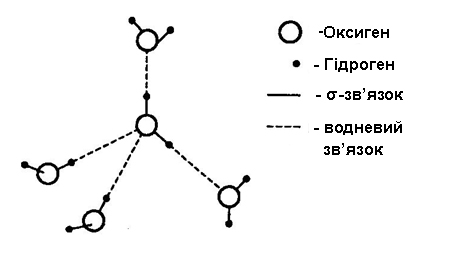
Рисунок 3.2 – Тетраедрична координація молекул води
Одночасна присутність в молекулі води двох донорів і двох акцепторів робить можливою асоціацію в тривимірну структуру, стабілізовану водневими зв'язками, що забезпечує велику силу взаємодії між молекулами. Ця структура пояснює особливі фізичні властивості води, незвичайні для малих молекул.
Здатність води утворювати тривимірні водневі зв'язки, для руйнування яких потрібна додаткова енергія, пояснює розглянуті вище незвичайні властивості води, наприклад високі значення теплоємності, точок плавлення і кипіння, поверхневого натягнення і теплот фазових переходів.
З хімічної точки зору вода є дуже реакційноздатною речовиною. Вона взаємодіє з багатьма оксидами металів і неметалів, взаємодіє з активними металами і вступає в різні інші реакції найрізноманітнішого характеру.
Перетворення білків, ліпідів, вуглеводів за участю води мають важливе значення в харчових технологіях.
Окрім хімічних реакцій, в які вступає вода, за розчинення в ній речовин мають також місце взаємодії фізико-хімічного характеру.
У випадку додавання різних речовин до води змінюються властивості як самої речовини, так і води. Гідрофільні речовини взаємодіють з водою шляхом іон-дипольного або диполь-дипольного механізму, викликаючи зміни в структурі води, її рухливості, а також в структурі і реакційній здатності гідрофільних речовин. Гідрофобні групи доданих до води речовин взаємодіють з нею слабо, віддаючи перевагу неводному оточенню. Молекули біля гідрофобних груп стають більше впорядкованими, що призводить до зменшення ентропії. Щоб зменшити контакт з водою, гідрофобні групи агрегуються.
Взаємодія води з іонами та іонними групами
Вода, що взаємодіє з іонами і іонними групами, є найбільш міцно зв’язаною в харчових продуктах. Нормальна структура чистої води (конфігурація тетраедра, що тримається на водневих зв'язках) порушується в результаті додавання дисоціюючих речовин. Для простих неорганічних іонів, які не мають донорних або акцепторних місць для утворення водневих зв'язків, зв'язок є просто полярним. Простий приклад – гідратовані іони хлориду натрію. Вода в мультишарі існує в структурно зруйнованому стані через конкуруючий вплив, з одного боку, моношару, з іншого – зовнішньої маси води.
Здатність іонів змінювати структуру води тісно пов'язана з силою електричного поля іона. Малі і (або) багатовалентні (головним чином, позитивні) іони, такі як Li+, Na+, H3O+, Ca2+, Ba2+, Mg2+, Al3+, F-, OH– мають сильне електричне поле і є утворювачами сітчастої структури. Біля кожного з цих іонів розташовані від 4 до 6 молекул води. Зв’язана вода є менш лабільною і має щільнішу структуру в порівнянні з чистою водою (рисунок 3.3).
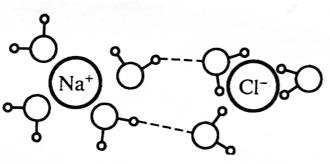
Рисунок 3.3 – Структура зв’язаної води
Великі і моновалентні іони (головним чином, негативно заряджені іони і великі позитивні іони), такі як K+, Cs+, NH4+, Cl-, Br-, I-, NO3-, BrO3-, IO3– і ClO4-, мають відносно слабке електричне поле і є руйнівниками сітчастої структури, хоча для К+ цей ефект є дуже слабким.
Завдяки різній здатності іонів до гідратації, змінювати водну структуру, впливати на діелектричну сталу водного середовища і товщину подвійного електричного шару біля колоїдів, вони сильно впливають на суспендовані і інші розчинені речовини в середовищі. Тому, наприклад, конформація білків і стабільність колоїдів сильно залежать від виду і кількості присутніх іонів.
Взаємодія води з нейтральними групами, що мають здатність утворювати водневі зв'язки
Водневі зв’язки вода-розчинена речовина є слабкішими, ніж у випадку вода-іон взаємодіях. Проте, вода, що зв'язана за допомогою водневих зв’язків з розчиненою речовиною, може бути класифікована як "органічно зв'язана" або "довколишня" і повинна проявляти знижену рухливість в порівнянні з водою в масі розчину (водної фази).
Можна чекати, що речовини, здатні до утворення водневих зв'язків, не підвищують або, принаймні, не руйнують нормальну структуру чистої води. Проте у ряді випадків відзначається орієнтація водневих зв'язків, відмінна від нормальної води.
Водневі зв'язки води утворюються з різними групами (гідроксил-, аміно-, карбоніл-, амід- або іміно-). Наприклад, вода утворює водневі зв'язки з двома видами функціональних груп білків. Ці зв'язки можуть бути як в одній макромолекулі між різними групами, так і між різними макромолекулами:
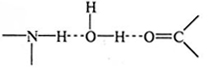
Взаємодія вода-неполярна речовина
У системі вода-неполярна речовина важливі два аспекти структурних утворень: утворення клатратних гідратів і гідрофобні взаємодії у білках.
Клатратні гідрати є сполуками включення, тобто це сполуки, що мають молекулу-"хазяїна", яка утворюється за рахунок водневих зв'язків, і молекулу -"гостя". Утворення такого типу мають місце у біологічних матеріалах.
"Гості" в клатратних гідратах є низькомолекулярними сполуками, а "хазяїн" – сітка з 20...74 водних молекул.
Типові "гості" – низькомолекулярні вуглеводні, галогенвуглеводні, діоксид вуглецю, етиленоксид, етиловий спирт, коротколанцюгові первинні, вторинні і третинні аміни, алкіл-амоній. Взаємодія між водою і "гостем" часто зумовлена слабкими Ван-дер-ваальсовими силами, але може мати місце і електростатична взаємодія.
Клатратні гідрати мають важливе значення, оскільки впливають на конформацію, реакційноздатність і стабільність таких молекул, як білки.
Гідрофобні взаємодії у водному оточенні є також важливими, оскільки приблизно 40% загальних амінокислот у більшості білків мають неполярні групи. Неполярні групи інших компонентів, таких як спирти, жирні кислоти, вільні амінокислоти, також можуть брати участь в гідрофобних взаємодіях. Ці взаємодії є слабкими, за силою вони приблизно такі ж, як сили Ван-дер-Ваальса. Гідрофобні взаємодії важливі для четвертинної структури багатьох білків, тому вода (і водна структура) відіграє важливу роль в конформації білку.