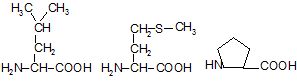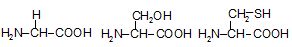4.3 Амінокислоти та їх деякі функції в організмі
До складу білків входять α-амінокислоти, тобто такі, в яких аміногрупа розташована біля другого атома С. Між аміно- і карбоксильною групами знаходиться тільки один α-С атом. В процесах обміну речовин утворюються і інші види амінокислот. Наприклад, γ-аміномасляна кислота (ГАМК) – є медіатором центральної нервової системи. Амінокислоти, що входять до складу білків, а їх більше 20, називаються протеїногенними. Серед амінокислот розрізняють незамінні амінокислоти – це амінокислоти, які необхідні для росту та нормального розвитку організму і не синтезуються в ньому, а засвоюються готовими з їжі. До них належать: валін, лейцин, ізолейцин, лізин, фенілаланін, метіонін, триптофан, треонін, гістидин і аргінін.
Загальну формулу α-амінокислоти можна зобразити так:
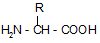
де R- вуглеводневий радикал. Радикал може бути аліфатичний або циклічний, містити різні функціональні групи. Одна із двадцяти α-амінокислот (пролін) є не аміно-, а імінокислотою, тому що її атом Нітрогену входить до складу циклу.
Для пояснення і розуміння властивостей амінокислот варто пам’ятати наступне:
1. Амінокислоти в твердому або розчиненому стані, завжди знаходяться у формі біполярних іонів (цвіттер-іонів), положення рівноваги яких залежить від рН середовища:
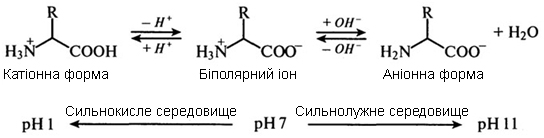
Перебування амінокислот у вигляді іонів зумовлює розчинність у воді і нерозчинність в неполярних рідинах. Більшість амінокислот є розчинними у воді, але у амінокислот із гідрофобними групами (ізолейцин, лейцин, тирозин) розчинність є відносно невисокою. В організмі іонний стан амінокислот визначається їх всмоктуваністю в шлунково-кишковому тракті після гідролітичного розщеплення білків і транспорту до різних органів і тканин. Здатність до іонізації в кислому або лужному середовищі лежить в основі розділення амінокислот за допомогою іонообмінної хроматографії і електрофорезу.
2. Більшість природних α-амінокислот відносяться до L-стереохімічного ряду, однак в деяких пептидах (антибіотики граміцидин, актиноміцин) зустрічаються амінокислоти D-ряду. Останні, як правило, не засвоюються організмом людини. Амінокислоти D- і L-рядів значно відрізняються за смаком. Так, D-глутамінова кислота не має смаку, а L-глутамінова кислота має смак м’яса (її отримують із клейковини пшениці і використовують як смакову добавку до харчових концентратів). Солодкий смак мають й інші амінокислоти L-ряду: валін, треонін, пролін, серин (використовуються як замінники цукру в харчуванні діабетиків).
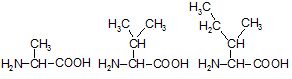
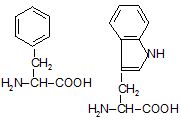
3. Амінокислоти відрізняються одна від одної структурою бічних ланцюгів, від яких залежать хімічні, фізичні властивості і фізіологічні функції білків в організмі (рисунок 4.2).
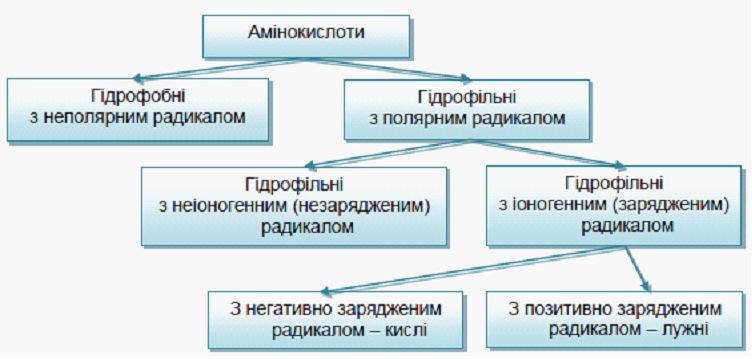
Рисунок 4.2 – Класифікація амінокислот за полярністю радикалу
Амінокислоти з гідрофобними бічними групами в більшій мірі локалізовані всередині білкових макромолекул, тоді як амінокислоти з полярними боковими групами розташовуються на їх поверхні У складі полярних α-амінокислот є функціональні групи, що здатні до іонізації (іоногенні) і такі, що нездатні переходити в іонний стан (неіоногенні). Кислі і основні іоногенні групи радикалів, як правило, розташовуються на поверхні молекул білків і приймають участь в іонних (електростатичних) взаємодіях. В якості полярних неіоногенних груп в молекулах білків виступають гідроксильні групи серину, треоніну й амідні групи глутаміну (Глн) і аспарагіну (Асн). Ці групи можуть розташовуватись як на поверхні, так і всередині білкової молекули, і приймати участь в утворенні водневих зв’язків з іншими полярними угрупуваннями.
|
Гідрофобні амінокислоти з неполярним радикалом |
||||||
|
|
||||||
|
Аланін* (Aла, Ala, A) |
Валін* (Вал, Val, V) |
Ізолейцин* (Ілей, Ile, I) |
||||
|
|
||||||
|
Лейцин* |
Метіонін* |
Пролін* |
Фенілаланін* |
Триптофан* |
||
|
(Лей, Leu, L) |
(Мет, Met, M) |
(Про, Pro, P) |
(Фен, Phe, P) |
(Три, Trp, W) |
||
|
Гідрофільні амінокислоти з неіоногенним (полярним незарядженим) радикалом |
||||||
|
|
||||||
|
Гліцин* (Глі, Gly, G) |
Серин* (Сер, Ser, S) |
Цистеїн* (Цис, Cys, C) |
||||
|
|
||||||
|
Треонін* (Тре, Thr, T) |
Аспарагін* (Асн, Asn, N) |
Глутамін* (Глн, Gln, Q) |
Тирозин* (Тир, Tyr, Y) |
|||
|
Гідрофільні амінокислоти з іоногенним радикалом – кислі |
||||||
|
|
||||||
|
Аспарагінова кислота* (Aсп, Asp, D) |
Глутамінова кислота* (Глу, Glu, E) |
|||||
|
Гідрофільні амінокислоти з іоногенним радикалом – лужні |
||||||
|
|
||||||
|
Лізин* (Ліз, Lys, K) |
Аргінін* (Арг, Arg, R) |
Гістидин* (Гіс, His, H) |
||||
|
Примітка.* Подані тривіальні назви амінокислот є найбільш вживаними (в дужках подаються скорочені українська і англійська назви і міжнародний символ). |
||||||