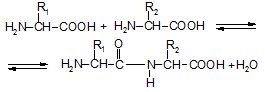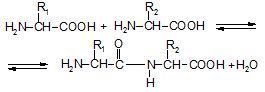4.5 Будова пептидів та білків
До складу білків входить в основному 20 різних альфа-амінокислот, які сполучені між собою у певній послідовності. У молекулі білка розрізняють такі типи зв’язків: пептидний, дисульфідний, водневий, йонний та гідрофобну взаємодію.
Пептидний зв’язок – це зв’язок, який утворений карбоксильною групою однієї амінокислоти з α-амінною групою іншої кислоти:
|
|
|
Утворена сполука називається пептидом. В результаті сполучення двох амінокислот утворюється дипептид, трьох – трипептид, а багатьох – поліпептид. Пептидний зв'язок є міцним, він піддається гідролізу тільки за тривалого кип'ятіння в кислому або лужному середовищі.
Наявність пептидного зв’язку визначають біуретовою реакцією, характерною для амідів, зокрема, для біурету. Першим біуретову реакцію пептидів вивчав О. Я. Данилевський. Суть її полягає у взаємодії пептидної групи з йонами міді (II) в лужному середовищі з утворенням розчинного комплексу фіолетового кольору. Ця реакція дуже чутлива і використовується як для якісного, так і для кількісного визначення пептидів.
Дисульфідний зв’язок – зв’язок, який утворюється внаслідок відщеплення атомів Гідрогену від сульфідних груп двох амінокислотних залишків цистеїну:
SH + HS- → - S-S- + 2H
Дисульфідні зв’язки мають велике значення у формуванні третинної структури білків. Вони є нестійкими до дії водню.
У білків розрізняють чотири рівні структурної організації – первинну, вторинну, третинну й четвертинну (рисунок 4.4).
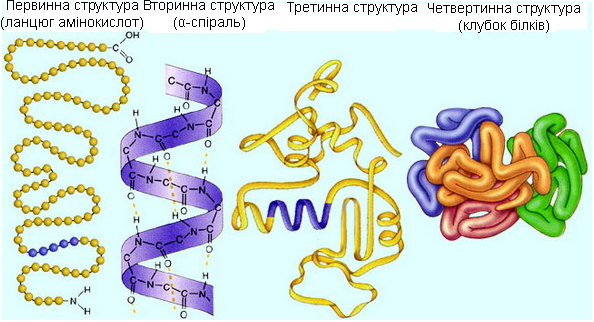
Рисунок 4.4 – Структурна організація білкової молекули
Первинна – певна послідовність залишків альфа α-амінокислот у поліпептидних ланцюгах молекул білка.
Вторинна – просторова конфігурація поліпептидного ланцюга, найпоширенішою є права α-спіраль і β-структура або складчастий лист. Вторинну структуру визначає первинна.
Третинна – розташування поліпептидного ланцюга в просторі (глобулярна або фібрилярна структури).
Четвертинна структура характерна для тих білків, молекули яких складаються з двох, чотирьох, і більше поліпептидних ланцюгів. Ця структура відображає характер взаємного розташування поліпептидних ланцюгів в просторі. Четвертинну структуру мають білки, які виконують складні біологічні функції і активність яких залежить від дії регулюючих факторів.