4.8 Білки харчової сировини
Білки зернових культур
Середній вміст білків в злаках складає від 7 до 17%. Найбільш білкововмісною серед злаків є пшениця, найменша кількість білку міститься в рисі і кукурудзі (7...9%).
Білки нерівномірно розподіляються між морфологічними частинами зерна. Вони накопичуються в дозріваючому зерні і служать для живлення зародка на початкових етапах проростання. Основна їх кількість припадає на ендосперм* (65...75%); на зародок до 22%, на алейроновий шар до 15,5%.
У ендоспермі білки розподілені також нерівномірно, концентрація їх знижується у міру просування до центру. Центральна частина ендосперму містить мало білку (7...9%). Розподіл білку по частинах зернівки залежить від виду культури, її сорту і ґрунтово-кліматичних умов вирощування. Біологічна цінність білків злаків різна. У таблиці 4.2 представлений вміст незамінних амінокислот в сумарних зернових білках.
Аналізуючи амінокислотний склад сумарних білків різних злакових культур з точки зору складу еталонного білку для харчування людей (ФАО, 1973) слід зазначити, що усі вони, за винятком гречки і вівса, є бідними на лізин (2,2...3,3%), а за винятком рису, гречки і сорго – на ізолейцин. Для білків пшениці, сорго, ячменю і жита характерна відносно невелика кількість метіоніну (1,6...1,7мг/100 г білку). Білки пшениці до того ж містять недостатню кількість треоніну (2,6%), а білки кукурудзи – триптофану (0,6%). Найбільш збалансованими за амінокислотним складом є овес і гречка.
Примітка.* Запасні білки злаків і бобових культур локалізовані в ендоспермі, а в насінні олійних культур – у зародку.
Під час вивчення білків зернових культур використовують метод вилучення їх фракцій за розчинністю (альбуміни, глобуліни, проламіни і глютеліни), запропонований американським дослідником Т. Осборном.
Таблиця 4.2 – Вміст незамінних амінокислот в сумарних зернових білках і потреба в них людини (%)
|
Найменування |
Пшениця |
Жито |
Ячмінь |
Овес без плівок |
Рис |
Просо |
Кукурудза |
Сорго |
Гречка |
Потреба людини за даними ФАО |
Молоко коров'яче |
|
Лізин |
2,6 |
3,8 |
3,2 |
4,2 |
3,5 |
2,2 |
2,5 |
2,5 |
6,3 |
4,2 |
6,6 |
|
Метіонін |
1,7 |
1,7 |
1,7 |
2,5 |
2,9 |
2,4 |
2,1 |
1,6 |
1,5 |
2,2 |
2,4 |
|
Триптофан |
1,3 |
1,6 |
1,2 |
1,9 |
1,3 |
1,4 |
0,6 |
0,9 |
2,2 |
1,4 |
1,4 |
|
Валін |
4,6 |
5,3 |
5,4 |
5,3 |
6,5 |
4,8 |
4,4 |
5,2 |
4,8 |
4,2 |
6,9 |
|
Ізолейцин |
3,4 |
3,5 |
3,5 |
3,9 |
4,6 |
3,9 |
2,7 |
5,6 |
4,7 |
4,2 |
6,6 |
|
Лейцин |
6,9 |
7,5 |
7,2 |
7,4 |
8,0 |
9,6 |
11,2 |
12,7 |
6,3 |
4,8 |
9,9 |
|
Треонін |
2,6 |
3,2 |
2,9 |
3,3 |
3,5 |
3,3 |
3,2 |
2,7 |
3,2 |
2,8 |
4,6 |
|
Фенілаланін |
4,3 |
5,2 |
5,1 |
5,3 |
5,2 |
4,8 |
4,1 |
4,3 |
4,1 |
2,8 |
4,9 |
|
Сирий білок (% с. р.) |
13,5 |
11,5 |
12,5 |
17,1 |
7,8 |
11,0 |
9,5 |
11,2 |
11,1 |
– |
– |
Альбуміни розчиняються у воді. З водних розчинів альбуміни осаджуються висолюванням за насиченні розчину солями (сульфатом амонію та ін.). Альбумінний комплекс зерна в основному складається з ферментів.
Глобуліни розчиняються у водних розчинах різних солей (застосовують зазвичай 5...10%-ний розчин NaCI). У чистій воді вони є нерозчинними. Для виділення глобулінів з сольового розчину застосовують діаліз за допомогою напівпроникних мембран або розбавляють великою кількістю води. Глобуліни складають велику частину насіння бобових культур.
Проламіни є найбільш характерними білками для зерна більшості злакових культур. Вони розчиняються в 60...80%-ному розчині етанолу. До проламінів відносять гліадин із зерна пшениці і жита (складова частина клейковини), гордеїн – ячменю, зеїн – кукурудзи, авенін – вівса.
Глютеліни розчиняються в розчинах лугів (0,1...0,2%). Вони є мало вивченими, оскільки їх важко виділити в чистому вигляді. Найбільш вивченим є глютелін зерна пшениці (складова частина клейковини), оризенін рису і глютелін кукурудзи.
Будь-яке виділення білка за допомогою розчинника порушує природну структуру білкової молекули, оскільки руйнує або змінює нековалентні зв'язки, тобто виділення білка з рослинного матеріалу завжди супроводжується початковою стадією денатурації.
У таблиці 4.3 наводиться відсотковий вміст білкових фракцій в зернових культурах.
Навіть екстракція білків водою пов’язана з порушенням гідрофобної взаємодії, відбувається перехід солей металів в розчин і іонна рівновага білкової молекули порушується. А під час виділення білків розчином лугу відбувається розрив навіть дисульфідних зв’язків(-S-S-).
Таблиця 4.3 – Вміст білкових фракцій в зерні злакових
|
Культура |
Азот фракцій (в % від білкового азоту) |
||||
|
Альбуміни |
Глобуліни |
Проламіни |
Глютеліни |
Склеропротеїни |
|
|
Пшениця м'яса |
5,2 |
12,6 |
35,6 |
28,2 |
8,7 |
|
Жито |
24,5 |
13,9 |
31,1 |
23,3 |
7,2 |
|
Ячмінь |
6,4 |
7,5 |
41,6 |
26,6 |
17,9 |
|
Кукурудза |
9,6 |
4,7 |
29,9 |
40,3 |
15,5 |
|
Овес |
7,8 |
32,6 |
14,3 |
33,5 |
11,8 |
|
Гречка |
21,7 |
42,6 |
U |
12,3 |
23,3 |
|
Рис |
11,2 |
4,8 |
4,4 |
63,2 |
16,4 |
Розділення протеїнів за розчинністю носить умовний характер. Сучасними методами встановлена гетерогенність кожної з названих білкових фракцій. Кожна з них складається з декількох, у багатьох випадках з багатьох десятків різних білків, що мають деякі загальні властивості.
До складу білків входять і так звані склеропротеїни (нерозчинні білки), що містяться в оболонках і периферійних шарах зерна. Особливістю білків цієї фракції є міцне з’єднання з лігніно-полісахаридним комплексом. Склеропротеїни виконують структурну функцію є мало доступними для травлення. Разом з білками в зерні міститься небілковий азот (0,7...12,9% від загального азоту), що включає вільні амінокислоти (50...60%), пептиди, нуклеотиди та ін. Кількість небілкового азоту змінюється в залежності від ступеня зрілості, вирівнянності і проростання зерна.
Запасні білки зерна і насіння різних культур характеризується певним фракційним складом. Наприклад, запасні білки насіння соняшнику в основному складаються з глобулінів (солерозчинних) білків, ця фракція характерна також для бобових культур. Злакові культури містять в основному спирто- і лугорозчинні білки (проламіни і глютеліни).
Білки пшеничного зерна
За даними Т. Осборна, в пшеничному зерні міститься:
– 4% проламінів,
– 4,4% глютелінів,
– 0,6% глобулінів,
– 2,4% альбуміну і інших водорозчинних речовин білкової природи.
Тобто сумарний вміст білка складає 11,4%.
У зерні пшениці найбільше проламінів і глютелінів, які утворюють клейковину. Проламін пшениці називають гліадином. Він краще всього розчиняється в 60%-ному етанолі. Його ізоелектрична точка відповідає рН 7,0.
Амінокислотний склад гліадину відрізняється малим вмістом незамінних амінокислот – триптофану і лізину. В той же час багато глютамінової кислоти (46,6%) і проліну(17,0%).
Глютелін пшениці називають глютеніном (від французького Gluten – клейковина). За амінокислотним складом він відрізняється від гліадину, але також містить багато глютамінової кислоти (42,1%).
У наш час встановлено, що гліадин і глютенін складаються з ряду білків, що розрізняються за молекулярною масою і амінокислотним складом. Так, гліадин був розділений на 4 основні фракції (α, β, γ, ω), а кожна з цих фракцій була розділена на ряд індивідуальних білків з молекулярною масою від 30000 до 160000 Д**.
Більшість гліадинових білків побудована з одного поліпептидного ланцюга*** з молекулярною масою 30...45 кД і внутрішньомолекулярними дисульфідними зв’язками (рисунок 4.5). У меншій кількості до складу гліадину входять білки з молекулярною масою 22; 25,6; 48,8; 57,3 кД, а також димери, побудовані з одноланцюгових молекул головного типу (36,5 і 44,2 кД).
Примітка.**Молекулярна маса – сума мас атомів, що входять до складу даної молекули, виражається в атомних одиницях маси (а.о.м.), яку також прийнято називати дальтон, Д (відповідно кД – кілодальтон).
*** Поліпептиди – це пептиди з молекулярною масою до 10000, а пептиди з більшою молекулярною масою – білки.
Глютенін пшениці є більш гетерогенною білковою фракцією в порівнянні з гліадином. Він складається з багатьох компонентів з молекулярною масою від 50 до 3000 кД. Глютенін – це білок, побудований з багатьох поліпептидних ланцюгів, сполучених між собою дисульфідними зв'язками, причому на кожен поліпептидний ланцюг глютеніну припадає 2...3 дисульфідні зв'язки з сусідніми ланцюгами (рисунок 4.5).
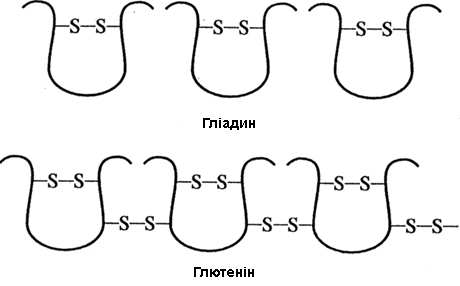
Рисунок 4.5 – Послідовність дисульфідних зв’язків в молекулі гліадину і глютеніну
Альбумін, що міститься в пшеничному зерні, був названий лейкозином. Лейкозин представляється собою комплекс різних білків з молекулярною масою 20000...25000, причому, до складу цього комплексу входять білки-ферменти. Він міститься, головним чином у зародку. Цей білок легко денатурується і втрачає свою розчинність.
Якщо отримати водний екстракт з пшеничного зерна або зародка і додати до нього навіть трохи спирту або ацетону, то лейкозин випадає в осад і його вже не можна перевести знову у водний розчин. Легко денатурується під впливом нагрівання.
За неправильного висушування зерно перегрівається під дією високих температур і втрачає схожість. Це викликано денатурацією лейкозину.
У зерні пшениці знайдений білок, який з’єднаний з ліпідами і тому екстрагується з борошна петролійним етером. Цей білок називається пуротіоніном, він містить близько 16% цистину. Складається з 2-х компонентів(α- і β-пуротіоніна) з молекулярною масою 12500 і 5000...7000.
Подібні білки знайдені в зерні ячменю і названі гордотіоніном.
У зерні твердої пшениці виявлений водорозчинний білок, що містить 0,03% Купруму і який має коричневе забарвлення. Від нього залежить коричневий колір макаронів, які отримують з деяких партій твердої пшениці.
Клейковина
Клейковина була відкрита в пшеничному борошні італійським вченим Беккарі в 1745 р. Білки клейковини містяться також в зерні деяких сортів ячменю, пирію та ін. За даними Казакова Е.Д., деякі сорти пирію містять більше 65% сирої клейковини.
Вміст клейковини в зерні і борошні пшениці є важливим показником якості.
Сира клейковина містить 2/3 (66%) води і 1/3 сухої речовини, яка в основному складається з білків. Від кількості і реологічних властивостей клейковини залежить здатність пшеничного борошна давати під час випічки пишний хліб з пружним еластичним і пористим м’якушем.
Клейковина є складним білковим комплексом, що складається з 2-х фракцій – гліадинової і глютенінової в співвідношенні 1:1 (білки складають 80...85%, вуглеводи 10...15%, ліпіди 2...8%)
Окремо ці фракції властивостей клейковини не мають. Гліадин легко відділяється від глютеніну шляхом екстракції 60...70%-ним етанолом. Це вказує на те, що дві фракції сполучені нековалентними зв’язками.
Клейковина різної якості має однаковий амінокислотний склад і складається з одних і тих же білкових компонентів. Але міцність їх взаємного з’єднання є різною. У міцній клейковині "щільність упаковки" білкових елементів вища, ніж в слабкій.
У формуванні структури клейковини і її властивостей важливу роль відіграють дисульфідні (-S-S-) і водневі зв’язки. Встановлено, що гліадин має внутрішні -S-S- зв’язки, тобто складається з декількох поліпептидних ланцюгів, сполучених дисульфідними зв’язками. Таким чином, клейковина є єдиним олігомерним білком, що має тривимірну сітчасту структуру.
Міцність і одночасно рухливість структури молекули клейковини створюють специфічні реологічні властивості – пружність, еластичність, розтяжність та ін. Це пояснюється наявністю великої кількості нековалентних зв’язків, які легко розриваються і знову виникають за різних дій на білок.
Якість клейковини тісно пов’язана з кількістю дисульфідних зв’язків, що оцінюється співвідношенням числа -S-S-зв’язків до числа SH-груп.
В залежності від реологічних властивостей клейковини сорти пшениці підрозділяються на тверді і м’які.
У твердої пшениці клейковина міцна під час розтягування коротко рветься. Тісто виходить міцне, з високою пружністю, малорозтяжне. Такі властивості повинне мати тісто для виготовлення макаронних виробів, манної крупи.
У м'якої пшениці клейковина поєднує пружність з еластичністю і розтяжністю. Тісто має гарну газоутримувальну здатність і під час випікання дає хліб пористої структури. Такі властивості потрібні для виробництва хлібобулочних виробів.
Група м’якої пшениці за властивостями клейковини поділяється на сильні, середні і слабкі сорти.
Борошно з пшениці сильних сортів дає пружне еластичне тісто, хліб добре зберігає форму, під час випікання дає пористу структуру м'якуша.
Тісто з борошна дуже сильної клейковини має обмежену здатність до розтягування і знижену газоутримувальну здатність, тому хліб має знижений об’єм.
В результаті підмішування борошна з сильної пшениці до борошна з низькими хлібопекарськими властивостями, отримують борошно з гарними властивостями. Тому сорти сильної пшениці називають сортами-поліпшувачами.
Середня пшениця сама дає хліб гарної якості, але вона не зможе ефективно поліпшити слабку пшеницю.
Борошно з пшениці слабких сортів дає низький, розпливчатий хліб з поганою пористістю. Гарний хліб можна отримати, якщо тільки додавати сорту поліпшувачі.
У ендоспермі пшеничного зерна клейковина розподіляється нерівномірно. Найбільше клейковини злокалізовано в зовнішньому шарі ендосперму, меншого всього – у внутрішніх шарах. Тому борошно II ґатунку міститиме більше клейковини.
Білки зерна жита
У зерні жита міститься гліадин і глютенін, але за звичайних умов відмити клейковину не вдається. Це пояснюється тим, що білки жита відрізняються від пшеничних за амінокислотним складом, фізичними і хімічними властивостями. Наприклад, гліадин жита краще розчиняється у водноспиртових розчинах.
Під час екстракції білків жита водою, а потім слабким розчином кислоти з подальшою нейтралізацією лугом, отримують білкову масу, яка має властивості клейковини. Вона має еластичність і розтяжність. Але така клейковина значно слабкіша за пшеничну, оскільки містить менше дисульфідних і водневих зв’язків.
Білки ячменю і вівса
Так як і у випадку пшениці зерно ячменю має невелику кількість альбуміну. Проламінів і глютелінів міститься приблизно в рівних кількостях. Проламін ячменю називається гордеїн.
Клейковина ячменю схожа на погану клейковину пшениці, що коротко рветься. Вона має сірий колір, погану розтяжність і гідратаційну здатність.
Ячмінь застосовують для випічки хліба і перепічок, там, де за природними умовами не можна вирощувати інші злаки. Хліб з ячмінного борошна має неприємний присмак, низьку якість, швидше черствішає.
У зерні вівса також є присутнім проламін, глютелін і деяка кількість альбуміну. Спирторозчинний білок вівса називається авенін, але переважає фракція глютелінів. За вмістом окремих амінокислот білки зерна вівса помітно викриваються від пшениці і ячменю. У них міститься в 2 рази більше лізину, ніж у білках пшениці. Тому овес характеризується високою біологічною активністю.
Білки кукурудзи
Найбільшу кількість білка містить зародок кукурудзяного зерна, на другому місці – його ендосперм. Кукурудзяне зерно містить, головним чином, два білки: проламін, який називають зеїн і глютелін. Глютелін складає приблизно 40% від усього білка, зеїн – приблизно стільки ж.
Зеїн відрізняється від інших білків амінокислотним складом – він практично не містить незамінних амінокислот – лізину і триптофану, тому є біологічно неповноцінним. Зеїн має промислове знання. У США він широко застосовується для виробництва особливих сортів паперу і пластичних мас.
Білки зерна рису
Характеризуються відсутністю проламінів. Основна маса білка представлена глютеліном, який називається оризеніном. Його вміст складає 93% від загальної кількості білків. Оризенін має велику молекулярну масу (до 2 млн) і складається з субодиниць двох типів, сполучених дисульфідним зв’язком.
У складі білків рису міститься усі незамінні амінокислоти, що зумовлює його біологічну цінність. Першою лімітуючою амінокислотою є лізин, другою – треонін. За амінокислотним складом рис наближається до білків гречки.
Білки зерна гречки
Фракційний склад білків зерна гречки характеризується майже повною відсутністю проламінів. Переважають глобуліни, на другому місці – водорозчинні білки. Білки гречки відрізняються високим вмістом незамінних амінокислот. За лізином зерно гречки перевершує пшеницю, жито, рис і наближається до соєвих бобів. За вмістом валіну може бути прирівняним до молока, за лейцином – до яловичини, а за фенілаланіном – до молока і яловичини. За вмістом триптофану зерно гречки не поступається продуктам тваринного походження.
Таким чином, білки зерна гречки є добре збалансованими за вмістом незамінних амінокислот. Виняток становлять ізолейцин і особливо сірковмісні амінокислоти, яких недостатньо у білках гречки.
Білки бобових культур
Насіння бобових відрізняється високим вмістом білка (20...40%) і його гарним амінокислотним складом. Вміст білків в насінні бобових, за даними різних авторів, змінюється в межах, наведених в таблиці 4.4. Розподіл білків за фракціями наведений в таблиці 4.5.
Таблиця 4.4 – Вміст білків в насінні бобових, %
|
Найменування |
Коливання |
Середній вміст |
Найменування |
Коливання |
Середній вміст |
|
Горох |
20,4–35,7 |
27,8 |
Кормові боби |
26,4–31,2 |
29,2 |
|
Квасоля |
17,0–32,1 |
24,3 |
Чина |
23,1–34,7 |
28,7 |
|
Сочевиця |
21,3–36,0 |
30,4 |
Нут |
18,5–29,7 |
24,5 |
|
Соя |
27,0–50,0 |
39,0 |
Віка ярова |
22,3–37,8 |
33,7 |
Таблиця 4.5 – Середній розподіл насіння бобового за фракціями, %
|
Найменування |
Альбумін |
Глобуліни |
Глютеніни |
|
Горох |
9,6 |
85,7 |
4,8 |
|
Сочевиця |
8,1 |
85,9 |
6,0 |
|
Віка |
10,1 |
83,6 |
6,3 |
|
Маїс |
8,3 |
88,4 |
3,3 |
|
Нут |
12,2 |
79,8 |
7,9 |
Проламінова фракція у білках насіння бобових відсутня. Основна фракція – глобуліни. Найменша кількість припадає на частку глютелінів. Альбуміну трохи більше, ніж глютелінів. У насінні бобових знайдені окремі, характерні для тієї або іншої культури білки – в насінні гороху водорозчинний легумелін і два глобуліни (легумін і віцилін), в насінні квасолі – глобулін фазеолін, в насінні сої – глобулін гліцинін.
Незважаючи на кількісні розбіжності, амінокислотний склад насіння бобових має багато спільного, аспарагінова і особливо глютамінова кислоти містяться в найбільшій кількості, в найменшій – цистин, метіонін і триптофан. Білки насіння бобових є бідними на сірковмісні амінокислоти. Але в насінні бобових у значних кількостях міститься багато незамінних амінокислот.
Оскільки насіння бобових є бідними на сірковмісні амінокислоти (метіонін + цистин), які в надмірній кількості містяться у білках злакових, то в харчовому відношенні білки бобових добре доповнюють білки злаків.
Для повного засвоєння білку бобових культур живим організмом потрібна їх попередня обробка. Сире зерно містить лише 15...20% засвоюваного білку. Глобулінова фракція білків квасолі стійка до деяких протеолітичних ферментів. Завдяки високому вмісту білків, багатих незамінними амінокислотами, насіння бобових культур є одним з найважливіших джерел білку.
Серед бобових культур в якості джерела харчового біологічно цінного білку найбільше значення має насіння сої. З нього виготовляють соєве борошно (знежирене, напівжирне і незнежирене), концентрати й ізоляти. Проте поживна цінність білків сої, що не пройшла термічну обробку, є дуже низькою. Це пов’язано з високим вмістом у бобах сої інгібіторів протеаз різного типу.
Разом з білками, що мають поживну цінність, до складу не тільки сої але й інших бобових культур входять антиаліментарні сполуки, що мають також білкову природу. Вони знижують поживну цінність білкових продуктів і харчових виробів. До таких сполук відносяться інгібітори протеаз шлунково-кишкового тракту і лектини (білки глікопротеїнової природи).
Інгібітори протеаз шлунково-кишкового тракту пригнічують активність травних ферментів, наприклад, інгібітор Кунітца та інгібітор Баумана-Бирк (інгібітори трипсину і хімотрипсину. Ці інгібітори є білковими молекулами з молекулярними масами 21,5 і 8 кД, відповідно. У насінні сої міститься не менше п’яти інгібіторів трипсину у кількості 5...10% від загального вмісту білку.
Лектини (від лат. – "вибирати") – це глікопротеїни рослинного походження, що зв’язані з одним або декількома специфічними цукрами. Свою назву дістали за специфічною здатністю викликати вибіркову аглютинацію**** еритроцитів крові. На частку лектинів у бобових культурах припадає від 2 до 10% загального білку.
Примітка.****Аглютинація (від латинського "приклеювання") – агрегація, склеювання, частинок, клітин, спор.
Аглютинація відбувається шляхом взаємодії лектинів з вуглеводними компонентами поверхні клітин. Деякі лектини мають дуже високу вибіркову здатність і взаємодіють тільки з еритроцитами певної групи крові (використовуються для визначення групи крові). Лектини здатні аглютинувати ракові клітини.
Високий вміст лектинів в насінні деяких бобових робить їх токсичними. Причому токсичність може бути вибіркова, для певної групи людей. Дієтологи рекомендують обережно відноситися до додавання борошна з сирих соєвих бобів під час виробництва продуктів харчування.
Відсутність високої активності лектинів, як і інгібіторів ферментів, у білкових продуктах з бобових є однією з санітарно-гігієнічних вимог, що передбачаються сертифікацією для використання їх в хлібопеченні, кондитерській і інших галузях промисловості з метою підвищення харчової цінності виробів. Зниження активності лектинів досягається нагріванням за температури 80˚С.
В бобових, крупах, борошні білки знаходяться у вигляді сухих гелів. Під час замочування круп, бобових, а також під час замішування тіста білки набухають. Під час варіння зернобобових і випіканні тіста білки денатурують і зсідаються, в результаті чого гелі ущільнюються і виділяється значна кількість вологи, яка в них міститься. Але рідина не виходить в навколишнє середовище, як у випадку теплової обробки м’яса або риби, а залишається в продуктах, оскільки вона зразу поглинається крохмалем на його клейстеризацію.
Білки олійних культур
Більшість олійних культур за вмістом білків не поступаються бобовим культурам. Середній вміст білкових речовин в насінні окремих олійних культур змінюється від 16 до 28% (таблиця 4.6).
Білки насіння олійних є сумішшю близьких за своїми властивостями білків. В білках насіння олійних культур міститься 10...30% альбумінів і до 90% глобулінів. Білки алейронових зерен (алейрини) представлені в основному глобулінами (80...97%) і незначною кількістю альбумінів і глютелінів (1...2%). Проламіни практично відсутні.
Таблиця 4.6 – Середній вміст білків в насінні олійних культур, % сухої речовини
|
Найменування |
Білки |
Найменування |
Білки |
|
|
Соняшник |
сім'янка |
15,7 |
Рицина |
19,4 |
|
Бавовник |
20,5 |
|||
|
ядро(без плодової оболонки) |
23,7 |
Коноплі |
21,8 |
|
|
Рапс: |
|
|||
|
Льон |
сім'янка |
24,9 |
озимий |
25,0 |
|
яровий |
28,5 |
|||
|
зародок(ядро) |
21,6 |
Рижок |
27,9 |
|
|
ендосперм |
30,8 |
Коріандр |
16,0 |
|
Досить висока біологічна цінність білків олійних культур дозволяє розглядати їх як цінне джерело покриття дефіциту білкових речовин.
Білки насіння найважливіших олійних культур характеризуються високим вмістом і різноманітністю незамінних амінокислот (таблиця 4.7). Тому робляться спроби налагодити отримання з олійної сировини концентрованих форм білку і створення на їх основі нових форм білкової їжі. Особливістю амінокислотного складу білків насіння соняшнику, арахісу, рапсу, кунжуту і бавовнику є високий вміст тирозину і фенілаланіну, а у деяких культур – лізину (рапс), сірковмісних амінокислот (кунжут, соняшник, рапс) і треоніну (рапс, соняшник). Найбільш цінними у біологічному відношенні є білки рапсу, соняшнику і кунжуту(таблиця 4.7).
Таблиця 4.7 – Склад незамінних амінокислот насіння найважливіших олійних культур
|
Незамінні амінокислоти |
Насіння, мг на 1 г білку |
||||
|
Соняшник |
Арахіс |
Рапс (високоеруковий) |
Кунжут |
Бавовник |
|
|
Валін |
52 |
50 |
52 |
46 |
45 |
|
Ізолейцин |
37 |
36 |
40 |
40 |
35 |
|
Лейцин |
67 |
70 |
74 |
69 |
57 |
|
Лізин |
38 |
37 |
60 |
28 |
41 |
|
Треонін |
47 |
30 |
42 |
40 |
39 |
|
Метіонін + Цистин |
42 |
25 |
51 |
45 |
25 |
|
Фенілаланін + Тирозин |
80 |
95 |
86 |
83 |
83 |
|
Триптофан |
17 |
11 |
18 |
15 |
10 |
Для збагачення харчових сумішей бажано використовувати виділені білкові ізоляти. Більшість рослинних білкових харчових сумішей готують тільки з борошна або концентратів. Найбільш легкий і дешевий спосіб – використання білкового борошна, отриманого зі знежиреного олійного насіння. Проте насіння деяких олійних культур містить отруйні речовини, що є серйозною перешкодою для використання отриманих із них білкових ізолятів (як і самого насіння) в харчових продуктах і в кормах для худоби. Насіння бавовнику містить токсичну сполуку госипол, насіння рицини – високотоксичні білки лектини, здатні аглютинувати клітини.
Білки картоплі, овочів, плодів
Відносно низький вміст азотистих речовин в картоплі (приблизно 2%), овочах (1,0...2,0%) і плодах (0,4...1,0%) свідчить про те, що дані види харчової рослинної сировини не мають великого значення в забезпеченні білкам продуктів харчування (таблиця 4.8).
Таблиця – 4.8 – Вміст білку в овочах і плодах (в % на суху масу)
|
Капуста білокачанна |
Морква |
Цибуля |
Баклажани |
Буряк |
Огірки |
Кавун |
Абрикос |
Яблука |
|
1,8 |
1,3 |
1,4 |
1,2 |
1,5 |
0,8 |
0,7 |
0,9 |
0,4 |
Найбільшим вмістом запасних білків характеризується зелений горошок – в середньому 5,0%, в овочевій квасолі вміст білку складає 4,0%, в шпинаті – 2,9%, в цвітній капусті – 2,5%, в картоплі – 2,0%, томатах – 0,6%. Ще менше білків у більшості плодів, хоча деякі плоди містять білків не менше, ніж в овочі. Так, в маслині міститься в середньому 7% білків, ожині – 2%, бананах – 1,5%.
Картопля, незважаючи на невисокий вміст білку, як джерело азотистих речовин має більш суттєве значення через значне її споживання, яке в середньому складає 330 г в день, таким чином з даним видом продукту задовольняється 6...8% загальної добової потреби людини в білку. Кількість білкового азоту в бульбах картоплі в 1,5...2,5 рази більше, ніж небілкового, тоді як в овочах і плодах, навпаки – менше 50% (наприклад, в капусті 40%, винограді 7%). Небілковий азот картоплі представлений амінним і нітратним азотом с аміаком, які від загального азоту в бульбах складають18...31 і 10...15% відповідно. Сорти картоплі в більшій мірі відрізняються вмістом небілкового азоту, ніж білкового, і перш за все за кількістю вільних амінокислот. Середи них переважають аланін, лізин, гістидин, глутамінова кислота і фенілаланін.
Білки картоплі є біологічно цінними, так як містять всі незамінні амінокислоти. Білок туберин містить усі амінокислоти, у тому числі і незамінні. Туберин за вмістом незамінних амінокислот, за виключення триптофану, перевершує білок пшениці, наближаючись за складом до білку сої і яєчного білку. В порівнянні з білком курячого яйця біологічна цінність білків картоплі складає 85%, а в порівнянні з ідеальним білком – 70%. Першими лімітуючими амінокислотами білків картоплі є метіонін і цистеїн, другою – лейцин. Усі білки картоплі можуть бути розділені на 2 основних фракції: глобуліни (солерозчинні) і водорозчинний альбуміни, в співвідношенні 7:3.
Серед овочевих культур великим вмістом білку відрізняються зелений горошок (28,3...31,9%) і цукрова кукурудза (10,4...14,9% в перерахунку на суху масу). Основну частку білків зеленого горошку складають глобуліни (віцилін і легулін), кукурудзи – спирторозчинний зеїн. Крім того, білки зеленого горошку вирізняються високим вмістом альбуміну, який в 2...3 рази вищий, ніж в зрілому горосі гладкозернових сортів. У молочно-восковій стадії стиглості білки горошку містять в 2,5...3 рази менше глютелінів, ніж за повної стиглості.
В порівнянні із зерновою кукурудзою овочева кукурудза містить значно більше альбуміну, глобуліну і менше розчинних білків. Вміст зеїну складає 21,1...37,2% від загального білку, що значно менше, ніж в кукурудзі інших ботанічних груп (41...58%). Щодо амінокислотного складу , то значну частку амінокислот горошку складає лейцин з ізолейцином (15,4% від загальної кількості), фенілаланін (7,1%), валін з метіоніном (5,2%), аргінін (10,5%) і треонін (5,2%). Для білків цукрової кукурудзи характерний високий вміст лейцину і ізолейцину – 15,1%, аргініну – 12,4%, глутамінової кислоти – 17,3%, аланіну, гліцину, серину – 9,0%, гістидину – 4,2%, лізину – 1,1%. Високий вміст в зеленому горошку і цукровій кукурудзі лізину і аргініну пояснюється підвищеною кількістю альбуміну, а в кукурудзі – зниженим вмістом неповноцінного зеїну.
За різних температурних обробок білки обох культур поводяться по-різному. Нагрівання зеленого горошку впродовж 1 хв. у воді за 98...100˚C зменшує розчинність глобулінів на 80%, альбумінів – на 24% і збільшує кількість лугорозчинної фракції (на 61%). Заморожування за температури 30...196˚С істотно не впливає на розчинність і компонентний склад білків.
Азотисті речовини овочів, фруктів і ягід мають суттєве значення для формування споживчих і органолептичних властивостей цих продуктів (смаку, аромату, кольору і консистенції), стійкості їх під час зберігання і збереженні вітамінів. Так, вільні амінокислоти беруть участь в реакціях, пов’язаних з утворенням аромату (реакції Майяра); нітрати, навпаки, в надмірній кількості погіршують стійкість під час зберігання, а дія, наприклад, пектолітичних ферментів в кінці дозрівання плодів зумовлює їх розм’якшення. Деякі із азотистих речовин виконують функції протеаз і амілаз. Ферменти у складі азотовмісних речовин овочів, фруктів і ягід утворюють незначну їх частину, проте, їх роль у дозріванні і зберіганні рослинної сировини величезна. Збереження овочів і фруктів в основному залежить від активності ферментів, що беруть участь в диханні.
У бульбах картоплі, насінні японської редиски, коренях турнепсу, зеленому горошку, томатах містяться білки-інгібітори тваринних протеїназ, в першу чергу трипсину і хімотрипсину. За вмістом інгібіторів соковита рослинна сировина займає третє місце після бобових і злакових. Інгібітор хімотрипсину картоплі відноситься до "аргінінового" типу, тобто в ділянці, яка вступає у взаємодію з активним центром ферменту, міститься аргінін. Окрім інгібіторів трипсину і хімотрипсину в картоплі виявлені поліпептиди, що діють як інгібітори карбоксипептидази А і Б.
Білки м'яса
М’ясні продукти є одним з основних джерел повноцінного білку. Вміст білку в них коливається в межах 11...22%. Білки м'язової тканини добре збалансовані за амінокислотним складом, в них немає нестачі незамінних амінокислот. Білки сполучної тканини і хрящів є неповноцінними.
За своїми біологічними властивостями білки м’яса є неоднаковими. Найбільшу цінність мають білки м’язової тканини. Вона є сукупністю м’язових волокон і сполучних оболонок, що кількісно переважають.
Будова м’язової тканини м’яса
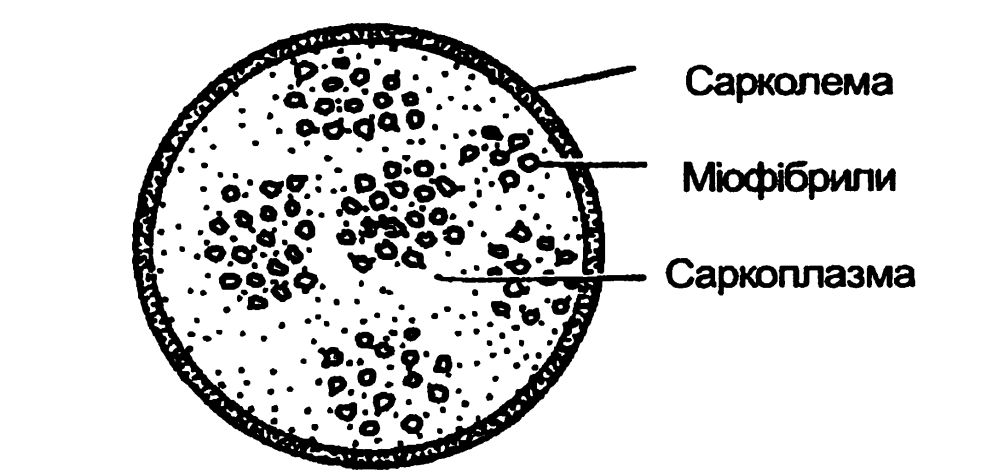
М’язова тканина м’яса складається з м’язових волокон. Довжина їх сягає 10 – 2 см, а товщина – 0,1...0,15 мм. Поверхня м’язового волокна вкрита оболонкою – сарколемою (саркос – м’ясо, лема – шкіра), яка складається з фібрилярного білка колагену і ліпідів (жирів). В середині волокна знаходиться саркоплазма (плазма – рідина). Це розчин мінеральних речовин, водорозчинних білків, вітамінів і інших речовин. Водорозчинні білки саркоплазми – міоген, міоглобін, міоальбумін, глобулін та ін. У рідкій саркоплазмі знаходиться драглеподібні нитки – міофібрили, які складаються з солерозчинних білків міозину, актину, актоміозину (рисунок 4.6).
Рисунок 4.6 – Схема будови м’язового волокна
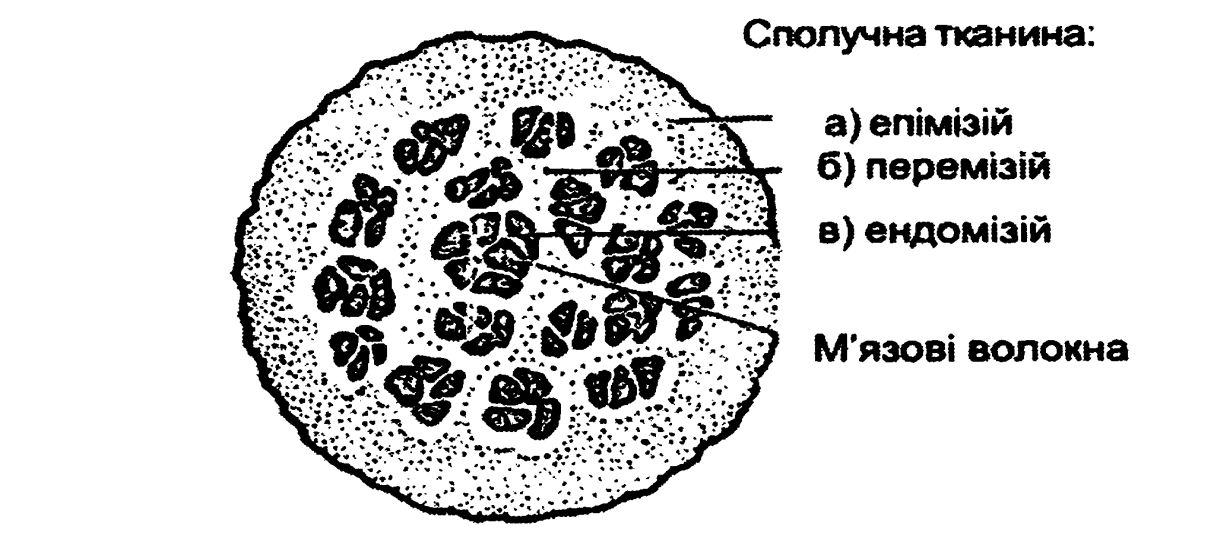
Окремі м’язові волокна з’єднуються в первинні пучки, а декілька первинних пучків з допомогою ніжної сполучної тканини – ендомізію (ендо – внутрішній) з’єднуються у вторинні пучки. Вторинні пучки з допомогою товстішої сполучної тканини – перемізію (проміжний) утворюють м’яз, який зверху покритий ще грубішою сполучною тканиною – епімізієм (зовнішній). Внутрішня сполучна тканина (ендомізій) складається із тонких колагенових волокон. Проміжна сполучна тканина (перемізій) складається із колагенових і еластинових волокон (рисунок 4.7).
Рисунок 4.7 – Будова м’язової тканини
Характеристика білків м’яса
На частку білків в м’язовій тканині припадає приблизно 80% сухого залишку або 16,5...20,9% маси тканини.
Головними м’язовими білками є міозин і актин, функція яких полягає у забезпеченні механізму м’язового скорочення і розслаблення за у часті АТФ.
Міозин за масою складає 55% м’язового білка і представляє собою гексамір, який включає фібрилярну частину (дві переплетені спіралі з молекулярною масою 200 кД, які закінчуються глобулярними "головками"), важкі ланцюги і дві пари легких ланцюгів (молекулярна маса 15...27 кД). Міозин має АТФ-гідролізуюючу активність і здатність зв’язуватись з нерозчинним F-актином.
Актин – на частку цього білку припадає 15% від усіх білків м’язової тканини; існує в 2-х формах – у вигляді глобулярного актину(G-актин – мономірний глобулярний білок з молекулярною масою 43 кД, на частку якого припадає 25% від загальної маси м’язового білку) і фібрилярного актину (F-актин).
Міоглобін – водорозчинний білок, хромопротеїн, простетичною групою в якому є гем, його структура представлена одним поліпептидним ланцюгом, що складається з 153 амінокислотних залишків; вміст міоглобіну в м'язовій тканині приблизно 1% від суми усіх білків тканини.
Міозин і актин відіграють основну роль у фізіологічному акті м’язового скорочення. Функція міоглобіну полягає в передачі кисню, що доставляється гемоглобіном, ферментативним системам клітин.
В м’язових клітинах міститься глобулярний водорозчинний пігментохромопротеїд міоглобін, в якому простетичною групою є гем-циклічний тетрапірол, присутністю якого пояснюється червоний колір цього білку. Вміст міоглобіну в м’язовій тканині становить приблизно 1%. Біологічна функція міоглобіну полягає не в транспортуванні кисню, як у випадку гемоглобіну, а в його запасі. В умовах кисневого голодування (наприклад, за фізичного навантаження) кисень вивільняється із комплексу з міоглобіном і надходить в мітохондрії м’язових клітин, де здійснюється синтез АТФ.
Міоглобін, що не є зв’язаним з киснем, називають дезоксиміоглобіном (Mb), оксигемований Mb називають оксиміоглобіном (МbО2). Колір м’ясопродуктів залежить від вмісту міоглобіну, стану гему і белкової частини макроглобули. Окиснення Fe2+в міоглобіні до Fe3+призводить до зміни кольору пігменту від яскраво-червоного до темно-коричневого, так як метміоглобін (MetMb), що утворюється втрачає здатність зв’язувати молекулярний кисень. Теплова денатурація глобіну також призводить до втрати здатності гемового пігменту зв’язувати кисень і погіршує колір виробів.
Кисень міоглобіну може заміщуватись такими лігандами, як оксид азоту, оксид вуглецю та ін., тому дану властивість білка м’язової тканини м’яса використовують для отримання інтенсивного кольору м’ясопродуктів. Нітрит (NO), що застосовується з цією метою, вступаючи і реакцію з міоглобіном, утворює нітрозоміоглобін, що переходить за нагрівання в стійкий пігмент червоного кольору нітрозоміохромоген.
Міоген складається із комплексу міогенів А, В, С і становить приблизно 20% від усі білкових волокон. Він розчиняється у воді, утворюючи гомогенні розчини з невеликою в’язкістю. Температура денатурації вільного від солей міогену – 55...60ºС. З часом міоген переходить у нерозчинний стан.
До білків сполучної тканини відносяться колаген і еластин – головні фібрілярні білки сполучної тканини.
Колаген є найбільш поширеним з усіх білків, що виявлені у хребетних. У людини 1/3 усіх білків складає колаген. Фібрили колагену складається з трьох навитих один на одного поліпептидних ланцюгів, кожен з яких утворює ламану спіраль особливого типу. З колагену формуються волокна, що складають основу сполучної тканини. Міцність таких волокон можна порівняти з міцністю сталевого дроту. Колаген містить близько 35% залишків гліцину і приблизно 11% залишків аланіну – незвично великі кількості цих амінокислот.
Ще характернішою відмітною ознакою колагену є високий вміст проліну і оксипроліну, на частку яких в сумі доводиться 21%.
За часткового гідролізу колаген перетворюється на желатин – розчинну і перетравлювану суміш поліпептидів, що використовується для приготування желе. В ході цього перетворення відбувається гідроліз деяких ковалентних зв’язків колагену.
Еластин – специфічний білок еластичної сполучної тканини. Подібно до колагену, еластин багатий гліцином і аланіном, в той же час він містить велику кількість залишків лізину і мало проліну. Він існує у вигляді мережі поперечно-зв’язаних поліпептидних ланцюгів, завдяки чому має велику пружність.
Якість м’яса значною мірою залежить від вмісту в нім сполучній тканини – чим більше сполучної тканини, тим нижчою є біологічна і харчова цінність. Вміст оксипроліну часто використовують як показник вмісту сполучної тканини, а відношення триптофан : оксипролін – як показник якості м’яса, чим він вищий, тим якість краща.
Нині існують і інші показники якості тваринного білку, засновані на їх біологічних властивостях. Наприклад, коефіцієнт використання білку (КІБ) – процентне відношення засвоєного білку до білку, прийнятого як еталон.
Для підвищення виходу придатного для виробництва напівфабрикатів м’яса, частини яловичої туші з високим вмістом сполучної тканини піддають ферментативному гідролізу. З цією метою найчастіше використовують препарати протеолітичних ферментів, папаїн, що містять, або суміш папаїну з мікробними протеїназами, що дозволяє підвищити вихід придатного для виробництва напівфабрикатів м’яса з 15...17% до 40...43%.
Зміна білків м’яса в ході технологічних процесів
Білки сарколеми є дуже стійкими, і навіть під час довгого нагрівання за температури 120°С структура їх не змінюється. Тому після теплової обробки м’язові волокна зберігаються, і розварене м’ясо можна подрібнити на пучки або окремі м’язові волокна. Білки саркоплазми, які знаходяться в розчиненому стані, денатурують і утворюють щільний гель (студень), оскільки концентрація їх велика. Цей процес починається вже за температури 30...35°С, а за температури 65°С денатурує близько 90% всіх розчинних білків саркоплазми. Однак навіть за нагрівання м’яса до 95...100°С не відбувається повної денатурації білків і деяка частина їх зберігає властивість розчинятися. Білки міофібрил, які мають вигляд гелю, під час нагрівання ущільнюються і від утвореного студня відокремлюється значна частина води разом з розчиненими в ній поживними речовинами. Частина цієї води переходить в простір між волокна, тому діаметр м’язових волокон зменшується, вони стають щільнішими і міцнішими. Під час варіння м’яса і птиці, поки ще продукти не прогрілись, частина водорозчинних білків (міоген) переходить у воду. За подальшого нагрівання вони згортаються і спливають на поверхню бульйону у вигляді піни.
Якщо воду, в якій вариться м’ясо або птиця, посолити перш ніж продукти прогріються, то в розчин перейде більше білків за рахунок глобулінів (солерозчинних) і кількість піни збільшиться. Тому під час варіння м’яса воду солять після того, як м’ясо прогріється. Одночасно із змінами білків м’язової тканини змінюються також білки сполучної тканини. Ендомізій складається з волокон фібрилярного білка – колагену. У всіх частинах туші ендомізій має однакові властивості. Перемізій складається не тільки з волокон колагену, а й з волокон іншого фібрилярного білка – еластину. Перемізій в окремих частинах туші не однаковий і його властивості визначають кулінарне використання частин м’яса. За нагрівання м’яса в процесі кулінарної обробки еластинові волокна змінюються мало. Колагенові волокна за температури близько 60°С зварюються, скорочуються майже на половину своєї початкової довжини. В результаті зварювання колагену шматки м’яса під час смаження або варіння де формуються, м’ясний сік разом з розчиненими білками, екстрактивними речовинами і мінеральними солями виходить в навколишнє середовище. Це призводить до зменшення маси напівфабрикатів. Щоб шматки м’яса, особливо під час смаження, не деформувалися, їх відбивають, роблять надрізи, перетинаючи сполучну тканину. Одночасно проходить набухання колагенових волокон. За подальшого нагрівання розриваються водневі зв’язки між окремими амінокислотними ланцюжками. Нерозчинений колаген перетворюється в більш просту розчинну речовину – глютин. Кулінарна готовність м’ясних виробів зумовлена ступенем розкладу колагену і розм’якшенням тканин. Швидкість розкладу колагену залежить від кількох причин. Чим грубіша сполучна тканина, тим повільніше розкладається колаген. Розклад колагенових волокон супроводжується поглинанням значної кількості вологи. Тому для смаження придатні тільки ті частини туші, в яких перемізій є достатньо ніжним і значна частина колагену встигає перетворитися в глютин за час, коли основна частина вологи ще не випарувалася. У більшості частин м’яса великої рогатої худоби перемізій є настільки міцним, що таке м’ясо є непридатним для смаження і його можна використати тільки для варіння і тушкування. Швидкість переходу колагену в глютин залежить від температури: чим вона вища, тим цей процес відбувається скоріше. Особливо швидко він проходить за температури 100°С. Значно швидше переходить колаген в глютин в присутності кислот. На цьому базується маринування м’яса перед смаженням і застосування кислих соусів для тушіння м’яса. Розчини, в яких є більше 1% желатину, під час охолодження утворюють студні (гелі).
Білки молока
До складу молока входить більше 100 різних компонентів. Деякі з основних компонентів молока (казеїн, лактоза) ні в яких інших природних продуктах не зустрічаються.
Молоко – це гетерогенна система, в якій дисперсної фази є емульговані жирові глобули і колоїдні міцели казеїну, а дисперсним середовищем – розчин білків, лактози, солей і вітамінів. Загальний вміст білку у молоці коливається від 2,9 до 3,5%. Серед них виділяють дві основні групи: казеїни і сироваткові білки (таблиця 4.9). В молоці міститься більше 20 ферментів, а також гормони і білки у складі оболонок жирових кульок.
Основними білками молока є казеїн і сироваткові білки: α-лактоальбумін, β-лактоглобулін, імуноглобуліни.
Вміст α-лактоальбуміну складає 0,1%. Молекулярна маса 36 кД. α-Лактальбумі необхідний для синтезу лактози в молоці із УДФ-галактози і глюкози.
Інший основний білок молока – β-лактоглобулін. Він має високу термостабільність (витримує нагрівання до 100ºC), стійкий в кислому середовищі шлунку до дії пепсину, тому розщеплюється тільки в кишечнику трипсином і хімотрипсином. У жіночому молоці не міститься.
Імуноглобуліни виконують захисну функцію, лактоферин і лізоцим (фермент) є носіями антибактеріальних властивостей. Лактоферин і β-лактоглобулін виконують транспортну функцію, переносячи в кишечник мікро- і макроелементи, вітаміни і ліпіди.
Казеїн – основний білок молока (2,7%) є фосфопротеїном; він містить велику кількість фосфоросеринових залишків, які утворюються в результаті ферментативного фосфорилювання гідроксильних груп серину. Їх функція полягає у зв’язуванні іонів кальцію.
Таблиця 4.9 – Склад і молекулярні характеристики білкових компонентів молока
|
Компоненти |
Вміст |
Молекулярна маса, кД |
ІЕТ |
|
|
в % від загальних білків |
в г/л |
|||
|
Казеїн: |
78...85 |
... |
|
|
|
αs1-казеїн |
43...54 |
12...15 |
23,0 |
4,4...4,8 |
|
αs2-казеїн |
3...4 |
25,0 |
- |
|
|
β-казеїн |
25...35 |
9...11 |
24,0 |
4,8...5,1 |
|
χ-казеїн |
8...15 |
2...4 |
19,0 |
5,4...5,8 |
|
Білки сироватки |
15...25 |
6...8 |
|
|
|
β-лактоглобулін |
7...12 |
3,6 |
18,3 |
5,1 |
|
α-лактоальбумін |
2...5 |
1,7 |
14,2 |
4,2...4,5 |
|
імуноглобуліни |
1,5...2,5 |
0,6 |
150...1000 |
5,5...8,3 |
|
альбумін сироватки крові |
0,7...1,3 |
0,4 |
69,0 |
4,7...4,9 |
Казеїн є присутнім в молоці у вигляді свого попередника казеїногена (80% білків коров'ячого молока). Містить повний набір незамінних амінокислот, особливо багатий метіоніном, лізином, триптофаном.
Під дією протеолітичних ферментів шлунку в за присутності іонів кальцію казеїноген перетворюється на казеїн, який випадає в осад (ферментативне перетворення молока в сирну масу). Осад казеїну довше затримується в шлунку і повніше засвоюється.
Технологічні перетворення білків молока
В молоці знаходяться основні три білки: казеїн (2,5...3%), лактоальбумін (0,5...1%) і лактоглобулін (0,1%). Найбільше в молоці казеїну, який належить до групи фосфоровмісних білків і має виражений кислотний характер. У молоці він знаходиться у вигляді кальцієвої солі. Всі білки мають вигляд золю. За підвищення кислотності молочна кислота, яка виробляється молочнокислими бактеріями, відокремлює кальцій від солей казеїну, підвищує кислотність молока і утворює драглеподібну масу – гель, який під час кип’ятіння згортається. За подальшого нагрівання він ущільнюється і виділяється вода (одержання сиру). Нагрівання молока призводить до денатурації його білків. Денатурований альбумін зсідається у вигляді пластівців на дні посуду. Цей процес починається за 60°С. Протягом 30 хв. за даної температури осідає близько 1% альбуміну, а за годину – до 5%. За швидкого нагрівання молока початок випадання пластівців починається за 75°С. Денатурація казеїну проявляється у появі плівки на поверхні молока і починається вже за температури 40...50°С.
Білки яєць
Яйця різних птахів за своїм хімічним складом відрізняються не дуже і містять значну кількість повноцінного білка, збалансованого за амінокислотним складом (таблиця 4.10).
Білок яйця – це концентрований колоїдний розчин протеїну у воді. Зовнішній (підшкарлуповий шар білку є рідким, середній – щільний і внутрішній – рідкий. Яєчний білок добре розчиняється у воді з утворенням в’язкої рідини. Під час збивання водного розчину білка утворюється стійка піна. В таблиці 4.11 наведені основні протеїни яєчного білка.
Головним компонентом яєчного білка є яєчний альбумін – овоальбумін. Він є повноцінним білком, який у звареному стані засвоюється на 97,6%. Це глікофосфопротеїн (2% манози і 1,2% глюкози). Овальбумін містить чотири тіольні і одну дисульфідну групу. Під час зберігання яєць з нативного білка (температура коагуляції 84,5ºС) формується більш термостабільний S-овоальбумін (температура коагуляції 92,5ºС). Вміст S-овоальбуміну збільшується від 5% в свіжих яйцях до 81% в яйцях, які зберігалися протягом шести місяців на холоді. У розчинах овоальбумін є нестійким до механічних впливів. В результаті струшування швидко денатурує і коагулює, це міжфазова коагуляція, яка відбувається через розкриття і агрегацію молекул білку.
Таблиця 4.10 – Амінокислотний склад яйця (в % від загального вмісту білку)
|
Амінокислота |
Яйце (в цілому) |
Білок |
Жовток |
|
Аланін |
0,71 |
0,65 |
0,82 |
|
Аргінін |
0,84 |
0,63 |
1,13 |
|
Аспарагинова кислота |
1,2 |
0,85 |
1,37 |
|
Валін |
0,95 |
0,84 |
1,12 |
|
Гістидин |
0,31 |
0,23 |
037 |
|
Гліцин |
0,45 |
0,40 |
0,57 |
|
Глутамінова кислота |
1,58 |
1,52 |
1,95 |
|
Ізолейцин |
0,85 |
0,70 |
1,00 |
|
Лейцин |
1,13 |
0,95 |
1,37 |
|
Лізин |
0,68 |
0,65 |
1,07 |
|
Метіонін |
0,40 |
0,42 |
0,42 |
|
Пролін |
0,54 |
0,41 |
0,72 |
|
Серин |
0,92 |
0,75 |
1,31 |
|
Теонін |
0,51 |
0,48 |
0,83 |
|
Тирозин |
0,55 |
0,45 |
0,76 |
|
Триптофан |
0,21 |
0,16 |
0,24 |
|
Цистеїн |
0,30 |
0,26 |
0,27 |
|
Фенілаланін |
0,75 |
0,69 |
0,72 |
Таблиця 4.11 – Основні протеїни курячого яйця
|
Білок |
% від загальної кількості білку |
|
Овоальбумін |
54 |
|
Кональбумін |
12 |
|
Овомукоїд |
11 |
|
Овомуцин |
3,5 |
|
Лізоцим (овоглобулін G1) |
3,4 |
|
Овоглобулін G2 |
4 |
|
Овоглобулін G3 |
4 |
|
Флавопротеїн |
0,8 |
|
Овоглікопротеїн |
1,0 |
|
Овомакроглобулін |
0,5 |
|
Овоінгібітор |
1,5 |
|
Авідін |
0,05 |
|
Цістатин |
0,05 |
Овомукоїд – білок яйця, що за хімічним складом є глікопротеїдом, чутливий до тепла. Він містить різні вуглеводи: галактозу – 1...1,5%; манозу – 4,3...4,7%; глюкозу – 12,5...15,4%. У кислому середовищі овомукоїд проявляє високу стійкість до теплового впливу, а в лужному середовищі (рН = 9,0) швидко денатурує за 80ºС.
Лізоцим є широко розповсюдженим білком і зустрічається не тільки в білках яйця, але в багатьох тканинах тварин, латексі, ексудатах різних рослин і в деяких грибах. Лізоцим є ферментом яєчного білку, який має бактерицидні властивості і здатний розчиняти оболонки бактеріальних клітин. Інактивація ферменту залежить від рН середовища і температури. Під час теплової обробки за температури 63ºС протягом 10 хв. лізоцим інактивується. Цей білок є гарним піноутворювачем.
Овомуцин – білок яйця, що за хімічним складом є глікопротеїдом з вмістом вуглеводів приблизно 20%. В розчині він є дуже стійким до тепла. Комплекс лізоциму і овомуцину під час зберігання яєць сприяє розрідженню білка за рН = 9,0. Активність лізоциму зменшується на 20% через 45 днів зберігання за температури ±2ºС в результаті утворення в розчині комплексу овомуцин-лізоцим.
Авідін є глікопротеїдом, який містить приблизно 10% вуглеводів. Його амінокислотна послідовність збігається з послідовністю лізоциму на 12%. Авідін здатний утворювати біологічно неактивний комплекс х біотином. Авідин курячого яйця виконує антибактеріальну роль.
Цистатин курячого яйця є інгібітором і пригнічує ендопептидази цистеїну (фіцин, папаїн)
Під час зберігання яєць протягом певного часу у білках виявляють продукти їх ферментативного розпаду. У незапліднених яйцях з’являються вільні амінокислоти, пурини, молочна і лимонна кислоти та ін.
Сирий білок містить значну кількість ферментів, що мають антитрипсинову дію. Тому сирий білок гірше перетравлюється (82%). В результаті інактивації цих ферментів засвоюваність білків значно зростає. Оптимальна засвоюваність(96...98%) яєчних білків досягається під час нагрівання їх до 70ºС.
Кількість білку у жовтку є не такою великою (18%), але жовток включає більш повноцінний білок. Температура денатурації білків жовтка 65ºС.
Білкові речовини в жовтку представлені переважно ліпопротеїдами, які містять від 17% до 38% зв’язаних ліпідів. Приблизно 70% від загальної кількості білка припадає на ліповітеліни; 24% – на ліветин; 9% - на фосвітин.
Ліповітелін є повноцінним білком, який містить найсприятливіше для людини співвідношення незамінних амінокислот, тому добре засвоюється організмом. Крім того ліповітелін має оптимальну кількість органічного фосфору. Він представлений α- і β-ліповітелінами. Ліпідна частина цих білків складається з фосфоліпідів.
Ліветин і фосвітин є ліпопротеїдами низької щільності, вміст ліпідів у яких складає 80...89%. Приблизно 70...77% ліпідної частини становлять нейтральні жири і 26% – фосфоліпіди.
Ліветин – це білкова фракція з добре розчинних у воді білків. Вони є повноцінними й містять значно менше фосфору в порівнянні з ліповітеліном.
Фосвітин є білком, о багатий на фосфор, він містить також і Ферум. Це є повноцінний білок, який розчиняється в розчинах солей помірної концентрації.
Жовток містить значно менше ферментів у порівнянні з білком яйця. Яєчний жовток, у випадку його вживання, стимулює секреторну діяльність шлунку і добре перетравлюється.
Технологічні перетворення білків яйця
Фосфоропротеїни жовтка – вітелін, лівотин і фосвітин – містять різну кількість фосфору і є добрими емульгаторами, що дозволяє використовувати їх під час виготовлення майонезу. Яйця містять також білки, які є антиферментами і гальмують харчове травлення. Під час теплової обробки антиферменти руйнуються й яйця засвоюються краще. І білок і жовток – концентровані золі. Під час нагрівання білки яєць денатурують, а потім зсідаються. Зсідання яєчного білка починається за температури 50...55°С. Спочатку з’являється поступове помутніння, за 65°С білок густішає і за 75°С перетворюється в непрозору білу драглеподібну масу ніжної консистенції. За температури 80°С утворюється гель, що зберігає форму, за подальшого нагрівання він стає все більш щільним. Жовток починає густішати за вищої температури (70°С). Ціле розмішане яйце густішає за тієї самої температури, що і жовток. Для деяких кулінарних виробів (омлетів) яйце розводять водою або молоком. Розведене яйце дає під час зсідання гель більш ніжної консистенції, ніж натуральне. Додавання цукру до яєць підвищує температуру зсідання.
Білки риби
Білки м’язової тканини риб мало чим відрізняються від білків м’яса теплокровних тварин. Так само, як і білки м’яса тварин, вони складаються з нерозчинних глобулінів (іхтулін риб – аналог міозину – білка м’яса тварин), розчинних у воді альбумінів та деякої кількості складних фосфоровмісних білків – нуклеопротеїдів. У саркоплазмі міститься 20...30% загального білка м’язової тканини. У скорочувальному апараті 65...75% білку, в сполучній тканині кісткових риб – 3%, а у хрящових, таких як акули і скати – до 10%.
Сполучнотканинні білки зовсім не містять еластину і складаються в основному з колагену, який швидко перетворюється під час нагрівання за температури 45ºС в глютин, желатин. Перетворення колагену в глютин супроводжується різким зниженням міцності тканин, в результаті чого риба, що була піддана тепловій обробці, легко розжовується. У м’язовій тканини риб кількість сполучної тканини становить 0,6...3,5%, з чого можна зробити висновок, що м’ясо риб містить приблизно в 5 разів менше сполучної тканини, ніж м’ясо теплокровних тварин. Ці два фактори роблять рибне м’ясо більш ніжним, ніж м’ясо ссавців.
Пігменти зосереджені в темних м’язах. Наприклад, в темних м’язах скумбрії міститься 3,9 г/кг міоглобіну, 5,8 г/кг гемоглобіну і 0,13 г/кг цитохрому С. Світлі м’язи містять тільки міоглобін і гемоглобін в кількості приблизно 0,1 г/кг.
Білки риби містять всі незамінні амінокислоти в добре збалансованих відношеннях. Амінокислотний склад білків риби відрізняється від амінокислотного складу білків м’яса. Так, у білок м’яса риби містить більше лізину, аланіну, цистеїну і аспаргінової кислоти, решта замінних і незамінних амінокислот у ньому міститься менше, ніж у білку м’яса тварин.
Високий вміст таких кислот як лізин і аргінін, які є ростовими факторами, дозволяє віднести рибу до продуктів, які є абсолютно необхідними в дитячому харчуванні. До переваг білків риби можна віднести високий вміст в них метіоніну і цистеїну, кількість яких сумарно перевищує їх вміст у такому визнаному джерелі цистеїну і метіоніну як сир. Тому м’ясо риби відносять до продуктів, які мають виражені ліпотропні властивості. Ліпотропними називаються речовини, які попереджають ожиріння печінки та приймають участь у нормалізації жирового і пов’язаного з ним холестеринового обміну.
В основі будови м’язової тканини риби також лежать м’язові волокна. Окремі волокна з’єднуються перемізієм у зигзагоподібні міокоми. Міокоми за допомогою горизонтальних і вертикальних прошарків (септ) утворюють тіло риби. Септи – це прошарки сполучної тканини між окремими м’язами (рисунок 4.8).
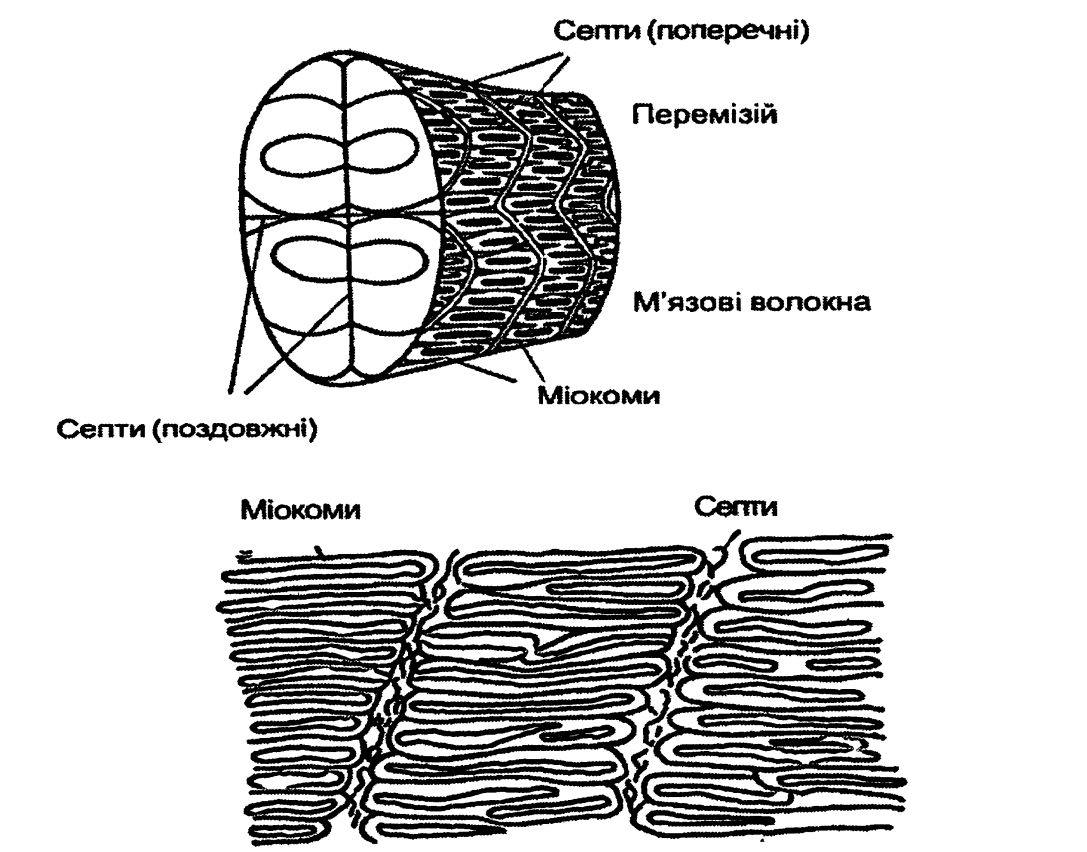
Рисунок 4.8 – Будова тканини риби.
Будову м’язової тканини добре видно у звареної риби, в якої після розм’якшення сполучної тканини добре розділяються міокоми. В м’язових волокнах тканини риб немає білка міоглобіну. Більшість білків риби повноцінні і легко засвоюються організмом. Білки м’язової тканини риби змінюються так само, як білки м’яса, але процес згортання білків риби закінчується за температури 75°С. Сполучна тканина риби майже повністю складається із колагену і не має еластину.
Зварювання колагенових волокон шкіри риби викликає деформацію шматків під час теплової обробки. Тому під час виготовлення рибних напівфабрикатів шкіру в декількох місцях перерізають. Зварювання колагенових волокон риби відбувається за нижчої температури (40°С), ніж у м’яса.
Зміна ваги м’яса і риби під час теплової обробки
Денатурація білків призводить до зміни їх колоїдного стану – згортання. Білки переходять у розчин, згортаються й утворюють піну. Під час варіння м’яса і риби ущільнюється білковий гель міофібрил, що призводить до зменшення ваги і об’єму продукту. Кількість води, яка виділяється м’ясом і рибою, залежить від ряду причин: величини шматків, умов нагрівання та ін. Із м’яса і риби переходять в навколишнє середовище разом з водою розчинені білки, мінеральні солі, екстрактивні речовини. Виділення води під час згортання білків м’яса проходить більш інтенсивно за 45...75°С, але продовжується до 100°С. У риб цей процес закінчується за 75°С. Зменшення ваги продукту зумовлюється також витопленням із нього жиру.
Екстрактивні речовини м’яса і риби зумовлюють смак і сокогінну дію бульйонів, тому важливим є режим варіння, за якого найбільша кількість цих речовин переходить в розчин. Є два основні прийоми варіння м’яса для одержання бульйонів і для других відварних страв. Для бульйону м’ясо заливають холодною водою, нагрівають до кипіння і варять за слабкого кипіння. В цьому випадку в розчин переходить більше екстрактивних речовин. Для других страв м’ясо закладають у гарячу воду, доводять до кипіння і варять за температури 85...90°С. В такому випадку білки утримують більше вологи, менше екстрактивних речовин і білків переходить у розчин. М’ясо стає більш ніжним, соковитим, смачним. Втрати сухих речовин м’яса в середньому становлять 1,5...3% від ваги м’яса. Кількість речовин, що переходить у розчин, залежить від величини шматків, виду м’яса, частин туші. Під час смаження втрачається значно менше поживних речовин, ніж під час варіння, оскільки частина води випаровується з поверхні, а розчинені в ній речовини залишаються і частина з них переходить у м’ясний сік. Вироби, поміщені для смаження в добре розігрітий жир, втрачають менше поживних речовин, менше з них виходить соку і вони стають більш соковитими.