Тема 8 Електрохімічні процеси
План
8.1 Суть процесу електролізу. Закони М. Фарадея
8.2 Електроліз розплавів та водних розчинів електролітів. Практичне значення електролізу
8.1 Суть процесу електролізу. Закони М.Фарадея
Електролізом називається окисювально-відновний процес, який відбувається на електродах під час пропускання постійного електричного струму через розплав або розчин електроліту.
Хімічні реакції на електродах здійснюються за рахунок електричної енергії. На катоді відбувається процес приєднання електронів (відновлення). На анноді – процес окиснення (рисунок 8.1).
На відміну від гальванічного елемента при електролізі катод – негативно заряджений електрод, а анод – позитивно.
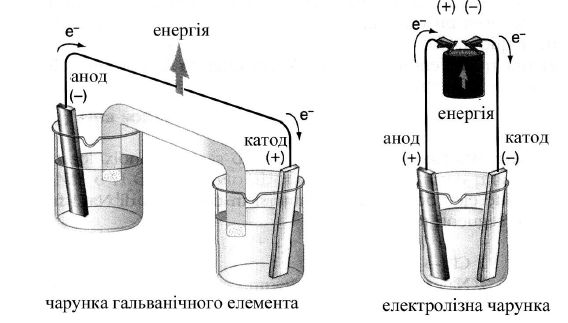
Рисунок 8.1 – Принципова відмінність між електролізом та гальванічним елементом
Окиснювально-відновна дія електричного струму сильніша дії хімічних окисників та відновників.
На характер і хід електродних процесів при електролізі впливають ;
- склад електроліту;
- природа розчинника;
- матеріал електродів;
- режим електролізу (напруга, густина струму, температура та ін.).
Між кількістю речовини, що виділяється під час електролізу, і кількістю електричного струму, що проходить через електроліт, існує зв'язок, який відображається в двох законах М. Фарадея:
І закон: Маси речовин, які виділяються на електродах під час електролізу, прямо пропорційні кількості електрики, яка пройшла через розплав або розчин електроліту.
![]() , (8.1)
, (8.1)
де Є – коефіцієнт пропорційності, названий електрохімічним еквівалентом. Його фізичний зміст такий: Є – це маса речовини, що виділилась на катоді або аноді при проходженні 1 Кл електрики. Q – це кількість електрики, що дорівнює добуткові сили струму на час: ![]() . Q виражається в Кл, якщо сила струму І в амперах (A), а час в секундах, (с), або в А/год.
. Q виражається в Кл, якщо сила струму І в амперах (A), а час в секундах, (с), або в А/год.
![]() , (8.2)
, (8.2)
де Е – еквівалентна маса речовини; F- число Фарадея 96500 Кл/моль, або 26,8 А·год/моль.
ІІ закон: Під час електролізу однакові кількості електрики виділяють на електродах еквівалентні маси різних речовин (рис. 8.2):
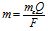 , або
, або 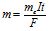 , (8.3)
, (8.3)
де m – маса речовини (г), що утворилась на катоді або на аноді; me – еквівалентна маса речовини, Q – кількість електрики (Кл), яка пройшла через електроліт; І –сила струму (А), t – час (с).
Під час проходження однієї й тієї ж кількості електрики через ряд електролітів, маси речовин, відновлених на катоді або окиснених на аноді, пропорційні їх хімічним еквівалентам (рисунок 8.2), а константа Фарадея F дорівнює добуткові числа Авогадро на заряд електрону:
![]() .
.
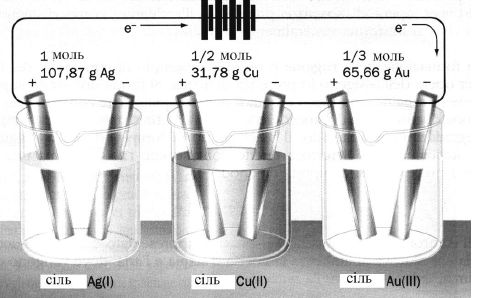
Рисунок 8.2 – Електрохімічний еквівалент речовин
На практиці під час проведення електролізу дійсні затрати струму Іпр, внаслідок побічних процесів (взаємодія утворених речовин з електродом або електролітом та ін.), звичайно перевищують теоретичне значення Ітеор, розраховане за законом Фарадея. Відношення маси речовини, одержаної практично (тпр) до теоретично розрахованої (ттеор), називається виходом за струмом (η):
![]() , або
, або ![]() (8.4)
(8.4)
8.2 Електроліз розплавів та водних розчинів електролітів. Практичне значення електролізу
Розглянемо електроліз водного розчину натрій хлориду за наявності вугільних електродів.
В цьому розчині знаходяться йони Na![]() і Cl
і Cl![]() у вигляді гідратованих йонів, а також вільні молекули води. Якщо система, в якій проводять електроліз, містить різні окисники (в даному випадку Na
у вигляді гідратованих йонів, а також вільні молекули води. Якщо система, в якій проводять електроліз, містить різні окисники (в даному випадку Na![]() і Н2О), то на катоді буде відновлюватися найбільш активний із них, або – окиснена форма тієї електрохімічної системи, якій відповідає найбільше значення електродного потенціалу (за алгебраїчною величиною).
і Н2О), то на катоді буде відновлюватися найбільш активний із них, або – окиснена форма тієї електрохімічної системи, якій відповідає найбільше значення електродного потенціалу (за алгебраїчною величиною).
Порівняємо потенціали двох окиснених форм :
Na + 1![]() → Na
→ Na![]() ;
; ![]() = -2,71 В
= -2,71 В
2H2O + 2![]() → H2 + 2OH
→ H2 + 2OH![]() ;
; ![]() = -0,81 В.
= -0,81 В.
Отже, -0,81 В>-2,71 В. Це означає. що на катоді будуть розряджатися молекули води, а не йони натрію
2H2O + 2![]() → H2 + 2OH
→ H2 + 2OH![]() .
.
Аналогічно, за наявності в системі декількох відновників, на аноді буде окиснюватися найбільш активна із них, або – відновлена форма тієї електрохімічної системи, яка характеризується найменшим значенням електродного потенціалу. Наприклад:
2Cl![]() → Cl2 + 2
→ Cl2 + 2![]()
![]() = +1,36 В
= +1,36 В
2H2O → O2 + 4H![]() + 4
+ 4![]()
![]() = +1,23 В.
= +1,23 В.
Отже, під час електролізу водних розчинів хлоридів можливий перебіг двох процесів на інертному аноді, так як вони мають близькі значення ![]() . Однак, в даному відбувається перший процес: 2Cl
. Однак, в даному відбувається перший процес: 2Cl![]() → Cl2 + 2
→ Cl2 + 2![]() , не дивлячись на те, що
, не дивлячись на те, що ![]() >
>![]() , так як це зумовлено гальмівною дією матеріалу анода на другий процес. Таким чином, на катоді виділяється водень, а на аноді - хлор, а в катодному просторі накопичується NaOH. Склавши рівняння двох електродних процесів, одержують загальне рівняння процесу електролізу водного розчину NaCl:
, так як це зумовлено гальмівною дією матеріалу анода на другий процес. Таким чином, на катоді виділяється водень, а на аноді - хлор, а в катодному просторі накопичується NaOH. Склавши рівняння двох електродних процесів, одержують загальне рівняння процесу електролізу водного розчину NaCl:
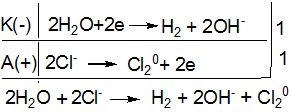
або в молекулярній формі:
2NaCl + 2H2O ![]() H2 + Cl2 + 2NaOH.
H2 + Cl2 + 2NaOH.
Розряд катіонів. Чим менша алгебраїчна величина стандартного електродного потенціалу, тим важче відновити йони на катоді. Можливі три випадки:
1. катіони металів від Li![]() до Al
до Al![]() включно у водному розчині не відновлюються (відновлюються молекули води);
включно у водному розчині не відновлюються (відновлюються молекули води);
2. катіони металів від Mn![]() до Pb
до Pb![]() відновлюються на катоді одночасно з молекулами води (питання дискусійне);
відновлюються на катоді одночасно з молекулами води (питання дискусійне);
3. катіони металів від Cu![]() до Au
до Au![]() практично повністю відновлюються на катоді.
практично повністю відновлюються на катоді.
Якщо в розчині буде суміш катіонів Ag![]() , Cu
, Cu![]() , Fe
, Fe![]() то, порівнявши їхні електродні потенціали:
то, порівнявши їхні електродні потенціали:
Ag![]() + 1
+ 1![]() → Ag;
→ Ag; ![]() = 0,8 В
= 0,8 В
Cu![]() + 2
+ 2![]() → Cu;
→ Cu; ![]() = 0,34 В
= 0,34 В
Fe![]() + 2
+ 2![]() → Fe;
→ Fe; ![]() = -0,44 В
= -0,44 В
робимо висновок про те, що першими будуть відновлюватися йони Ag![]() , потім Cu
, потім Cu![]() і нарешті, Fe
і нарешті, Fe![]() .
.
Характер реакцій, які відбуваються на аноді, залежить як від наявності молекул води, так і від природи анода. Розрізняють розчинні і нерозчинні аноди.
Нерозчинні аноди виготовлюють із вугілля, графіту, платини, при цьому електрони надсилаються в зовнішній ланцюг в результаті окиснення аніонів і молекул води. Аніони безкисневих кислот (при достатній концентрації) легко окиснюються, тоді як аніони кисневмісних кислот SO![]() , NO
, NO![]() , CO
, CO![]() , PO
, PO![]() та ін. не окислюються, а окиснюються молекули води. Наприклад, в нейтральному середовищі :
та ін. не окислюються, а окиснюються молекули води. Наприклад, в нейтральному середовищі :
2H2O → O2 + 4H![]() + 4
+ 4![]() ;
;
а в лужному:
4ОН- → 2Н2О + O2 + 4![]()
У випадку розчинного анода електрони в зовнішній ланцюг посилає сам анод (виготовляють із Cu, Ag, Zn, Co, Ni, Fe та ін.). Розчинні аноди використовуються у випадку очищення металів (рафінування міді), або нанесенні гальванічного покриття, наприклад для посріблення виробів (рисунок 8.3).
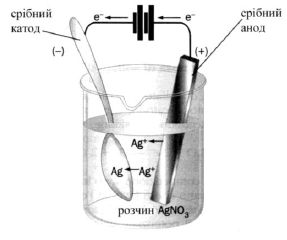
Рисунок 8.3 – Схема електролізу з розчинним анодом
Приклад І. Які процеси будуть відбуватися на електродах під час електролізу водного розчину CuCl2 з інертними вугільними електродами.
Рішення.
У водному розчині CuCl2 дисоціює на йони:
CuCl2 → Cu2+ + 2Cl-
Значення стандартного електродного потенціалу мідного електроду позитивне (+ 0,34 В), отже, йони Купруму будуть легко відновлюватись у водних розчинах. Йони Cl-, як і більшість аніонів безоксигенових кислот, у водних розчинах окиснюються:
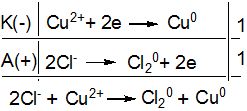
або у молекулярному вигляді:
CuCl2 ![]() Cu0 + Cl20
Cu0 + Cl20
Приклад 2. Які процеси будуть відбуватися на електродах під час електролізу водного розчину CuSO4 з мідним анодом.
Рішення.
У водному розчині CuSO4 дисоціює на йони:
CuSO4 → Cu2+ + SO![]() .
.
На катоді буде відбуватися відновлення катіонів Cu2+. А анодний процес, у випадку із мідним електродом, буде пов’язаний із окисненням матеріалу електрода (на цьому ґрунтується метод рафінування міді), кількість солі в розчині залишається незмінною. Електродні процеси можна зобразити так:
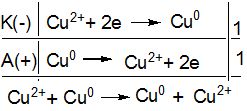
Приклад 3. Які процеси будуть відбуватися на електродах під час електролізу водного розчину сульфату цинку з інертними електродами.
Рішення.
У водному розчині ZnSO4 будуть міститися такі йони:
ZnSO4 → Zn2+ + SO![]()
Під час електролізу поблизу катода будуть знаходитись катіони Zn2+ і вода. Так як стандартний електродний потенціал цинкового електроду дорівнює –0,76 В, то на катоді будуть відбуватися паралельно два процеси: відновлення катіонів Zn![]() і води. Йони SO
і води. Йони SO![]() будуть накопичуватись біля анода, але окиснюватись не будуть, замість них окиснюється вода, в результаті чого виділяється кисень:
будуть накопичуватись біля анода, але окиснюватись не будуть, замість них окиснюється вода, в результаті чого виділяється кисень:
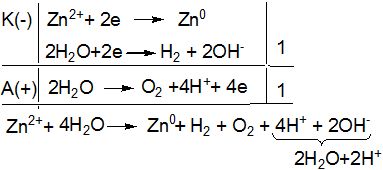
після скорочень:
Zn2+ + 2Н2O → Zn0 + Н2 + О2 + 2Н+
або у молекулярному вигляді:
ZnSO4 + 2H2O ![]() Zn0 + Н2 + O2 + H2SO4
Zn0 + Н2 + O2 + H2SO4
Приклад 4. Які процеси будуть відбуватися на електродах під час електролізу водного розчину сульфату калію з інертними електродами.
Рішення.
У водному розчині K2SO4 дисоціює на йони:
K2SO4 → 2K+ + SO![]()
Так як катіони лужних металів не відновлюються у водних розчинах, то процес електролізу буде зводитись до катодного відновлення і анодного окиснення молекул води:
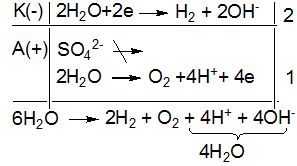
У навколо катодному просторі утворюється КОН, а біля анода H2SO4, але якщо катодний і анодний простори не розділені діафрагмою, то:
Н![]() + ОН
+ ОН![]() → H2O
→ H2O
Приклад 5. Які процеси будуть відбуватися на електродах під час електролізу розплаву NаСІ з нерозчинним анодом.
Рішення.
В розплаві NаСІ дисоціює на йони:
NаСІ → 2Na+ + 2Cl- .
Катіони під дією електричного струму будуть рухатись до катода і приймати від нього електрони (відновлюватись). На аноді буде відбуватися процес окиснення хлорид-йонів:
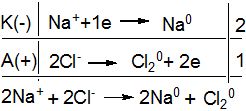
Якщо ж використати розчинний анод, наприклад, мідний, то в розплаві може відбуватися анодне розчинення металу.
Електроліз має велике технічне значення. За його допомогою одержують багато цінних продуктів: активні метали (електролізом розплавів), їдкий натр, хлор, кисень, водень, металічні покриття та ін.