Тема 9 Комплексні сполуки
План
9.1 Координаційна теорія А.Вернера. Класифікація комплексів і лігандів
9.2 Номенклатура комплексних сполук та їх основні типи. Рівновага в розчинах
9.3 Сучасні теорії комплексних сполук та їх практичне значення
9.1 Координаційна теорія А.Вернера. Класифікація комплексів і лігандів
Існують сполуки, склад яких виражається не зовсім звичайними формулами, наприклад, K4[Fe(CN)6], [Ag(NH3)2]Cl, де є комплексний катіон або аніон. Для них характерний ряд своєрідних властивостей, тому їх виділяють в особливий клас і називають координаційними (комплексними) сполуками. Засновником уявлень про КС вважається А. Вернер (1893 р. Швейцарія). Великий вклад в розвиток теорії КС внесли роботи Л.С. Чугаева, І.І. Черняєва, О.О. Грінберга, В.В. Лебединського та ін. Суть координаційної теорії зводиться до таких висновків:
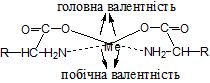
1) більшість елементів проявляють два види валентності: головну, яка збігається зі ступенем окиснення, та побічну – донорно-акцепторну;
2) при насиченні елементом головної та побічної валентності, утворюється координаційна сфера або комплекс – стійка група атомів, в основі якої знаходиться центральний атом або йон (ЦА) – найчастіше це атоми-акцептори електронів: наприклад, катіони з s2р6d1-10 оболонками, а також атоми неметалів, зрідка – атоми-донори електронів, наприклад, Нітроген, Оксиген, атоми галогенів. Наприклад:
FeSO4 + 2КCN → Fe(CN)2 + 2КСІ (головна валентність)
4KCN + Fe (CN)2 → [K4Fe(CN)6] (побічна валентність);
3) навколо ЦА можуть координуватися донори електронів – аніони, нейтральні молекули, наприклад, Н2О, NH3, CO, а біля ЦА активного неметалу з негативним ступенем окиснення – йони гідроксонію та деяких металів. Частинки, які координуються навколо ЦА, називаються лігандами, а число місць, яке займає ліганд, називається дентантністю (моно-, бі-, три-, полідентатні);
4) число, яке показує, скільки монодентатних лігандів може приєднатися до ЦА, називається координаційним числом. Воно може мати значення: від 2 до 9 і навіть більше (залежить від ступеня окиснення елемента та співвідношення між радіусами ЦА і ліганда);
5) комплексоутворювач і ліганди складають внутрішню сферу, а йони, які безпосередньо не зв'язані з комплексоутворювачем, складають зовнішню сферу, наприклад:
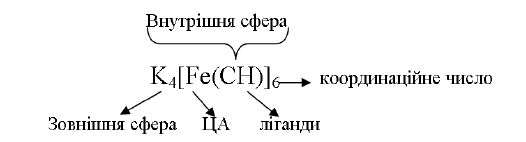
Таким чином, координаційними або комплексними називаються такі сполуки, що містять у своєму складі одну або більше координаційних сфер (комплексів). Вони здатні до існування як в кристалічному, так і в розчиненому стані.
Заряд координаційної сфери (комплексу) визначається алгебраїчною сумою ступенів окиснення ЦА та всіх лігандів.
Класифікація комплексів. За характером електричного заряду розрізняють:
– катіонні комплекси ([Cu(NH3)4]2+, [А1(Н20)6]3+);. Найчастіше утворюються за рахунок координації навколо позитивних йонів нейтральних молекул (NH3, H2O та ін.), наприклад:
[Zn(NH3)4]Cl2 — тетраамінцинк (ІІ) дихлорид;
[A1(H2O)6]C13 — гексаакваалюміній(ІІІ) трихлорид.
–аніоні комплекси ([Fe(CN)6]4-, [Al(OH)4]![]() ) – це комплекси, яких у ролі комплексоутворювача виступають позитивні йони, а лігандами є аніони. До латинських назв комплексоутворювача додають закінчення -am, наприклад:
) – це комплекси, яких у ролі комплексоутворювача виступають позитивні йони, а лігандами є аніони. До латинських назв комплексоутворювача додають закінчення -am, наприклад:
K4[Fe(CN)6] – тетракалій гексаціаноферат(ІІ);
К3[Fe(CN)6] – трикалій гексаціаноферат(ІІІ);
Na[Al(OH)4] – натрій тетрагідроксоалюмінат (III).
Нейтральні комплекси ([Fe(CO)5], [Ni(CO)4]) утворюються в результаті координації навколо нейтрального комплексоутворювача нейтральних лігандів, а також під час одночасної координації навколо позитивного йона-комплексоутворювача негативно заряджених, або нейтральних лігандів. Нейтральні комплекси, таким чином, є комплексними сполуками без зовнішньої сфери. Щоб відобразити електронейтральність комплексів, застосовують українські назви комплексоутворювача без змін, а весь комплекс беруть у квадратні дужки [Co(NH3)3С13]° — кобальт (ІІІ) триамінотрихлорид.
Комплексоутворювачем може бути будь-який елемент періодичної системи. Неметалічні елементи майже завжди дають аніонні комплекси, у яких лігандами є атоми найбільш електронегативних елементів, наприклад: K[PF6], K3[PO4], K[PS4].
У типових елементів-металів здатність до утворення комплексних сполук виражена слабко, оскільки їхні йони характеризуються відносно великими розмірами і малим зарядом. Існуючі нечисленні комплексні сполуки такого типу є похідними малостійких катіонних комплексів, наприклад, [Sr(H2O)6]Cl2; [Ca(NH3)8]Cl2.
Амфотерні елементи можуть утворювати як катіонні та аніонні, так і нейтральні комплекси, наприклад: [Al(Н2О)6]Cl3, [А1(OH)3(Н2O)3], Са3[А1(OН)6]2.
Класифікація лігандів:
– монодентатні: (F![]() , Cl
, Cl![]() , Br
, Br![]() , I
, I![]() , CN
, CN![]() , NH3, Н2О, СО та ін.);
, NH3, Н2О, СО та ін.);
– бідентатні ліганди (CO32-, SO42-, C2O42-, H2NCH2CH2NH2 та ін.), рідше зустрічаються три- (полі-)дентатні ліганди. Комплекси з полідентантними лігандами називаються хелатними (або клішнеподібними, від грец, chelate – клешня). Наприклад, нехелатний (а) і хелатний (б) комплекси Купруму (П):
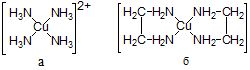
Головною особливістю хелатних комплексів (комплексонів) є те, що ліганди в них приєднуються до комплексоутворювача за рахунок головної і побічної валентності. До таких лігандів відносяться сполуки, в яких є декілька функціональних груп, наприклад, -СOOН, в яких Гідроген заміщується на йон металу і -NН2-група, що містить неподілену електронну пару. Прикладом можуть бути продукти взаємодії йонів металів з α-амінокислотами.
Для комплексних сполук характерна “ізомерія” Розрізняють:
– геометричну (цис-транс) ізомерію, характерну для комплексів з різними лігандами :

[Pt(NH3)2Cl2] - квадратний комплекс, цис-, транс-ізомери;
– координаційну ізомерію – характеризується різною координацією двох видів лігандів відносно двох різних комплексоутворювачів:
[Co(NH3)6]3+ [Cr(CN)6]3- і [Cr(NH3)6]3+ [Co(CN)6]3-;
– йонізаційну ізомерію – характеризується неоднаковим розподілом аніонів між внутрішньою і зовнішньою сферами:
[CoBr(NH3)5]2+SO4 і [CoSO4(NH3)5]+Br
червоно-фіолетовий червоний
9.2 Номенклатура комплексних сполук і їх основні типи. Рівновага в розчинах КС
Назви лігандів. Якщо лігандами є аніони, то до кореня латинської назви додають голосну "о", наприклад: F![]() –фторо, СІ
–фторо, СІ![]() –хлоро, Br
–хлоро, Br![]() –бромо, ОН
–бромо, ОН![]() –гідроксо, CN
–гідроксо, CN![]() –ціано, SO42-–сульфато, NO
–ціано, SO42-–сульфато, NO![]() –нітро, NO
–нітро, NO![]() – нітрато та ін. Назви нейтральних лігандів залишають без змін: С6Н6 – бензен, (NH2)2CO – карбамід, H2NCH2CH2NH2 –етилендіамін. Виключення: H2O – аква; NH3 – амін; NO – нітрозил; CO – карбоніл.
– нітрато та ін. Назви нейтральних лігандів залишають без змін: С6Н6 – бензен, (NH2)2CO – карбамід, H2NCH2CH2NH2 –етилендіамін. Виключення: H2O – аква; NH3 – амін; NO – нітрозил; CO – карбоніл.
Назви KС складаються за таким принципом (за номенклатурою ЮПАК): спочатку називають катіон, потім аніон.
В сполуках з комплексними катіонами спочатку називають комплекс а потім зовнішню сферу. Назва комплексу починається із назви лігандів, попередньо вказується число лігандів грецькими числівниками (ди, три, тетра, пента, гекса та ін), потім називається комплексоутворювач із зазначенням його валентності (за системою Штока: І, П, Ш, IV). Наприклад:
[Ag(NH3)2]Cl – діамінаргентум(І)хлорид;
[Al(H2O)5OH]SO![]() – моногідроксопентаакваалюмінй(III)сульфат;
– моногідроксопентаакваалюмінй(III)сульфат;
[Pt(H2O)(NH3)2ОН]NO3 – гідрокcодіамінмоноакваплатина(П)нітрат.
У сполуках з комплексними аніонами спочатку називають зовнішню сферу, потім число лігандів і ЦА, додаючи до кореня його латинської назви закінчення "ат", зазначаючи валентність (система Штока). Наприклад:
К4[Fe(CH)6] – тетракалій гексаціаноферрат (П);
K3[Fe(СN)6] – трикалій гексаціаноферрат(Ш);
Na3[AIF6] – тринатрій гексафторалюмінат(ІІІ)
Na2[Pl(CN)4Cl2] – динатрій діхлоротетраціаноплатинат (ІV).
Назви деяких комплекноутворювачів: Pt – платинат, B – борат, As – арсенат, Mn – манганат, Аl – алюмінат, Ag – аргентат, Сu – купрат, Hg – меркурат і інші.
Комплекси без зовнішньої сфери називається одним словом:
[Ni(СO)4 ] – ніколтетракарбоніл;
[Рt(NH3)2Cl2] – дихлородіамінплатина (П).
Серед основних катіонних комплексів виділяють наступні:
– аміакати – сполуки, що містять амін-комплекси:
([Сu(NH3)4]SO4 – тетраамінкупрум(П)сульфат);
– гідрати – містять аква-комплекси:
([Cr(H2O)6]Cl3 - гексааквахром(Ш)трихлорид);
– гідроксокомплекси – лігандами є гідроксид-йони:
К2[Zn(ОН)4] - дикалій тетрагідроксоцинкат;
– ацидокомплекси – лігандами є аніони (залишки кислот):
К2[PlСl4] –дикалій тетрахлороплатинат(П) та ін.
Рівновага в розчинах КС.
Йони зовнішньої сфери з'єднані з внутрішньою сферою (комплексом) йоним зв'язком, тому в водних розчинах комплексні солі дисоціюють практично повністю як сильні електроліти, наприклад:
[Ag(NH3)2]Cl D [Ag(NH3)2]+ + Cl-
Цей процес називається первинною дисоціацією (вона відбувається миттєво і до кінця).
Внутрішня сфера KС також здатна розпадатися на комплекоутворювач і ліганди, наприклад:
[Аg (NH3)2]+ = Ag+ + 2 NН3
Цей процес називають вторинною дисоціацією, який аналогічний дисоціації слабких електролітів. Він підкоряється закону дії маси, може відбуватися ступінчасто і характеризуєгься константою рівноваги:
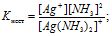 рКнест = -lg Кнест
рКнест = -lg Кнест
Ця константа є мірою стійкості комплексу: чим менше стійкий комплекс, тим більша концентрація Аg+ і NН3 (для даного випадку), тим більше числове значення константи (К), яку називають константою нестійкості. Величина, обернена до константи нестійкості, називається константою стійкості : Кст = 1/Кнест (інколи позначається грец. літ. β) або Кст = К-Інест, lgβ = pKнест, ΔG° = -RTlnК = -4,575lgβ.
Вона є мірою комплексоутворення. Для наведеного вище прикладу:
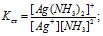
тобто більшій величині Кст відповідає більша концентрація комплексу за рівноваги. Оскільки в розчинах йони сольватовані (гідратовані), то під час йонізації комплексу в розчині відбувається заміна лігандів на молекули розчинника і навпаки, наприклад:
[Co(NH3)6]2+ + 6 H20 ![]() [Co(H2О)6]2+ + 6 NH3
[Co(H2О)6]2+ + 6 NH3
Напрямок визначається за величинами рКнест
До дисоціації комплексного йона можна застосувати правило зміщення рівноваги Ле-Шателье. Наприклад, для дисоціації йона
[Ag(NH3)2]+ = Ag+ + 2 NН3
збільшення концентрації молекул аміаку зміщує рівновагу вліво, або за формулою
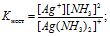
збільшення числівника дробу приводить до зростання знаменника, так як величина К - стала.
Наведемо приклади констант нестійкості для однотипних сполук:
а) ![]() Кнест = 1,3∙10-3
Кнест = 1,3∙10-3
б) ![]() Кнест = 6,8∙10-8
Кнест = 6,8∙10-8
в) ![]() Кнест = 1∙10-21
Кнест = 1∙10-21
На підставі цих даних можна зробити висновок, що найбільш стійким комплексом є в) а найменш – а).
Більшість добре розчинних КС можна зруйнувати дією інших електролітів або розчинників, якщо в результаті реакції утворюються малорозчинні сполуки, нові більш стійкі ніж вихідні комплекси. Напрямок реакції визначають за величиною константи рівноваги. Наприклад:
[Аg (NH3)2]+ + I- → АgI ↓+ 2 NH3+
Кнест = 6.8∙10-8 Кз = 8,3∙10-17
![]()
Аміакати можна зруйнувати дією кислот, наприклад:
[Аg (NH3)2]+ + 2 H+ → Аg+ + 2NH4+
або утворенням більш міцного комплексу, наприклад:
[Zn(NH3)4]2+ + 4 CN- = [Zn (CN)4]2- + 4NH3
Кнест = 3,6∙10-10 Кнест = 1,3∙10-17
![]()
Великі значення констант рівноваги свідчать про те, що реакції практично відбуваються до кінця, тобто, є необоротними.
9.3 Сучасні теорії KС і їх практичне значення
Для пояснення утворення і властивостей КС використовують метод валентних зв'язків (МВЗ), теорію кристалічного пoля (ТКЦ) і метод молекулярних орбіталей (MMО). За МВЗ – утворення комплексів здійсняється за рахунок донорно-акцепторної взаємодії, частіше всього, неподілених електронних пар лігандів і вільних орбіталей комплексоутворювача. Причина комплексоутворення – валентна ненасиченість атомів, тому КС, як правило, міцніші, ніж прості сполуки, із яких вони утворилися. Так як комплексоутворювач надає для утворення зв'язків нерівноцінні орбіталі, то відбувається їх гібридизація, а тип гібридизації визначає геометрію комплексу (рисунок 9.1).
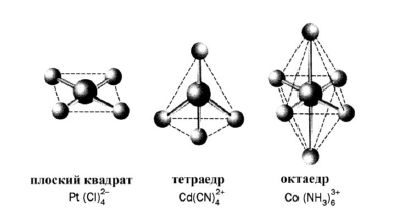
Рисунок 9.1 – Геометрія молекул комплексних сполук
Be2+ має вільні 2s і 2 р-орбіталі, виступає як акцептор 4 електронних пар, які надають йому фторид-йони. 3а рахунок sр3-гiбридизації валентних орбіталей берилію йон [BeF4]2- має тетраедричну будову.
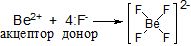

Якщо координаційне число дорівнює 4, крім sр3-гібридизації (тетраедрична координація лігандів), може реалізуватися також dsp2-гібридизація, якій відповідає плоско-квадратична координація:
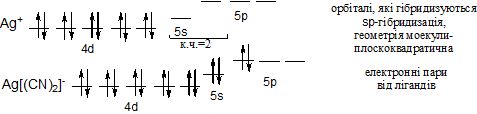
Комплексноутворююча здатність катіонів визначається:
йонним потенціалом φ (рівним відношенню заряду катіона Ζ до його радіусу r ![]() ) і електронною конфігурацією.
) і електронною конфігурацією.
Від величини φ залежить в основному стійкість комплексу. Наприклад катіони s-елементів (К+,Nа+,Са2+ та ін.) мають великий радіус і малий заряд, тому характеризуються низькою комлексоутворюючою здатністю.
Катіони d-елементів, які мають невеликий радіус і високий заряд (Сr3+, Сo3+, Рt4+ та ін.) є дуже сильними комплексоутворювачами. Йони р-елементів за комплексоутворюючою здатністю займають проміжне положення між катіонами s- і d-елементів.
Катіони d-елементів можуть одночасно мати і вільні орбіталі, і неподілені електронні пари. Якщо аналогічні можливості характерні і для ліганду, то одночасно з σ - зв'язком (ліганд – донор, комлексоутворювач – акцептор) утворюється і π-зв'язок (ліганд – акцептор, комлексоутворювач – донор, називають такий зв'язок "дативним"):
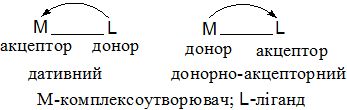
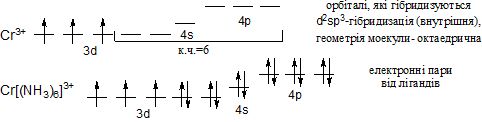
Для катіонів d-елементів характерні октаедричні комплекси з гібридизацією: d2sp3 і sр3d2, в залежності від того, які d-орбіталі комплексоутворювача доступні для лігандів. Гібридизація d2sp3 називається внутрішньою (комплекси – внутрішньоорбітальними); гібридизація sр3d2 - називається зовнішнью (комплекси –зовнішньоорбітальними).
Приклад d2sp3-гібридизації (внутрішньої):
Приклад sр3d2-гібридизації (зовнішньої):
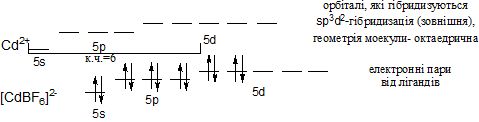
Метод ВЗ є наближеним, мало придатним для розрахунку енергії зв'язку і інших характеристик комплексних сполук.
Теорія кристалічного поля ґрунтується на припущенні, що між комплексоутворювачем і лігандами існує тільки електростатична взаємодія, при цьому враховується просторовий розподіл електронної густини
d-орбіталей комплексоутворювача.
Якщо атом (йон) помістити в центр сфери з рівнорозподіленим негативним зарядом (гіпотетичний випадок), то на всі п'ять електронні хмари d-орбіталей буде діяти однакова сила відштовхування, що призведе до збільшення енергії всіх d-електронів, але вона, як і раніше, буде однакова (виродження не знімається).
Якщо йон потрапляє в утворене лігандами менш симетричне, ніж сферичне поле, то енергія d-електронів буде зростати тим більше, чим ближче до ліганду розміщена відповідна електронна хмара.
Наприклад, в октаедричному полі d-орбіталї розділяються на дві групи з різними енергіями:
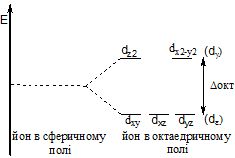
три орбіталі (dxy, dx, dy) з більш низькою енергією (dє – орбіталі); дві орбіталі (dz2 і dz2=y2) з більш високою енергією (dy-орбіталі). Різниця між енергіями dε–dγ-підрівней називається енергією розщеплення орбіталей (позначається грецькою літерою Δ, в даному випадку – Δокт).
Для тетраедричного оточення розщеплення буде мати обернений вигляд, тобто, dy-орбіталі мають низьку, а dε-opбіталі – більш високу енергію (Δтет = 4/9·Δокт) d-рівня. За здатністю спричиняти розщеплення орбіталей ліганди розміщуються в такому порядку:
CN![]() > NO
> NO![]() > NH3 > H2O > OH
> NH3 > H2O > OH![]() > F
> F![]() > Сl
> Сl![]() > Вr
> Вr![]() > I
> I![]() ,
,
який називається спекторохімічним рядом.
Ліганди, які розміщені в кінці цього ряду, спричиняють невелике розщеплення енергії d-підрівня (ліганди слабкого поля). Ліганди, розміщенні на початку ряду (ліганди сильного поля) призводять до значного розщеплення d-підрівня. Тому, в першому випадку електрони розміщуються за правилом Гунда спочатку на dє-орбіталях (три електрона), потім на
dγ-орбіталях (два електрона) і тільки після цього починається попарне заповнення електронами dє-, а потім dγ-орбіталей.
У другому випадку заповняються dε-орбіталі – спочатку поодинокими, а потім спареними електронами, після чого заповнюються dγ-орбіталі (ліганди сильного поля).
Приклад. Пояснити, чому йон [CoF6]3- парамагнітний, а йон [Co(CN)6]3- – дімагніний?
Рішення. Електронна формула Сo3+ 3d0. Ці шість d-електронів розподілені на орбіталях так:
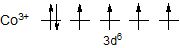
В октаедричному полі лігандів відбудеться розщеплення d-підрівня неоднаково, тому що F![]() -йон – ліганд слабкого поля і СN
-йон – ліганд слабкого поля і СN![]() -йон – ліганд сильного поля. Тому, схема розподілу електронів на dε - і dγ-орбіталях буде такою:
-йон – ліганд сильного поля. Тому, схема розподілу електронів на dε - і dγ-орбіталях буде такою:
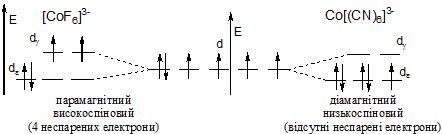
Якщо число непарних електронів дорівнює одиниці, то в такому випадку теж буде низькоспіновий комплекс.
Наявність на dγ-орбіталях валентних місць (незаповнені орбіталі) може спричиняти перехід електрона 3dε → dγ (при поглинанні комплексним йоном світла), що буде визначати колір комплексного йона (сполуки), це зумовлено рівністю ![]() (енергія поглинутого кванта світла дорівнює енергії розщеплення). В розрахунку на 1 моль поглинутої речовини справедливе таке відношення :
(енергія поглинутого кванта світла дорівнює енергії розщеплення). В розрахунку на 1 моль поглинутої речовини справедливе таке відношення :
![]() , а так як
, а так як ![]() , то
, то ![]() , враховуючи, що
, враховуючи, що ![]() , можна записати:
, можна записати: ![]() , де h – стала Планка, с – швидкість світла, ν і λ – відповідно частота і довжина хвилі поглиненого світла.
, де h – стала Планка, с – швидкість світла, ν і λ – відповідно частота і довжина хвилі поглиненого світла.
Теорія молекулярних орбіталей надає великого значення σ- і π-зв'язуванню, яке впливає на величину параметра розщеплення (Δ): чим більше σ-зв'язування, тим більше Δ. π-взаємодія, як вже згадувалося вище, може бути донорно-акцепторною (з утворенням π*-розпушуючих МО) і дативною (з утворенням π-зв'язуючої МО). Ліганди π-акцептори характеризуються більшим Δ ніж π-донори. Тому при дативному
π-зв'язуванні Δ більше в порівнянні з π-донорно-акцепторною взаємодією. За характером σ- і π-зв'язування ліганди поділяються на такі групи:
1) σ-донори (NH3 ,NR3, NCS![]() );
);
2) σ-донори, слабкі π-донори (F![]() , OH
, OH![]() , H2O, ROH, R2O);
, H2O, ROH, R2O);
3) σ, π-донори, слабкі π-акцептори (CI![]() , Br
, Br![]() , I
, I![]() , SH
, SH![]() , SCN
, SCN![]() );
);
4) σ-донори, π-акцептори (CN![]() , CO, NO, PR3, NO
, CO, NO, PR3, NO![]() );
);
5) π-донориб π-акцептори (C6H6, C2H4).
Тому, електрохімічний ряд лігандів (див. вище) починається з CO, CN![]() (це комплекси з максимальною стійкістю за рахунок σ- і π-акцептороного зв'язування).
(це комплекси з максимальною стійкістю за рахунок σ- і π-акцептороного зв'язування).
Будову комплекса [CoF6]3- за теорією молекулярних орбіталей можна уявити так:
Со3+-йон (3d6), шість лігандів F![]() мають І2
мають І2 ![]() , всього – І8
, всього – І8![]() . Із них І2
. Із них І2![]() знаходяться на шести σ-зв'язуючих орбіталях, решта шість електронів – на розпушуючих – πd* і розпушуючих σd:
знаходяться на шести σ-зв'язуючих орбіталях, решта шість електронів – на розпушуючих – πd* і розпушуючих σd:
(σs)2 (σp)6 (σd)4 (πd)4 (σ![]() )2 [CoF6]3-
)2 [CoF6]3-
Метод молекулярних орбіталей дає найбільш загальний підхід до характеристики комплексних сполук, поєднуючи ідеї методів валентних зв'язків і теорії кристалічного поля (рисунок 9.2).
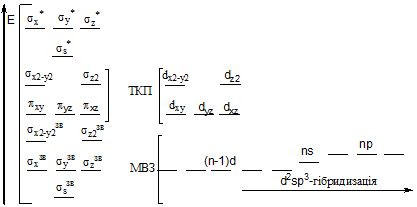
Рисунок 9.2 – Порівняння методів МО, ВЗ і ТКП на прикладі октаедричного комплексу d-елемента
Значення КС. За порівняно короткий час хімія КС виросла в галузь, яка швидко розвивається, перетворюючись на зв’язуючу ланку між неорганічною, органічно, аналітичною, фізичною і біологічною хімією. Більше як 30% всіх реакцій якісного аналізу, базується на комплексоутворенні. Ці реакції використовуються і в кількісному аналізі, а також в техніці: добування цінних металів (металів платинової групи); одержання чистих і надчистих матеріалів (очистка урану). Комплексоутворення покладене в основу фарбування тканин.
Більшість природних мінералів (коштовні і напівкоштовні) є комплексними сполуками (смарагд, топаз, гранат, бірюза та ін.).
Комплексоутворення здійснюється в багатьох процесах, які відбуваються в живих організмах (комплексними сполуками є ферменти, вітаміни, гемоглобін та ін.).