Тема 2 Сучасна теорія будови атомів та періодичний закон
План
2.1 Історія розвитку теорії про будову атомів. Сучасна теорія будови атомів. Квантова або хвильова механіка. Квантові числа
2.2 Атомні орбіталі і принципи їх заповнення електронами. Електронні формули елементів
2.3 Зв'язок між електронною будовою атомів і хімічними властивостями елементів (йонів)
2.4 Періодичний закон і періодична система елементів
2.5 Основні параметри, які визначають властивості елементів
2.1 Історія розвитку теорії про будову атомів. Сучасна теорія будови атомів. Квантова або хвильова механіка. Квантові числа
Перші дані про складність будови атома було здобуто під час вивчення катодного випромінювання, що утворюється внаслідок проходження електричного струму крізь розріджені гази. Так, вимірювання його відхилення в електричному і магнітному полях показало, що це потік найдрібніших частинок, які несуть найменший електричний заряд – електронів. Було обчислено заряд електрона 1,6·10-19 Кл та його масу – 9,1094·10-28г.
Велику роль у встановленні складної природи атома відіграло відкриття і вивчення радіоактивності. Здатність деяких елементів випромінювати невидиме для ока проміння, яке спричиняє почорніння фотографічних пластинок, проходить крізь речовини, йонізує повітря, називається радіоактивністю, а відповідні елементи – радіоактивними. В 1899 р. англійський фізик Е. Резерфорд встановив, що радіоактивне проміння є неоднорідним і складається із β- випромінювання (потік електронів), α-випромінювання (потік позитивно заряджених частинок з масою атома гелію ![]() ), γ-випромінювання (електромагнітні хвилі λ=4·10-11…2·10-9).
), γ-випромінювання (електромагнітні хвилі λ=4·10-11…2·10-9).
Перша модель атома була запропонована в 1903 р. Дж. Томсоном. За його гіпотезою атом мав вигляд суцільної позитивно зарядженої сфери, в якій розміщені незначні за розмірами негативно заряджені електрони.
В 1911 р. Е. Резенфорд запропонував ядерну модель атома: в центрі – позитивно заряджене ядро, маса якого майже дорівнює масі атома, навколо ядра рухаються електрони, число яких дорівнює позитивному заряду ядра. Між електронами і ядром взаємодіють електростатичні сили, врівноважені відцентровою силою, що виникає внаслідок руху елетронів. Заряд ядра атома чисельно дорівнює порядковому номеру елемента в періодичній системі.
Вивчаючи характеристичні рентгенівські спектри різних хімічних елементів, Г. Мозлі в 1913 р. встановив, що корінь квадратний з частоти (ν=1/λ) певних ліній однакових серій характеристичного рентгенівського спектра прямо пропорційна порядковому номеру елемента в періодичній системі: ![]() , де а і b – сталі величини; λ – довжина хвилі власного випромінювання елемента з порядковим номером Z. Цей закон дав змогу визначити точні значення порядкових номерів для елементів.
, де а і b – сталі величини; λ – довжина хвилі власного випромінювання елемента з порядковим номером Z. Цей закон дав змогу визначити точні значення порядкових номерів для елементів.
Німецький фізик М. Планк, вивчаючи природу випромінювання нагрітих твердих тіл, висловив припущення, що енергія випромінюється і поглинається не безперервно, а певними порціями – квантами, пропорційними частоті коливань. Величину кванта енергії можна обчислити із рівняння Планка: Е = hν де Е – кількість енергії з частотою коливань ν; h – стала Планка –
6,626·10-34Дж·с.
В 1913 р. датський фізик Н. Бор сформулював основні положення своєї теорії будови атомі у вигляді постулатів:
– електрон обертається навколо ядра, не випромінюючи енергії, тільки по певних колових орбіталях, які називаються стаціонарними, або квантовими;
– електрон може переходити з однієї стаціонарної орбіталі на іншу; при цьому поглинається або випромінюється квант електромагнітного випромінювання, енергія якого дорівнює різниці енергії атома в кінцевому і вихідному станах.
Стан, що відповідає найменшому запасу енергії атома, називається основним. Перехід електрона на більш віддалену від ядра орбіталь супроводжується поглинанням кванта енергії, а такий стан атома називається збудженим. Перехід атома із збудженого у основний стан супроводжується випромінюванням кванта енергії (рисунок 2.1).
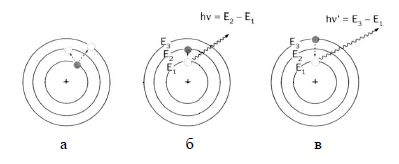
Рисунок 2.1 – Схема переходу атома на орбіталі з поглинанням (а) та випромінюванням (б, в) енергії
На основі своєї теорії Н.Бор розрахував спектр атома водню. Отже теорія будови атома Н. Бора не лише пояснює фізичну природу атомних спектрів як наслідок переходу атомних електронів з однієї орбіталі на іншу, а й дає змогу розраховувати спектри.
В 1916 р. А. Зоммерфельд обґрунтував можливість руху електронів і по еліптичних орбіталях, що по-різному розташовані у просторі.
Сучасною теорією будови атомів є квантова або хвильова механіка.
Квантова механіка – це система понять та рівнянь, якими необхідно користуватися замість законів і рівнянь класичної фізики, щоб описати поведінку і властивості атомних об'єктів.
Рівняння Луї де Бройля. Двоїста природа електрона
У 1924 р. Луї де Бройль припустив, що корпускулярно-хвильова двоїстість (дуалізм) – це властивість матерії. Рух будь-якої матеріальної частинки можна розглядати як хвильовий процес і для нього справедливе співвідношення: λ = h/mV, де m і V – маса і швидкість руху частинки (електрону); h-стала Планка; λ – довжина хвилі. Це математичний вираз дуалізму "хвиля-частинка"; будь-якій частинці з масою m, яка рухається із швидкістю V, відповідає хвиля довжиною λ і, навпаки: полю, яке характеризується довжиною хвилі λ, відповідає мікрочастинка з масою m.
Стосовно до електрона (потоку електронів), ця гіпотеза була підтверджена у 1927 p. K. Девіссоном і Р. Джермером (США) дослідами з дифракції пучка електронів на кристалі нікелю. З того часу квантова механіка розглядає електрон як частинку і як хвилю.
Дифракція електронів використовується в електронних мікроскопах.
Принцип невизначеності Гейзенберга
В.Гейзенберг (1927р., німецький фізик) запропонував принцип невизначеності: для мікрочастинки атомного масштабу не можливо одночасно встановити координати і швидкість її руху. Математично це виглядає таким чином: Δx·ΔVх≥h/m. Добуток невизначеності положення (Δx) і швидкості (ΔVх) руху частинки не може бути меншим величини h/m.
Висновок: властивості елементарних частинок не можуть бути описані лише з хвильової або лише з корпускулярної точки зору. Електрон – мікрочастинка, тому неможливо відтворити траєкторію його руху в атомі і неможливо створити наочно модель атома, яка б відповідала характеру цього руху. Можна лише вказати область навколо ядерного простору, у якому більш ймовірно існує електрон.
Таким чином, вводиться поняття про електронну хмару з ймовірністю ψ2 знаходження електрона в даній точці простору або у елементі об'єму dV навколо ядра ψ2ΔV.
Хвильове рівняння Е. Шредінгера
В 1926 р. Е. Шредінгер запропонував хвильове рівняння, яке у квантовій механіці відіграє таке ж значення, як закони Ньютона у класичній механіці.
Це рівняння зв'язує хвильову функцію ψ з потенціальною енергією електрону U та його повною енергією Е:
![]()
де m – маса електрона, h – стала Планка; х, у, z – координати тримірного простору, які визначають положення електрона у атомі, якщо ядро атома знаходиться на початку координат; U – потенціальна енергія електрона (електростатична взаємодія електрона з ядром, яка залежить від відстані електрона від ядра, тобто від координат х, у, z ); ψ – функція координат х, у, z.
Це рівняння – стаціонарне (не залежить від часу ) і нерелятивне (не враховує залежність маси електрона від швидкості його руху – більш детально розглядається у курсі фізики ).
Квантові числа
Квантова механіка вводить поняття про електронний розподіл з певною хвильовою функцією, яку називають атомна орбіталь (АО).
Сукупність АО одного енергетичного рівня утворює електронний шар (оболонку ). Енергетичний стан електрона (![]() ) в атомі описується 4 квантовими числами : n, l, ml, ms
) в атомі описується 4 квантовими числами : n, l, ml, ms
Головне квантове число n – характеризує рівень енергії у полі ядра і відстань цього рівня від ядра. Для атома водню: Е = -13,6 (1/n2) еВ.
Головне квантове число приймає значення цілих чисел: n = 1, 2, 3, 4...![]() (від одиниці до нескінченності, що відповідає стану йонізації, тобто відриву електрона від атома). Його позначають також літерами, наприклад: n = 1(К), n = 2(L), n = 3(М), n = 4(N), n = 5(0), n = 6(Р).
(від одиниці до нескінченності, що відповідає стану йонізації, тобто відриву електрона від атома). Його позначають також літерами, наприклад: n = 1(К), n = 2(L), n = 3(М), n = 4(N), n = 5(0), n = 6(Р).
Побічне, орбітальне або азимутальне квантове число l визначає енергію енергетичного підрівня, характеризує форму орбіталі (рисунок 2.2). Назва "азимутальне" походить від арабського "аз мутус" – шлях, траєкторія руху). Приймає значення від 0 до (n-1). Має такі літерні позначення:
|
l |
0 |
1 |
2 |
3 |
4 |
|
|
s |
p |
d |
f |
g |
(зі спектроскопії : s (sharp) – різкий; р (principal) – головний; d (diffuse) – дифузний; f (fundamental) – фундаментальний).
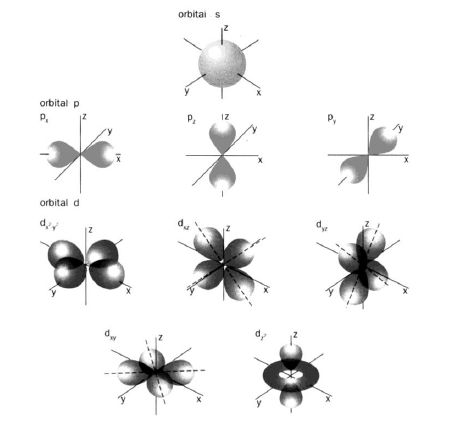
Рисунок 2.2 – Форма і просторова орієнтація s-, p-, d- орбіталей
Орбітальний момент кількості руху (момент імпульсу електрона) виражається співвідношенням: М = (h/2π) ![]() , якому і відповідає орбітальне квантове число.
, якому і відповідає орбітальне квантове число.
Таким чином, енергетичні рівні (оболонки), які характеризуються головним квантовим числом n, розщепляються на енергетичні підрівні, що характеризуються орбітальним квантовим числом (мають орбіталі різної форми). Число енергетичних підрівнів дорівнює номеру рівня. Наприклад:
|
Рівень n |
Підрівень l |
Позначення |
|
1(К) |
0 |
1s |
|
2(L) |
0; 1 |
2s, 2р |
|
3(М) |
0; 1; 2 |
3s, Зр, 3d |
|
4(N) |
0; 1; 2; 3 |
4s, 4p, 4d, 4f |
Причому, s-орбіталь має форму кулі, р-орбіталь – гантелеподібну, d-орбіталь має вигляд чотирьох об'ємних пелюстків, f-орбіталь – шість пелюсток (рисунок 2.2).
Магнітне квантове число ml – характеризує орієнтацію орбіталі у магнітному полі на даному енергетичному підрівні (момент імпульсу є вектором) або просторове розміщення орбіталей відносно магнітної осі атома і приймає значення: від +l через 0 до -1; або ml визначає значення проекції орбітального моменту кількості руху на виділений напрямок (наприклад, на вісь z):
Mz=(h/2π)ml
Число орбіталей з даним значенням l дорівнює (2l+1).
|
Орбітальне квантове число l |
Магнітне квантове число ml |
Число орбіталей з даним значенням l |
|
0 |
0 |
1 |
|
1 |
1; 0; -1 |
3 |
|
2 |
2; 1; 0; -1; -2 |
5 |
|
3 |
3; 2; 1; 0; -1; -2; -3 |
7 |
Орбіталі з однаковою енергією називаються виродженими. Наприклад, р – стан вироджений втричі. Загальне число орбіталей даного енергетичного рівня дорівнює n2.
Спінове квантове число ms – характеризує рух електрона навколо власної осі. Воно має два значення:+1/2 і -1/2 (рисунок 2.3).
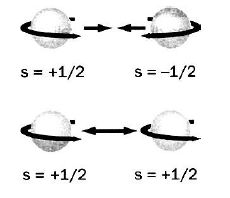
Рисунок 2.3 – Обертання електрона навколо своєї осі
2.2 Атомні орбіталі і принципи їх заповнення електронами
Атомна орбіталь характеризує ту частину простору навколо ядра, у якому найбільш ймовірне знаходження електрона.
В 1925 році В. Паулі формулює найважливіший принцип: «в атомі не може бути навіть двох електронів, які мають однакове значення усіх квантових чисел» Будь-які два електрони повинні відрізнятися хоча б значенням одного квантового числа. Це означає, що на одній орбіталі може знаходитися лише два електрони.
Знаючи число орбіталей на енергетичному рівні (n2), можна розрахувати число електронів на енергетичних рівнях за формулою: N = 2n2, Наприклад:
|
n=1 |
N = 2·12 = 2 |
перший енергетичний рівень |
|
n=2 |
N = 2·22 = 8 |
другий енергетичний рівень |
|
n=3 |
N = 2·32 = 18 |
третій енергетичний рівень |
|
n=4 |
N = 2·42 = 32 |
четвертий енергетичний рівень |
Якщо число орбіталей на енергетичному підрівні дорівнює (2l+1), то кількість електронів на даному підрівні обчислюється за формулою: 2 (2l+1). Наприклад:
|
n = l |
l = 0 |
1s2 |
|
n = 2 |
l = 0; 1 |
2s2 2p6 |
|
n = 3 |
l = 0; 1; 2 |
3s23p63d10 |
|
n = 4 |
l = 0; 1; 2; 3 |
4s2 4p6 4d10 4f14 |
Таким чином, розрізняють s-, p-, d-, і f-атомні орбіталі (АО).
Порядок їх заповнення підкоряється принципу В. Паулі, правилам Гунда (Хунда) і В.М. Клечковського. В основі цих правил лежить принцип послідовного заповнення АО в міру зростання енергії.
Правило Гунда: електрони даного енергетичного підрівня прагнуть зайняти максимальне число АО (енергетичних місць), щоб спінове квантове число було максимальним.
Наприклад, при заселенні еквівалентних орбіталей (рх, ру, рz) меншій енергії відповідає паралельне розташування спінів (випадок (а), але не (б)):
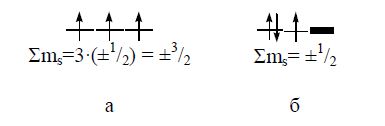
Правила В.М. Клечковського: АО заповнюються електронами у порядку послідовного зростання суми квантових чисел (n+l) – перше правило; за однакових значень суми (n+l) спочатку заповнюються АО з меншим значенням n, тобто у порядку послідовного збільшення головного квантового числа - друге правило. Наприклад:
|
1s |
n=1 |
l=0 |
n+l=1 |
6s |
n=6 |
l=0 |
n+l=6 |
|
2s |
n=2 |
l=0 |
n+l=2 |
4f |
n=4 |
l=3 |
n+l=7 |
|
2p |
n=2 |
l=1 |
n+l=3 |
5d |
n=5 |
l=2 |
n+l=7 |
|
3s |
n=3 |
l=0 |
n+l=3 |
6р |
n=6 |
l=1 |
n+l=7 |
|
3p |
n=3 |
l=1 |
n+l=4 |
7s |
n=7 |
l=0 |
n+l=7 |
|
4s |
n=4 |
l=0 |
n+l=4 |
5f |
n=5 |
l=3 |
n+l=8 |
|
3d |
n=3 |
l=2 |
n+l=5 |
6d |
n=6 |
l=2 |
n+l=8 |
|
4p |
n=4 |
l=1 |
n+l=5 |
7p |
n=7 |
l=1 |
n+l=8 |
|
5s |
n=5 |
l=0 |
n+l=5 |
|
|
|
|
|
4d |
n=4 |
l=2 |
n+l=6 |
|
|
|
|
|
5p |
n=5 |
l=1 |
n+l=6 |
|
|
|
|
Таким чином, заповнення АО відбувається в порядку зростання їх енергії:
1s< 2s< 2p< 3s< 3p< 4s < 3d< 4p< 5s < 4d< 5p< 6s < 4f ≤ 5d< 6p< 7s< 5f≈6d<7p.
(Користуючись правилами В.М. Клечковського, зробіть необхідні розрахунки для підтвердження наведеного вище порядку заповнення АО)
Електронні формули елементів
Розміщення електронів на енергетичних рівнях і підрівнях називається електронною конфігурацією. Запис електронних конфігурацій здійснюють таким чином: вказують значення головного квантового числа, потім – літерами s, p, d, f – значення орбітального квантового числа, а зверху справа над літерою – число електронів на даному підрівні. Наприклад, запис 2р4 означає, що на другому енергетичному рівні на р-підрівні знаходиться чотири електрони. Послідовність заповнення електронами орбіталей різних енергетичних рівнів можна уявити наступним чином:
1 s2 2s2 2p6 3s2 Зр6 4s2 3d10 4р6 5s2 4d10 5p6 6s2 5d1 4f14 5d9 6p6 7s2 6d1 5f14 6d9.
Важливе значення мають валентні електрони, які приймають участь в утворенні хімічних зв'язків. Як правило, це зовнішні електрони (s, р) і електрони передостаннього енергетичного рівня (d). Знаючи електронну формулу валентних електронів атома даного елемента, можна визначити до якої родини елементів (s, р, d, f) він відноситься, оскільки у s-, р-, d-, f-елементів добудовуються відповідно s-, р-, d-, f- АО.
Наприклад: 4s23d5 – це елемент 4-го періоду, 7-ої групи, d- елемент (Мn-Манган).
2.3 Зв'язок між електронною будовою атомів
і хімічними властивостями елементів
Електронна будова атомів дає можливість охарактеризувати властивості елементів та їх сполук: положення в періодичній системі, метал чи неметал, ступінь окиснення, кислотно-основні властивості оксидів, формули відповідних кислот, гідроксидів, амфолітів.
Максимальна цифра перед s-електронами свідчить про номер періоду; сума валентних електронів визначає номер групи. До головної підгрупи
(А-групи) належать елементи у яких валентними електронами є s- і
р-електрони, тому ці елементи називають s- і р-елементами. Формули валентних електронів для елементів А-груп: ns1-2 або ns2 np1-6. До побічної
(В-групи) належать d- і f-елементи. Їх валентні електрони: ns0-2 (n-1)d1-10. У
f-елементів в утворенні хімічних зв'язків можуть брати участь і f-електрони.
До металів відносяться усі s-елементи (крім Гідрогену і Гелію), d- і
f-елементи, а також деякі р-елементів (III А-група). Атоми металів містять на зовнішньому рівні від 1 до 3 електронів.
До неметалів відносяться р-елементи, у яких на зовнішньому енергетичному підрівні міститься 5 – 8 електронів. Проміжне положення займають металоїди (за класифікацією видатного українського хіміка A.M. Голуба) – елементи IV – VI А-групи, 5 – 6 періодів:
|
Sn |
Se |
Те |
|
Pb |
Ві |
Po |
Метали мають лише позитивний ступінь окиснення, неметали і металоїди – негативний, який можна обчислити таким чином: номер групи мінус 8. Наприклад, номер групи дорівнює 6, звідси: 6-8=-2, (ст.ок. S в Н2S).
Під час утворення позитивних йонів із р-елементів, спочатку елемент втрачає р-електрони, потім s-електрони, потім d-електрони із пар, а потім – неспарені.
Наприклад: 5s2 5p3 (Sb°, 5 період, V група):
|
Sb° 5s2 5p3
|
|
Sb+3 5s2 5p°
|
|
Fe° 4s2 3d6
|
|
Fe+3 4s°3d5
|
Приклад 2.1 Охарактеризувати властивості елементу, для якого z = 25.
Рішення:
Повна електронна формула цього елементу така: 1s22s22p63s2Зр64s23d5.
Валентні електрони 4s23d5, отже це елемент 4 періоду, VII В-групи,
d-елемент, манган (Mn), метал, максимальний ступінь окиснення +7, оксид Mn2O7, кислотного характеру, якому відповідає кислота HMnО4.
Приклад 2.2 Охарактеризувати властивості елементу, для якого z = 16.
Рішення:
Повна електронна формула цього елементу Is22s22p63s2Зр4.
Валентні електрони 3s23р4, отже – це елемент 3 періоду, VI А-групи,
р-елемент, Сульфур (S), неметал, максимальний ступінь окиснення – +6, мінімальний – -2; оксид SO3, кислотного характеру, якому відповідає кислота H2SO4, гідрид – H2S.
2.4 Періодичний закон і періодична система елементів
Попередники Д.І. Менделєєва здійснили спробу провести класифікацію хімічних елементів: І. Деберейнер (1817 – 1829 рр.) встановив правило тріад; Дж. Ньюленд (1863 р.) – закон октав; А. де Шанкуртуа запропонував земну спіраль (1862 р.), у якій подібні елементи виявилися у багатьох випадках розміщеними один під одним на спіральних витках; Л. Мейер, практично одночасно з Д.І. Менделєєвим запропонував таблицю, подібну до такої Менделєєва. Однак, попередники Д.І. Менделєєва шукали лише очевидної подібності між елементами, не допускаючи думок про об'єднання (в періоди) таких не схожих елементів, як Натрій і Хлор.
Д.І. Менделєєв відкрив один із фундаментальних законів природи – періодичний закон (1869 р.), який дозволив створити не просто таблицю, а єдину систему елементів: «властивості елементів і їх сполук знаходяться у періодичній залежності від їх атомних мас».
Порядковий номер елемента є його фундаментальною характеристикою. Те ж саме можна сказати і про заряд ядра, оскільки його величина чисельно дорівнює порядковому номеру. Ядро – основа атома, яка визначає особливість елементів. До складу ядер усіх атомів, крім легкого ізотопу Гідрогену (Протію), входять протони і нейтрони (нуклони). Відомості про деякі елементарні частинки наведено в таблиці 2.1.
Таблиця 2.1 – Характеристика елементарних частинок
|
Частинка |
Символ |
Маса спокою |
|
|
г |
а.о.м. |
||
|
Протон |
р |
1,679·10-24 |
1,007276 |
|
Нейтрон |
n |
1,675·10-24 |
1,008665 |
|
Електрон |
|
9,108·10-28 |
0,000549 |
Маса атома практично дорівнює масі ядра – сумі мас протонів і нейтронів (маса електрона мала).
Ізотопи (від грец. “ізос” – однаковий, “топос” – місце) – це різновид атомів одного й того ж елементу з однаковим зарядом ядра або порядковим номером (z), але з різними масовими числами. У періодичній системі елементів вони займають одне й теж місце. Наприклад: ![]() і
і ![]() , де z = 17 (по 17 протонів), але 35 – 17 = 18 і 37 – 17 = 20 нейтронів.
, де z = 17 (по 17 протонів), але 35 – 17 = 18 і 37 – 17 = 20 нейтронів.
А = Z + N, де А – масове число (а.о.м.), z – порядковий номер або число протонів і N – кількість нейтронів.
Ізобари (від грец. “барос” – важкий) – різновид атомів з однаковими масовими числами, але з різним порядковим номером або зарядом ядра (z). Наприклад:![]() .
.
Таким чином, з відкриттям ізобарів виникла необхідність у новому формулюванні періодичного закону: "властивості елементів та їхніх сполук перебувають у періодичній залежності від заряду ядра атома (порядкового номера)".
Ізотони – це різновидність атомів з однаковим числом нейтронів. Наприклад:
|
|
(p-54, n-82) |
|
|
(p-56, n-82 ) |
|
|
(p-57, n-82) |
Розташування елементів у певному порядку називається періодичною системою, яка є графічним вираженням періодичного закону.
Відомо багато форм періодичної системи (понад 400), проте найважливіша – це коротка форма, запропонована Д.І. Менделєєвим, яка після вдосконалення є найпоширенішою до останнього часу. У такій формі періодична система включає всі відомі елементи і має місце для невідкритих елементів.
Основними структурними одиницями періодичної системи є періоди і групи.
Період – це горизонтальний ряд, в якому елементи розміщені в порядку зростання атомних мас (порядкового номера). В атомах елементів, розміщених в одному періоді відбувається заповнення однакового числа квантових рівнів. Номер періоду співпадає із значенням головного квантового числа n зовнішнього енергетичного рівня. Усі періоди, окрім першого, попарно містять однакове число (X) елементів, яке можна визначити за формулами В. М. Клечковського:
|
Непарний період |
Парний період |
|
X = 0,5(n+1)2 |
X = 0,5(n+2)2 |
|
n=1, 3, 5, 7 |
n =2, 4, 6 |
Наприклад, якщо n = 3, то X = 0,5∙(3 + 1)2 = 8 елементів; якщо n = 4, то X = 0,5∙(4 + 2)2 = 18 елементів і т.д.
Всього є сім періодів. Кожен період, крім першого, починається з лужного металу і закінчується благородним газом. Перший період найкоротший і має два елементи: Гідроген і Гелій. Другий і третій періоди містять по вісім елементів. Усі три періоди називаються малими періодами. Четвертий і п’ятий великі періоди містять по 18, а шостий – 32 елементи. Останній сьомий період – незавершений.
У малих періодах зі збільшенням порядкового номера спостерігається поступове зменшення металічних і посилення неметалічних властивостей. Для елементів великих періодів ця закономірність дещо ускладнюється. Наприклад, у п’ятому періоді, починаючи з Rb, металічні властивості послаблюються і досягають мінімуму у таких металів як Ru, Rh, Pd. Однак, починаючи із Cd (у якого металічні властивості стрибкоподібно зростають) з ростом порядкового номера повторюється зміна властивостей елементів, характерна для малих періодів: поступовий і закономірний перехід металічних властивостей у неметалічні і закінчується період благородним газом.
Такі зміни властивостей елементів в періодах із ростом порядкового номера можна пояснити наступним чином: оскільки у s- і р-елементів забудовується зовнішній електронний рівень, у d-елементів – передостанній, а у f-елементів – третій ззовні, то відмінність у властивостях найбільш різко проявляється у сусідніх s (р)-елементів. У d- і, особливо, у f-елементів одного й того ж періоду різниця у властивостях проявляється менш помітно.
d- і f-елементи даного періоду об'єднуються у родини. В 4 – 6 періодах у родини з 10 елементів об'єднуються d-елементи. Це родини 3d- (Sc – Zn),
4d- (Y – Cd) і 5d- (La, Hf – Hg ) елементів. В 6 і 7-му періодах у родини з 14 елементів об'єднуються f-елементи, це родини: 4f-елементів (Се – Lu), які називаються лантаноїдами та родина 5f-елементів (Th – Lr) – актиноїди.
Групи і підгрупи. Якщо головне квантове число n визначає положення елемента в періоді, то орбітальне l, разом із магнітним ml і спіновим ms квантовими числами визначає положення елемента у відповідній групі періодичної системи.
У відповідності до максимального числа електронів на зовнішньому енергетичному рівні атомів у не збудженому стані, елементи періодичної системи поділяють на вісім груп. Положення в групах s- і р-елементів визначається загальним числом електронів зовнішнього квантового рівня. Так, s-елементи утворюють І і ІІ групи; р-елементи – ІІІ – VIII (сума s + р). Наприклад:
|
Р |
3s23p3 |
– 3 період, V група; |
|
Mg |
3s2 |
– 3 період, II група; |
|
Ar |
3s23p6 |
– 3 період, VIII група та ін. |
Положення в групах d-елементів зумовлюється загальним числом
s-електронів зовнішнього і d-електронів передостаннього рівнів, за цією ознакою перші шість елементів кожної родини d-елементів розміщуються в одній із відповідних груп: Sc (4s23d1) – у III групі; Mn (4s23d5) – у VII групі; Fe (4s23d6) – у VIII групі; Zn (4s23d10) – у якого забудований d-підрівень і зовнішніми є 4s2 електрони, належить до II групи.
Через присутність на зовнішньому енергетичному рівні лише одного електрону (за рахунок "провалу" одного із s-електронів на d-підрівень) такі елементи як Cu (4s13d10), Ag (5s14d10), Au (6s15d10) належать до I групи. Тоді як Co (4s23d7), Ni (4s23d8), Rh (5s13d8), Pd (5s°4d10), Ir (6s25d7), Pt (6s15d9) разом з Fe, Ru і Os – до VIII групи (так звані тріади перехідних d-елементів).
Враховуючи особливості електронних структур елементів, родину лантаноїдів (4f-елементи) і актиноїдів (5f-елементи) розміщують у ІІІ групі.
В підгрупу типових елементів виділяють елементи малих періодів (без поділу на головну та побічну). В останньому випадку, згідно з Б.В. Некрасовим, елементи кожної групи поділяють на три підгрупи: типові елементи і дві підгрупи, складені із елементів великих періодів.
Наприклад, IV група періодичної системи елементів складаються із наступних трьох підгруп:
|
Типові елементи |
Елементи підгрупи германію |
Елементи підгрупи титану |
|
С Is22s22p2 |
Ge 3d104s24p2 |
Ті 4s23d2 |
|
Si 3s23p2 |
Sn 4d105s25p2 |
Zr 5s24d2 |
|
|
Pb 5d106s26p2 |
Hf 6s25d2 |
Електронні аналоги – це елементи, у яких валентні електрони розміщені на орбіталях, що описуються загальною для усіх елементів формулою. У періодичній системі елементів електронні аналоги входять до складу однієї підгрупи.
Таким чином, структура періодичної системи Д.І. Менделєєва визначається будовою атомів. Вона складається із восьми груп і семи періодів.
У 1 – 3 періодах (малі періоди) знаходяться типові елементи (див.вище).
4 – 7 періоди складаються із двох рядів: парного і непарного (для восьми кліткового варіанту). Послідовність розміщення елементів в 2 – 7 періодах така:
2 період: два s-елементи Li (2s1), Be (2s2) і шість р-елементів: B (2s22p1)…..F 2s22p5, Ne 2s22p6;
3 період: два s-елементи Na (3s1), Mg (3s2) і шість р-елементів: Al (3s23p1)…..Cl (3s23p5), Ar (3s23p6);
4 період: два s-елементи: K (4s1), Ca (4s2), десять d-елементів: Sc (4s23d1)...Zn (4s23d10) і шість р-елементів (див. період. систему);
5 період побудований аналогічно 4-му періоду;
6 період: два s-елементи: Cs (6s1); Ba (6s2); один d-елемент La (6s25d1); чотирнадцять f-елементів: Се…Lu, дев’ять d-елементів: Hf (6s25d2)... (6s26d10) і шість р-елементів Тl (6s26p1)…..At (6s26p5), Rn (6s26p6);
7 період – неповний, він повторює структуру 6-го періоду. До нього належить родина актиноїдів (f-елементи).
Отже, перший період містить 2 елементи; 2 і 3 – по вісім елементів; 4 і 5 періоди – по 18 елементів; 6 період – 32 елементи; 7 період – 25 елементів (незавершений).
2.5 Основні параметри, які визначають властивості елементів
Властивості елементів визначаються електронною будовою атомів, радіусами атома і йона (rат, rйона), енергіями йонізації і спорідненості до електрона. Останні два показники кількісно характеризують здатність атомів приймати або віддавати електрони (їх окисно-відновну активність, або металічні і неметалічні властивості).
Енергія йонізації (І) – кількість енергії (кДж/моль або еВ/атом), яка необхідна для відриву електрона від атома у не збудженому стані з перетворенням його у позитивно заряджений йон.
Енергія йонізації у електрон-вольтах на атом чисельно дорівнює потенціалам йонізації у вольтах (В).
Для багато електронних атомів значення І1, І2, .... Іn відповідає відриву першого, другого, третього і n-електрона. При цьому завжди І1< І2< І3.... Іn (зростає позитивний заряд йону, що утворюється).
Енергія йонізації визначає міцність зв'язку електронів з ядром, на яку впливають три основні фактори:
а) ефект екранування внутрішніх енергетичних підрівнів (послаблює зв'язок зовнішніх електронів з ядром); чим більше внутрішніх енергетичних рівнів, тим більше ефект екранування;
б) ефект проникнення – згідно з квантовою механікою, усі електрони (навіть зовнішні) певний час можуть знаходитися в просторі, близькому до ядра, що збільшує міцність зв'язку зовнішніх електронів з ядром; найбільшу проникаючу здатність мають s-електрони ( s > р > d);
в) взаємне відштовхування електронів одного й того ж енергетичного рівня, особливо, однієї й тієї ж АО.
Енергія йонізації залежить від заряду ядра (z), rат, rйона та електронної будови атома. Чим більше rат, rйона, тим менша енергія йонізації. Зі збільшенням z у межах одного періоду енергія йонізації збільшується. Чим менша енергія йонізації, тим більша відновлювальна активність елементу (яскравіше виражені його металічні властивості).
Внаслідок ефекту екранування у А-групах енергія йонізації зменшується зверху вниз, тоді як у В-групах – зростає (наприклад, V-В: Ванадій, Ніобій, Тантал), оскільки 6 s-електрони Танталу потрапляють під подвійний екран 5d- і 4f-електронів. Тому енергія йонізації для елементів V-А і V-B-груп закономірно змінюються:
|
5A |
As 9,81 |
5B |
V 6,74 |
|
|
Sb 8,64 |
|
Nb 6,88 |
|
|
Bi 7,29 |
|
Та 7,88 |
Електроспорідненість йонів – різниця між потенціалом йонізації І і теплотою гідратації L йонів при їх розчиненні: K = I – L.
Потенціал йонізації дорівнює енергії, яка необхідна для відриву електрона від атома під час утворення йона. Теплота гідратації (сольватації) L описує енергію гідратації йона. Різниця потенціалу йонізації і енергії гідратації характеризує здатність йона до утворення ковалентного зв'язку. При утворенні, наприклад, комплексних сполук і осадів, відбувається спочатку дегідратація йона, потім заповнення його вакантних орбіталей електронами, тобто процес, у деякій мірі зворотний гідратації і йонізації. Чим більша різниця між енергією йонізації та енергією гідратації, тим кращою є здатність йонів до асоціації або утворення хімічних сполук.
Ковалентна характеристика катіонів (К) у водних розчинах пов'язана з їх відношенням до сильно поляризованих аніонів, наприклад S![]() ,
,
РО![]() , СгО
, СгО![]() та ін., з якими вони можуть утворювати осади. За величиною К катіони можна поділити на декілька груп (таблиця 2.2).
та ін., з якими вони можуть утворювати осади. За величиною К катіони можна поділити на декілька груп (таблиця 2.2).
Сульфіди катіонів з малим значенням К розчиненні у воді, або розкладаються до гідроксидів; катіони з середнім К – нерозчинні у воді, розчинні в НСl; катіони з великим К – нерозчинні у кислотах.
Таблиця 2.2 – Класифікація катіонів за ковалентною характеристикою
|
Заряд |
значення К і група катіонів |
||
|
йона |
невелике |
середнє |
велике |
|
1 |
2 |
3 |
4 |
|
1+ |
< 126 (Na+, K+) |
– |
>126 (Cu+, Ag+) |
|
2+ |
<294 (Ва2+, Sr2+ Са2+, Mg2+) |
294 - 550 (Mn2+, Fe2+, Co2+, Ni2+) |
>550 (Cu2+, Cd2+, Hg2+ Pb2+) |
|
3+ |
<760 (Аl3+, Сг3+) |
760…970 (Fe3+) |
>970 (Вi3+, As3+, Sb3+, Sn4+) |
Енергія спорідненості до електрону (Е) – це енергетичний ефект процесу приєднання електрона до нейтрального атома з перетворенням його в негативно заряджений йон:
Є° + ![]() = Є– ± Е
= Є– ± Е
Ця енергія чисельно дорівнює енергії йонізації, але протилежна їй за знаком.
Найбільше значення енергії спорідненості до електрона мають
р-елементи VI-А, VII-А груп. Мінімальну і, навіть, від’ємну спорідненість до електрона мають атоми з електронною конфігурацією: s2, s2p6, p3.
Якщо притягальна дія ядерного поля на електрон сильніша, ніж сили відштовхування від інших електронів, то спостерігається екзоефект. Величини Е відомі лише для невеликого числа елементів, оскільки пряме їх визначення пов'язане з великими труднощами.
Якщо приєднання першого електрона для низки елементів є процесом екзотермічним, то приєднання другого електрона завжди є ендотермічним процесом. Це означає, що згідно з квантово-механічними розрахунками, неможливе приєднання двох або трьох електронів до атома. Тому прості одноатомні багатозарядні йони типу О2-, S2-, N3- та ін. у вільному стані існувати не можуть. Тому, запис формули, наприклад, Сu2+О2- є приблизним і умовним. Чим більше Е, тим більша окиснювальна активність елемента (неметалічні властивості).
Електронегативність (ЕН) – це поняття, яке дозволяє оцінити здатність атома одного елемента відтягувати на себе електронну густину порівняно з атомами інших елементів сполуки.
За пропозицією І. Маллікена ЕН можна визначити так: ![]() .
.
Існує більш ніж 20 шкал ЕН, хоча відносне розміщення елементів у ряду ЕН приблизно однакове. Полінг ввів відносну шкалу ЕН, взявши за одиницю порівняння електронегативність Літію. Тоді відносна електронегативність (ВЕН) Флуору дорівнює 4,0. Нижче наведено ВЕН для деяких елементів:
|
Н 2,1 |
Li 1,0 |
С 2,5 |
N 3,07 |
О 3,5 |
F 4,0 |
|
|
Na 0,9 |
Si 2,1 |
Р 2,06 |
S 2,5 |
Сl 3,0 |
|
|
К 0,8 |
Ge 1,7 |
|
|
Вr 2,8 |
EH – величина непостійна, залежить від валентного стану, типу сполуки і від іншого компоненту. Різниця ЕН двох атомів елементів (ΔЕН) показує частку йонності хімічного зв'язку. Наприклад, полярність зв'язку у молекулі хлороводню можна визначити за наступною формулою:
![]()
де PHCl – полярність зв'язку у відсотках; ECl - електронегативність Хлору, EH – електронегативність Гідрогену.
Підставляючи відповідні значення електронегативностей, знаходимо
![]() .
.
Якщо полярність йонного зв'язку прийняти за 100 %, а ковалентного – за нуль, то знайдені 18 % означають, що у молекулі НСl(г) зв'язок на 18 % носить йонний і на 82 % – ковалентний характер.
Атомні та йонні радіуси – величини умовні (внаслідок хвильового характеру електронів rат, rйона), їх обчислюють виходячи із атомних відстаней (при вивченні будови молекул, кристалів), які залежать від природи атомів, характеру зв'язку між ними, агрегатного стану речовини. Тому мають на увазі так звані ефективні радіуси. Зміна rат, rйона у періодичній системі носить періодичний характер. У періодах rат, rйона зменшуються (більш помітно у малих періодах). У s- і р-елементів – значніше, ніж у d- і f-елементів (внаслідок d- і f - стиснення). У групах – rат збільшується, особливо у s- і р-елементів, rат, d-елементів 5 – 6 періодів приблизно однакові, внаслідок f-стиснення. Наприклад:
|
р-елементи |
d-елементи |
||||
|
|
Z |
r, |
|
Z |
r, |
|
As |
33 |
1,48 |
V |
23 |
1,34 |
|
Sb |
51 |
1,61 |
Nb |
41 |
1,45 |
|
Bi |
83 |
1,82 |
Та |
73 |
1,46 |
Радіус негативно заряджених йонів у А-групах збільшується зверху вниз, як і радіус атома.
Радіус аніона завжди більший радіуса нейтрального атома, оскільки зі збільшенням числа електронів на кожний із них припадає все менша частка ядерного заряду, і притягання електронів до ядра послаблюється.
Радіус катіона завжди менший ніж радіус нейтрального атома, і чим більший заряд катіона тим менший радіус. У даному випадку більша частка ядерного заряду припадає на кожний електрон, що залишається, таким чином, вони сильніше притягуються до ядра.
Радіус йона має великий вплив на його основні або кислотні властивості. При збільшені радіуса йона основні властивості гідроксидів металів зростають (LiOH→KOH); у гідридів неметалів відбувається збільшення кислотних властивостей (HF→НІ). При збільшенні радіуса послаблюється взаємне притягання йонів металу і гідроксиду, що полегшує процес йонізації і підсилює основні властивості сполуки. Аналогічно при збільшені радіуса зростає здатність галогеноводневих кислот дисоціювати у розчинах на протони і аніони, сила кислот при цьому зростає. Радіус зумовлює здатність йонів до поляризації.
Таким чином, йонні радіуси змінюються у періодах і групах аналогічно атомним, отже, характер їх зміни носить періодичний характер.
У періодичній залежності від порядкового номеру елементів знаходиться дуже багато хімічних і фізичних властивостей елементів та їх сполук: атомні об'єми, температури кипіння і плавлення, питомі теплоємності, магнітні властивості, теплоти утворення сполук, енергії дисоціації та ін.
Види аналогій.
Розрізняють горизонтальну (у періодах), вертикальну (у групах), діагональну і валентну аналогії властивостей елементів. Крім того, є ще так звана вторинна та внутрішня періодичність.
Горизонтальна аналогія: у періодах (2 і 3 малих періодах) відновлювальна активність елементів зменшується, а окиснювальна зростає зліва направо:

Це пов’язано зі зменшенням rат, збільшенням І, Е та числа зовнішніх електронів. У зв'язку з цим спостерігається різка зміна властивостей елементів від металу до неметалу.
У непарних рядах великих періодів властивості елементів змінюються аналогічно: від металу до неметалу; у парних рядах розміщені метали, які мають 1 – 2 електрони на зовнішньому енергетичному рівні (відбувається забудова передостаннього рівня, d-підрівня). Тому в даному випадку не спостерігається різка зміна властивостей, хоча ряд починає активний метал з високою відновлювальною активністю.
Вертикальна аналогія: у головних підгрупах відновлювальна активність зростає, а окиснювальна – зменшується зверху вниз (оскільки зростає rат, зменшуються І, Е) у побічних підгрупах відновлювальна активність зростає у зворотному напрямку (зменшується І). Наприклад:
|
1 A |
|
відновлювальна активність зростає |
7А |
|
окиснювальна активність знижується |
5В |
|
відновлювальна активність зростає |
|
|
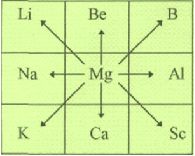
Діагональна аналогія. Д.І. Менделєєв висловив припущення про існування атомної аналогії, яка встановлює закономірність зв'язку властивостей даного елемента з властивостями елементів із сусідніх груп, періодів і діагоналі. Наприклад, Магній певними властивостями подібний до Літію, Берилію, Бору, Натрію, Алюмінію, Калію, Кальцію і Скандію. Глибокий зміст подібної "зірчатості" (термін ввів О.Е. Ферсман) полягає у взаємодії електронної конфігурації атома з його ядром. Розрізняють малу (B-Si, Be-Al) і велику діагональну аналогію ( Ti-Nb, Ca-La). |
Глибокий зміст подібної "зірчатості" (термін ввів О.Е. Ферсман) полягає у взаємодії електронної конфігурації атома з його ядром.
Розрізняють малу (B-Si, Be-Al) і велику діагональну аналогію ( Ti-Nb, Ca-La).
Валентна аналогія. Роботи Д.І. Менделєєва, присвячені вдосконаленню періодичної системи, дозволили виявити "подвійні подібні відношення" між елементами: підгрупа елементів Be, Mg, Са, Sr, Ba подібна з підгрупою Zn, Cd, Hg, тобто вони повинні складати одну групу (у даному випадку за валентністю).
Розрізняють також й іншу валентну аналогію, наприклад: Mg![]() Mn2+, К+ і Тl
Mn2+, К+ і Тl![]() , що пояснюється подібністю будови електронних оболонок, близькими значеннями rат i rйона, а також подібними просторовими і електростатичними характеристиками еквізарядних йонів (у кристалічній гратці і у розчині).
, що пояснюється подібністю будови електронних оболонок, близькими значеннями rат i rйона, а також подібними просторовими і електростатичними характеристиками еквізарядних йонів (у кристалічній гратці і у розчині).
На основі теорії будови атомів було встановлено причину періодичної зміни властивостей елементів у системі, а саме: властивості елементів, а також форми і властивості їхніх сполук знаходяться в періодичній залежності від заряду ядер і структури електронної оболонки їх атомів.
Зміна кислотно-основних властивостей: у А-групах основні властивості зростають зверху вниз (наприклад, в І-А, R-OH), кислотна активність також збільшується зверху вниз (наприклад, в VII-А, Н-Hal), що зумовлено збільшенням радіусу йона. Сила безоксигенових кислот збільшується у періодах зліва направо (зі зменшенням заряду En-). Наприклад, НСl як кислота сильніша, ніж H2S.
Сила оксигеновмісних кислот також зростає у цьому напрямку, що пов’язано зі збільшенням заряду Е+. Наприклад, у ряду:
![]() <
< ![]() <
< ![]()
Із загальної формули кислот: ![]() видно, що сила кислот зростає зі збільшенням Е+, m і зменшенням n. Наприклад:
видно, що сила кислот зростає зі збільшенням Е+, m і зменшенням n. Наприклад:
![]() >
> ![]() або
або ![]() >
> ![]() , оскільки зростає Е+ і число m;
, оскільки зростає Е+ і число m;
![]() >
> ![]() або
або ![]() >
> ![]() , оскільки збільшується m і зменшується n.
, оскільки збільшується m і зменшується n.
Вторинна періодичність – це періодична, а не монотонна зміна властивостей елементів та їхніх сполук у межах однієї підгрупи. В межах однієї підгрупи періодично змінюються енергії йонізації, атомні радіуси та інші властивості й характеристики елементів.
Вторинна періодичність найбільш чітко виявляється в зміні ентальпій утворення оксидів елементів ІІІ (E2O3), IV (EO2), V (E2O5) та VI (EO3) головних груп періодичної системи елементів. Дійсно, в кожній підгрупі стійкість вищих оксидів, наприклад у ряду СO2 – SiO2 – GeO2 – SnO2 – PbO2, змінюється періодично. При цьому можна виділити низку більш стійких оксидів-аналогів (SiO2, SnO2) та менш стійких (CO2, GeO2, PbO2) в ряду яких стабільність в цілому зменшується.
Типовим прикладом вторинної періодичності може бути кількість та стійкість оксигеновмісних сполук галогенів. Так, для Флуору не характерне утворення сполук з Оксигеном, а ті, що існують (OF2 та O2F2), нестійкі. Хлор утворює більше число сполук з оксигеном (ClO2 – Cl2O6 – Cl2O7), які стійкі за звичайних умов. Для брому знову не характерне утворення сполук з Оксигеном, а ті, що є (Br2O та BrO2), за звичайних умов розкладаються. Наступний елемент (Йод) знову утворює декілька стійких оксидів (J2O4, J2O5, J4O9). Отже здатність до утворення сполук з Оксигеном у підгрупі галогенів змінюється не монотонно, а періодично.
Внутрішня періодичність полягає в тому, що властивості елементів та їхніх сполук у горизонтальних рядах змінюються не монотонно, а періодично. Для великих періодів внутрішня періодичність виявляється в деякому посиленні металічних властивостей в середині періоду на фоні загального їх послаблення. При цьому максимальна металевість у середині періоду припадає на елементи однієї групи: Cu, Ag, Au. Така періодичність дозволила розділити великі періоди на ряди. Внутрішня періодичність зумовлена особливістю заповнення електронами орбіталей. Оскільки d- і f-орбіталі є внутрішніми, то їх заповнення призводить до екранування зовнішніх електронних оболонок від ядра і відповідно до зменшення розмірів атомів (d-, f-стиснення), що і викликає немонотонну зміну властивостей елементів у підгрупах зверху вниз.