Тема 5 Розчини і способи вираження їх концентрації
План
5.1 Основні поняття в теорії розчинів
5.2 Сольватна (гідратна ) теорія Д.І. Менделєєва
5.3 Концентрація розчинів і способи її вираження
5.4 Розчинність та її залежність від зовнішніх умов
5.5 Властивості розчинів. Розчини неелектролітів
5.1 Основні поняття в теорії розчинів
Дисперсні системи - це системи, які складаються із двох або більше компонентів (речовин), один із яких (дисперсна фаза) рівномірно розподілений в іншому (дисперсійне середовище) у вигляді дрібних частинок.
Система може складатися із речовин різної природи і різного агрегатного стану (наприклад: вода-лід-пара).
За ступенем дисперсності (величиною частинок дисперсної фази) розрізняють:
а) грубодисперсні системи – це системи, в яких розмір частинок дисперсної фази 1 мкм (мікрометр, 1 мкм = 10-6 м) і більше; до них належать суспензії (наприклад, крейда у воді) і емульсії (наприклад, масло у воді);
б) дрібнодисперсні системи – це колоїдні розчини, розмір частинок дисперсної фази в яких коливається в межах 1,0…0,1 мкм; (наприклад, розчин клею, желатини, сироватка крові, туман, дим); для них характерне явище Тіндаля, опалесценції (світлорозсіювання);
в) істинні (молекулярні) розчини – це системи, в яких розчинена речовина знаходиться у вигляді молекул або йонів (1 нм і менше).
Розчинами називають гомогенні (однорідні), термодинамічно стійкі системи змінного складу із двох або більше компонентів.
Розчини займають проміжний стан між хімічними сполуками і механічними сумішами. Склад розчинів в деякому інтервалі концентрацій, температур і тиску може змінюватися безперервно. Відсутність сталості складу і неможливість застосування законів стехіометрії наближує розчин до механічної суміші. Їхня подібність до хімічних сполук полягає в однорідності, значних об’ємних і енергетичних ефектах, якими супроводжується процес розчинення більшості речовин.
Розчини бувають газовими (повітря), рідкими (морська вода) і твердими (сплави). Найбільше практичне значення мають рідкі розчини (у хімії, біології, медицині, промисловості та ін.).
Розчини складаються із розчинника і розчиненої речовини (речовин), хоча ці поняття умовні, але прийнято вважати для розчинів газів і твердих речовин у рідині, що рідина є розчинником. У інших випадках розчинником вважається той компонент, якого більше.
5.2 Сольватна (гідратна ) теорія Д.І. Менделєєва
Перехід із індивідуального стану в розчин супроводжується зміною структури компонентів і властивостей системи, про що свідчать теплові (ΔН) і об'ємні (ΔV) ефекти при розчиненні. Так, із 1 л абсолютного спирту і 1 л води одержують 1,93 л (25 °С) суміші, а не 2 л. Зменшення об'єму (контракція) обумовлено, головним чином, утворенням водневих зв'язків і руйнуванням льодоподібної структури води.
В результаті змішуванні спирту і діазометану об'єм збільшується.
Розчинення завжди супроводжується взаємодією розчиненої речовини з розчинником. Такий процес називають сольватацією (у випадку води – гідратацією). Теорія розроблена Д.І.Менделєєвим і відома під назвою хімічної або сольватної (гідратної) теорії розчинів. Встановлено існування гідратів складу: H2SO4∙Н2О, H2SO4∙2Н2О, H2SO4∙4Н2О та ін.
Таким чином, на відміну від фізичної теорії розчинів (Вант-Гофф, С. Арреніус), яка розглядала розчинник як індиферентне середовище (без врахування міжмолекулярної взаємодії), сольватна (гідратна) теорія враховує взаємодію розчиненої речовини з розчинником з утворенням сольватів (гідратів) за рахунок міжмолекулярної взаємодії, йонно-дипольних і водневих зв'язків.
Наприклад, сполуки з йонним зв'язком і молекули розчинника взаємодіють за рахунок сил йоно-дипольних зв'язків (рисунок 5.1), в результаті чого катіони гідратуються за донорно-акцепторним механізмом, а аніони-за рахунок водневих зв'язків. Наприклад:
![]()
Диполь-дипольна взаємодія має місце при розчиненні речовин з молекулярною структурою (рисунок 5.2).
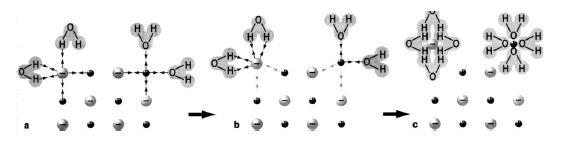
а) молекули води наближаються до йонів, які утворюють кристал; b) йони притягуються до полярних молекул води; c) йони, повністю оточені молекулами води (гідратовані), переходять в розчин
Рисунок 5.1 – Механізм розчинення кристалу речовини йонної будови
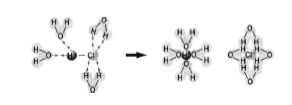
Рисунок 5.2 – Механізм йонізації молекули НCl
Термін сольватація відноситься частіше до неводних розчинників, він більш універсальний ніж термін гідратація. Під сольватацією розуміють сукупність енергетичних і структурних змін у розчині при взаємодії розчиненої речовини з молекулами розчинника.
5.3 Концентрація розчинів і способи її вираження
Поряд з температурою і тиском, основним параметром стану розчину є концентрація – вміст розчиненої речовини у певній масі або об'ємі розчину або розчиннику.
Основними способами вираження концентрації розчинів є:
Масова частка (W) – це відношення маси розчиненої речовини до маси розчину:
![]() або
або ![]() (5.1)
(5.1)
де m1 – маса розчинника, г; m2 – маса розчиненої речовини, г;
Наприклад: у 250 г води розчинили 50 г FeSO47H2O. Обчислити відсотковий вміст в розчині кристалогідрату та безводної солі.
Розв’язування:
Масова частка ![]() ;
; ![]()
mрозчину = 250 + 50 = 300 г; W1 = ![]() = 16,7%
= 16,7%
Обчислимо вміст безводної солі FeSO4в 50 г кристалогідрату (FeSO47H2O):
М (FeSO47H2O) = 278 г/моль; М (FeSO4) = 152 г/моль;
Складаємо пропорцію:
в 278 г FeSO47H2O міститься 152 г FeSO4
в 250 г х г
![]() тоді
тоді ![]() .
.
Молярна концентрація (СМ) – це кількість молів розчиненої речовини в 1 л розчину;
![]() (5.2)
(5.2)
Наприклад: обчислити молярну концентрацію 1 л 36,2% розчину HCl, густиною 1,18 г/мл.
Розв’язування: ![]() , моль/л;
, моль/л;
Знайдемо mрозчину за формулою m = V∙ρ: m(р-ну) = 1000∙1,18 = 1180 г;
Маса НCl, яка міститься в 36,2% розчині дорівнює
![]() г
г
Знаходимо кількість молів НСl: М (НСl) = 36,5 г/моль;
![]()
![]()
Звідки ![]() .
.
- Моляльна концентрація (Сm) – це кількість молів розчиненої речовини в 1 кг (1000 г) розчинника, наприклад, води:
![]() , (5.3)
, (5.3)
де m1 і m2 – маса розчинника і розчиненої речовини відповідно, М2 – молярна маса розчиненої речовини;
- Молярна частка (N2) – це відношення кількості молів розчиненої речовини (n2) до загальної кількості молів у системі. Для бінарного розчину
![]() (5.4)
(5.4)
Наприклад: знайти моляльність і мольну частку розчиненої речовини в 67% розчині сахарози (С12Н22О11).
Маса С12Н22О11, яка міститься в 100 г 67%-ного розчину дорівнює
![]() г.
г.
Враховуючи, що М (С12Н22О11) = 342 г/моль знаходимо Сm:
![]() .
.
Знаходимо кількість молів С12Н22О11:
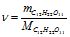
![]() .
.
Знаходимо кількість молів H2O (в 100 г розчину 67 г С12Н22О11 і 33 г H2O), враховуючи, що М (Н2О) = 18 г/моль:
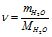
![]() .
.
Звідки ![]() .
.
- Молярна концентрація еквіваленту (СН) або нормальність (N, n) – це кількість моль-еквівалентів розчиненої речовини в 1 л розчину,
моль-екв/л:
![]() (5.5)
(5.5)
де meкв – еквівалентна маса, г/(мольекв.) m2 – маса розчиненої речовини (г) в 1 л розчину, V – об’єм розчину (л).
Наприклад: обчислити нормальність 15%-ного розчину H2SO4 об’ємом 1 л, густиною 1,10 г/мл.
Розв’язування:
Знайдемо mрозчину за формулою m = V∙ρ: m(р-ну) = 1000∙1,10 = 1100 г;
Маса H2SO4, яка міститься в 15% розчині дорівнює
![]() г
г
Еквівалентна маса H2SO4 дорівнює ![]() г/моль Знаходимо кількість молів еквівалентів H2SO4:
г/моль Знаходимо кількість молів еквівалентів H2SO4:
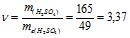 г/моль, тоді
г/моль, тоді 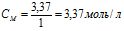
- Титр розчину (Т) – це маса розчиненої речовини, яка міститься у 1 мл розчину:
![]() або
або ![]() (5.6)
(5.6)
де Сн – еквівалентна концентрація розчиненої речовини, (моль-екв/л); Мeкв – еквівалентна маса, (г/моль-екв); m – маса розчиненої речовини (г); V – об’єм розчину (мл).
При переході від одного способу вираження концентрації до іншого користуються формулами:
![]() ;
; ![]() ;
; ![]() ;
; ![]()
5.4 Розчинність та її залежність від зовнішніх умов
Розчинність – це здатність речовини розчинятися у тому чи іншому розчиннику. Розчинність речовини вимірюється концентрацією її насиченого розчину і виражається значенням коефіцієнта розчинності, або масою речовини, яка розчиняється за даних умов у 100 грамах розчинника з утворенням насиченого розчину.
Процес розчинення пов'язаний з дифузією, тобто самодовільним розподілом частинок однієї речовини між частинками іншої (ΔG° < 0) і розчин залишається ненасиченим до того часу, доки у системі не настає стан рівноваги (ΔН° = ТΔS°, звідси ΔG° = 0). Розчин стає насиченим (за даних умов і може існувати невизначено довго). Перенасичений розчин – розчин, концентрація якого вище концентрації насиченого розчину за даних умов (Т і Р). Для них ΔG° > 0, тому вони нестійкі і легко перетворюються у насичені (виділяючи надлишок речовини в осад).
Розчинність речовини наводиться у спеціальних таблицях або у вигляді кривих розчинності, які показують залежність між розчинністю і температурою.
Якщо ввести в систему, яка складається з двох рідин, що не змішуються між собою, розчинну в них речовину, то вона розподілиться між цими рідинами таким чином (за даних Т і Р), що її концентрація у цих розчинниках С1 і С2 буде незмінною: С1/С2 = К, де К – константа рівноваги або коефіцієнт розподілу, а саме рівняння – це закон розподілу: у двохфазній рідкій системі (за постійних зовнішніх умов) незалежно від попередньої кількості розчиненої речовини, відношення концентрації її в обох фазах є величина постійна. На цьому законі ґрунтується процес екстрагування (витягування) розчиненої речовини з одного розчинника в інший – екстрагент. Наприклад, для системи J2, H2O і СНCl3, К = 130, це означає, що концентрація йоду у такій системі у СНCl3 буде у 130 разів більшою, ніж у воді.
Розчинність залежить від трьох чинників: природи речовини, її агрегатного стану і зовнішніх умов (Т, Р та ін.).
До теперішнього часу відсутня єдина теорія, за допомогою якої можна було б передбачити і обчислити розчинність. Багатовіковий досвід виробив правило – подібне розчиняється в подібному. Наприклад, розчинність неполярних і мало полярних речовин у полярних розчинниках (вода) є невеликою.
Розчинність солей у воді залежить від різниці енергії кристалічної ґратки і енергії гідратації йонів, обчислити яку з достатньою точністю не завжди можливо. Тому часто на практиці користуються емпіричними закономірностями. Добре розчинні нітрати, галогеніди (крім AgCl, Hg2Cl2 HgCl2, PbCl2), сульфати (крім CaSO4, SrSO4, BaSO4, PbSO4), невелика розчинність сульфідів (крім Na2S, K2S), карбонатів (крім CaCO3, SrСОз), фосфатів (крім Na3PO4 , (NH4)3PO4), гідроксидів перехідних металів (див. таблицю розчинності).
Розчинність газів у рідинах – процес екзотермічний (виняток – розчинення благородних газів у деяких органічних розчинниках), тому за принципом Ле - Шательє:
Газ + рідина ![]() насичений розчин газу в рідині
насичений розчин газу в рідині
а) при нагріванні рівновага зміщується вліво, при охолодженні – вправо;
б) оскільки у даній системі ΔV<0, то підвищення тиску зміщує рівновагу вправо (>![]() ). Ця залежність для малорозчинних речовин виражається законом Генрі (1802 р.): "розчинність газу за постійної температури пропорційна його тискові"; С = К1 ∙ Р, де С – масова концентрація газу в насиченому розчині; Р – парціальний тиск газу; К1 – коефіцієнт пропорційності (константа Генрі).
). Ця залежність для малорозчинних речовин виражається законом Генрі (1802 р.): "розчинність газу за постійної температури пропорційна його тискові"; С = К1 ∙ Р, де С – масова концентрація газу в насиченому розчині; Р – парціальний тиск газу; К1 – коефіцієнт пропорційності (константа Генрі).
Можливі три варіанти розчинності рідин у рідинах:
а) необмежена розчинність, наприклад, вода-спирт, вода-ацетон та ін.;
б) обмежена розчинність, наприклад, етер-вода, хлороформ-вода;
в) практично повна нерозчинність, наприклад, нафта-вода.
5.5 Властивості розчинів. Розчини неелектролітів
Розчин має властивості відмінні від властивостей чистого розчинника. Більшість із них, такі як смак, колір, запах, кислотність або лужність та ін залежать від природи розчиненої речовини, тоді як деякі інші залежать виключно від кількості розчиненої речовини і не залежать від її природи. Такі властивості називаються колігативними. Найбільш важливі із них:
- зниження тиску пари над розчином;
- підвищення температури кипіння розчину;
- зниження температури замерзання;
- осмотичний тиск.
Зниження тиску пари. Розчин, що містить не летку розчинену речовину має завжди тиск пари над розчином нижчий ніж над чистим розчинником.
В математичному вираженні: Р = Р0∙N1, де Р0 і Р відповідно тиск пари чистого розчинника і розчиненої речовини, N1 – мольна частка розчиненої речовини. Так як N1 < 1, тому Р < Р0. З моменту коли N1 + N2 =1 (де N2 – мольна частка розчинника) тиск пари можна представити як: Р = (1–N1)Р0, звідки Р = Р0 – Р0N1 , або ΔР = N1∙Р0.
Таким чином, зниження тиску пари над розчином пропорційне мольній частці розчиненої речовини (1-ий закон Рауля).
Тиск пари залежить від властивостей молекул поверхні покидати рідкий стан. В розчині, присутність частинок розчиненої речовини, незалежно від її властивостей, гальмує рух частинок розчинника, таким чином розчин покидає менша кількість молекул.
Розчин може досягнути такого ж тиску пари над розчином як і чистий розчинник тільки у випадку, якщо молекули розчинника зможуть подолати перешкоду, яку їм чинять молекули розчинника, тобто за вищої температури.
Отже, розчин кипить при вищій температурі, ніж чистий розчинник, ця властивість називається ебуліоскопічним підвищенням (2-ий закон Рауля).
Математичне вираження: ΔТеб = Кеб∙Сm, де Сm – моляльність розчину, ΔТеб – підвищення температури кипіння розчину (температура кипіння розчину мінус температура кипіння чистого розчинника) і
Кеб – ебуліоскопічна постійна (для різних розчинників має різні значення, наприклад для води 0,52 °С·моль-1·кг).
Інша властивість розчинів називається кріоскопічним зниженням – розчини замерзають при температурі нижчій, ніж чистий розчинник (2-ий закон Рауля). Це пояснюється тим, що частинки розчинника перешкоджають нормальному переходу в упорядкований стан, яким є твердий стан розчинника.
Математичне вираження: ΔТкр = Ккр∙Сm, де Сm – моляльність розчину, ΔТкр – зниження температури замерзання розчину (різниця між температурою замерзання розчинника і чистого розчинника) і
Ккр – кріоскопічна постійна (залежить від природи розчинника, для води 1,68 С°·моль-1·кг).
На вимірюванні ΔТеб і ΔТкр розчинів ґрунтуються ебуліоскопічні і кріоскопічні методи визначення молекулярної маси розчиненої речовини, а отже її ідентифікації.
Якщо з’єднати розчин і чистий розчинник за допомогою напівпроникної мембрани (а), то молекули розчинника будуть переходити через неї в розчин до тих пір доки рівень рідини над розчином не підніметься на певну висоту h (б), що створить більший тиск, який буде перешкоджати подальшому переходу. Щоб запобігти переходу частинок розчинника в розчин необхідно застосувати до розчину зовнішній тиск (с) (рисунок 5.3)
Одностороннє спонтанне переміщення (дифузія) молекул розчинника через мембрану в розчин називається осмосом. А осмотичний тиск – це гідростатичний тиск, який запобігає спонтанному переходу молекул розчинника через напівпроникну мембрану в свій розчин. Величина осмотичного тиску залежить від концентрації розчину і від його температури.
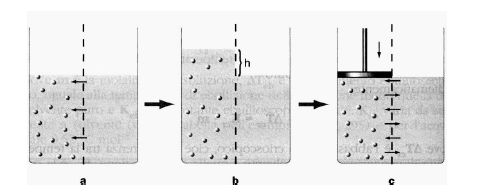
а, б – виникнення осмотичного тиску; с – подолання осмотичного тиску
Рисунок 5.3 – Осмотичний тиск
Математичне вираження осмотичного тиску Росм відоме як рівняння Вант-Гоффа:
![]() , (5.7)
, (5.7)
де m і M – відповідно маса та молярна маса розчиненої речовини; R – універсальна газова стала Больцмана; T – абсолютна температура; V – об’єм розчину.
Це рівняння дає можливість визначити молекулярну масу розчиненої речовини за величиною осмотичного тиску.
Осмос має важливе значення в житті живих організмів, так як визначає розподіл розчинних речовин і води в тканинах і клітинах. Наприклад, коли зменшується вміст води в організмі виникає почуття спраги, яку людина втамовує за рахунок пиття великої кількості води, при цьому відновлюється водно-сольова рівновага і осмотичний тиск плазми крові.
Напівпроникну перегородку мають еритроцити. У дуже концентрованому розчині (рисунок 5.4 а) еритроцити втрачають воду, зменшуючись в об’ємі, у слабко концентрованому – набухають (рисунок 5.4 б), а при попаданні в воду лопаються (рисунок 5.4 в) (гемоліз).
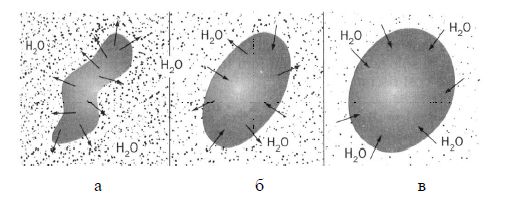
а – втрата води еритроцитами в концентрованому розчині; б – набухання еритроцитів в слабко концентрованому розчині; в – гемоліз еритроцитів
Рисунок 5.4 – Осмос еритроцитів
Вихід води із клітин в концентрований розчин називається плазмолізом. Розчини з осмотичним тиском, рівним осмотичному тиску стандартного розчину, називаються ізотонічними, а з більш високим – гіпертонічними і з більш низьким – гіпотонічними. Осмотичний тиск плазми крові у людини становить 8,1·105 Па (8 атм.).
Завдяки осмотичному тиску вода піднімається по капілярах у стеблах рослин на значну висоту. Від осмотичного тиску залежить всмоктувальна сила клітини, яка у насінні становить за 6%-ній вологості навколишнього середовища 4,05·107 Па (400 атм.). Це забезпечує необхідну для проростання насіння кількість води, що поглинається навіть із порівняно сухого ґрунту. В той же час на солонцюватих ґрунтах не всі рослини можуть проростати через існуючий там обернений осмос, тобто виведення води із насіння в ґрунт.
Обернений осмос використовують у техніці для опріснення морської води, очистки стічних вод. Якщо до розчину прикласти тиск, більший за осмотичний, то молекули розчинника будуть рухатися через напівпроникну перегородку із розчину, тобто в зворотному до осмосу напрямку.