Тема 6 Властивості розчинів електролітів. Протолітична теорія кислот і основ
План
6.1 Властивості розчинів електролітів
6.2 Рівновага в розчинах електролітів
6.3 Дисоціація води. Йонний добуток води. Водневий показник
6.4 Поняття про буферні розчини
6.5 Протолітична теорія кислот і основ
6.6 Гідроліз солей
6.1 Властивості розчинів електролітів
За здатністю речовин в розчиненому або розплавленому вигляді проводити електричний струм їх поділяють на електроліти (кислоти, основи, солі) і неелектроліти (спирти, етери, вуглеводи та ін.). Електроліти – це речовини розчини або розплави яких проводять електричний струм, тоді як розчини або розплави неелектролітів його не проводять.
Для розчинів електролітів характерні такі ж властивості, як і для розчинів неелектролітів, але експериментально виміряні величини осмотичного тиску, температур кипіння та замерзання та ін. значно більші, ніж розраховані за відповідними математичними рівняннями. Вант-Гофф не зміг пояснити причину цього явища, але запропонував використовувати в обчисленнях поправку – ізотонічний коефіцієнт (І). Його можна отримати із наступних відношень:
![]() (6.1);
(6.1); ![]() (6.2)
(6.2)
ΔТеб. = І·Кеб Сm (6.3); ΔТкр. = І·Ккр Сm (6.4)
Відхилення від законів Вант-Гоффа і Рауля характерні для розчинів електролітів привели до створення теорії електролітичної дисоціації шведським вченим С.Арреніусом (1887 р.). Він пояснив причини цих відхилень тим, що молекули електролітів у розчинах розпадаються на йони. Тому зростає загальна кількість частинок в розчині і збільшується величина осмотичного тиску, температура кипіння та замерзання розчинів. Арреніус показав, що ізотонічний коефіцієнт із розбавленням розчину зростає, наближаючись до цілих чисел. (2, 3, 4). Присутність заряджених позитивно (катіонів) і негативно (аніонів) частинок Арреніус пояснив електропровідністю електролітів.
Головні положення теорії електролітичної дисоціації зводяться до наступного:
а) при розчиненні у воді електроліти дисоціюють (розпадаються на позитивно і негативно заряджені частинки (йони); при цьому сума позитивних і негативних зарядів однакова (розчин залишається електронейтральним);
б) під впливом електричного струму катіони рухаються до катода (негативно заряджений електрод), а аніони до анода (позитивно заряджений електрод);
в) атоми і йони відрізняються за фізичними, хімічними і біологічними властивостями;
г) не всі електроліти в однаковій мірі розпадаються на йони, що залежить від природи електроліту, концентрації, характеру розчинника і температури.
Отже, дисоціація за Арреніусом – це розпад молекул електроліту на йони. Для кількісної характеристики співвідношення дисоційованих і недисоційованих молекул електроліту за даних умов використовують поняття ступінь дисоціації – відношення кількості молекул електроліту, які розпалися на йони (Х) до загальної кількості молекул у розчині (n):
α=Х/n·100%. (6.5)
Ступінь електролітичної дисоціації (α) можна визначити за осмотичним тиском, підвищенням або зниженням температури кипіння чи замерзання розчину. Відношення експериментально встановлених значень цих величин до обчислених теоретично за рівняннями для розчинів неелектролітів показує, у скільки разів число частинок у розчині електроліту більше загального числа розчинених молекул. Якщо концентрація розчину С, ступінь електролітичної дисоціації – α, число йонів, одержаних при дисоціації – n, тоді Сα буде показувати число молекул, які продисоціювали, а (С - Сα) – число недисоційованих молекул, Сαn – число йонів. Загальне число частинок у розчині буде дорівнювати:
С - Сα + Сαn = С[1 + α(n-1)] (6.6)
![]() або
або ![]() (6.7)
(6.7)
За ступенем дисоціації електроліти поділяються на:
сильні – α>30% (кислоти: HCl, H2SO4, HNO3, луги NaOH, KOH, майже всі солі)
середні – 3%<α<30% (H2SO3, H3PO4)
слабкі – α<3% (H2S, H2СO3, H3BO3, NH3, H2O).
Ступінь дисоціації залежить:
- від природи електроліту;
- від природи розчинника;
за законом Кулона сила взаємодії між зарядженими частинками F дорівнює
![]() , (6.8)
, (6.8)
де е1 і е2 – заряди йонів; ε –діелектрична проникненість (величина, яка показує, у скільки разів сили взаємодії між двома зарядами в даному середовищі менші, ніж у вакуумі); r – відстань між йонами. Чим вища діелектрична проникненість, тим більше значення ступеня дисоціації. Наприклад, розчин HCl у воді – сильний електроліт, а у бензені – неелектроліт.
- від температури (дисоціація ендотермічний процес, тому з підвищенням температури, ступінь дисоціації зростає);
- від концентрації розчину (зі зменшенням концентрації ступінь дисоціації зростає);
- від добавки в електроліт однойменно заряджених йонів, що призводить до зниження ступеня дисоціації
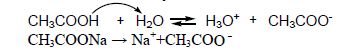
Добавка до розчину натрій ацетату, що містить СН3СОО– - йони, згідно з принципом Ле-Шательє, зміщує рівновагу вліво (у бік утворення недисоційованих молекул СН3СООН), тому значення α зменшується.
Дисоціація – процес оборотний (за винятком дисоціації сильних електролітів), тому для неї справедливі загальні закони рівноваги (принцип Ле-Шателье).
6.2. Рівновага в розчинах електролітів
У розчині слабкого електроліту встановлюється рівновага між йонами і недисоційованими молекулами:
КА = К+ + А-, тоді ![]() (6.9)
(6.9)
де К - константа рівноваги або константа дисоціації, а [K+], [A -], [KA] – рівноважні концентрації відповідно катіона, аніона і недисоційованих молекул.
Взаємозв’язок між К, α і С виражається законом розведення Оствальда:
![]() (6.10)
(6.10)
якщо α < 5%, то К = Сα2 звідки
![]() , а
, а ![]() (6.11)
(6.11)
Якщо у розчині бінарного електроліту КА ступінь його дисоціації дорівнює α, то концентрація йонів К+ і А– буде однаковою і складе:
[K+] = [A![]() ] = αC, оскільки
] = αC, оскільки ![]() , тоді: [K+] = [A
, тоді: [K+] = [A![]() ] =
] =![]() =
= ![]() звідки
звідки
Сйона = ![]() (6.12)
(6.12)
Отже: при збільшенні концентрації розчину слабкого електроліту ступінь дисоціації зменшується, і навпаки, при розбавленні розчину – зростає.
Величина К залежить від характеру хімічного зв'язку у молекулі сполуки, яка дисоціює. Наприклад, в ряду:
CH3COOH < ClСН2 СООН < Cl2СН СООН < Cl3ССООН
К зростає, що пояснюється відтягуванням електронів від карбоксильної групи електронегативним атомом Хлору.
Константа йонізації К – характерна величина для даного електроліту і розчинника, залежить від температури, яка впливає на гідратацію йонів і нейтральних молекул.
Силу електроліту краще характеризувати за величиною К або рК – показник константи дисоціації або силовий показник електроліта:
рК = -lg K (6.13)
рК < 0 - дуже сильні електроліти;
рК 0....4,5 - сильні або середньої сили;
рК 4,5....9 - слабкі електроліти;
рК 9....14 - дуже слабкі електроліти;
рК > 14 - надзвичайно слабкі електроліти.
Якщо відома рКа (кислоти), то можна обчислити рКв (основи):
рКа + рКb = 14; тоді рКb = 14 – рКа
Розчини сильних електролітів практично повністю дисоціюють у водних розчинах. Для бінарних електролітів типу NaCl можна було б чекати, що ізотонічний коефіцієнт дорівнюватиме двом. Однак, цього не спостерігається, так як йони взаємодіють в розчині один з одним завдяки значним силам електростатичної взаємодії, яка підсилюється зі збільшенням концентрації (зменшується відстань між йонами). В розчині кожний йон утворює навколо себе угрупування йонів протилежного знаку – йонну атмосферу, а сольватація (гідратація) йонів призводить до зміни властивостей не тільки самих йонів, а і властивостей розчинника, що впливає на швидкість переміщення молекул в електричному полі (зниження електропровідності зі збільшенням концентрації).
Тому розчини сильних електролітів характеризуються, так званим, уявним ступенем дисоціації. Льюіс (США, 1907 р.) ввів поняття про активну (ефективну) концентрацію – активність (а) –величина, яку можна підставити у рівняння закону дії мас і це зробить його справедливим для сильних електролітів:
![]() , (6.14)
, (6.14)
де f – коефіцієнт активності (безрозмірна величина); Сm – моляльна концентрація розчину.
Для дуже розбавлених розчинів (С > 10-4), f = 1, тоді а = С.
f вносить поправку на взаємодію даного йона з оточуючим середовищем. Коефіцієнт активності визначають за теорією сильних електролітів Дебая і Хюккеля (1923 р.). f залежить від йонної сили розчину (міри електростатичної взаємодії між йонами):
lgf = -0.52z2![]() , (6.15)
, (6.15)
де z – заряд йону; М – істинна сила розчину (![]() – половина суми добутків концентрації всіх йонів на їх заряд в квадраті).
– половина суми добутків концентрації всіх йонів на їх заряд в квадраті).
Реакції обміну між йонами відбуваються з великими швидкостями. Зміщення рівноваги у бік утворення продуктів реакції спостерігається у тому випадку, коли реакції супроводжуються утворенням газоподібних (летких) речовин (а), слабких електролітів (б), комплексних йонів (в) і осадів (г) (за правилом Бертолле). Наприклад:
а) СаСО3(к) + 2HCl(р) → СаCl2(тв) + СO2(г) + H2О(г);
CaCО3 + 2Н![]()
![]() Са2+ + СО2 + Н2О;
Са2+ + СО2 + Н2О;
6) NaOH(p) + НСl(Р) → NaCl(p) + H2O(P);
H![]() +OH
+OH![]()
![]() H2O;
H2O;
в) CuSO4(кр) + 4NH3·H2O(P) → [Cu(NH3)4]SО4(р)+4H2O;
Cu2+ + 4NH3·H2O ![]() [Cu(NH3)4]2+ + 4H2O;
[Cu(NH3)4]2+ + 4H2O;
г)ВаСl2(р) + Na2SO4(к) → BаSO4(к) + 2NaCl(p);
Ba![]() + SO
+ SO![]()
![]() BaSO4
BaSO4
Якщо кристали малорозчинної солі побудовані із йонів, то у розчин переходять не молекули, а йони солі. Для малорозчинної сполуки, наприклад BaSO4 або AgCl, що перебуває у рівновазі із своїм насиченим розчином, рівняння динамічної рівноваги матиме вигляд: BaSO4 ![]() Bа2++ SO
Bа2++ SO![]() , тобто за сталої температури в одиницю часу у розчин переходить така кількість солі, яка в той же самий час із розчину випадає в осад.
, тобто за сталої температури в одиницю часу у розчин переходить така кількість солі, яка в той же самий час із розчину випадає в осад.
Для наведеного вище процесу за сталої температури можна записати:
[Bа2+][SO![]() ] =K, де К – константа рівноваги.
] =K, де К – константа рівноваги.
З вище наведеного рівняння випливає, що у насиченому при певній температурі розчині добуток концентрації йонів малорозчинного електроліту є сталою величиною, яка називається добутком розчинності.
ДРBaSO4 = [Ba2+] [SO![]() ]
]
У загальному вигляді вираз добутку розчинності насиченого розчину малорозчинної речовини КхАу, що розпадається на йони за рівнянням
КхАу ![]() хКу+ + уАх-, матиме вигляд:
хКу+ + уАх-, матиме вигляд:
![]() (6.16)
(6.16)
Виходячи із значень ДР, можна порівнювати розчинність різних сполук, які дисоціюють на однакове число йонів. Знаючи ДР, можна знайти концентрацію йонів, або солі в насиченому розчині, тобто розчинність цієї солі:
AgSCN ![]() Ag+ + SCN–,
Ag+ + SCN–,
ДРAgSCN = [Ag+][SCN–]=1.16·10-12, звідки
[Ag+] = [SCN–] = ![]() = 1,08·10-6 моль/л, тобто
= 1,08·10-6 моль/л, тобто
[AgSCN]=1,08·10-6.
Оскільки ДР за певної температури є сталою величиною, то збільшення концентрації у розчині одного із йонів, на які дисоціює сполука, призводить до зменшення концентрації другого. Так, якщо до насиченого розчину BaSO4 добавити розчин сполуки, яка містить йон SO![]() , то рівновага порушується, і згідно з принципом Ле-Шателье, вона зміститься вліво, тобто з розчину почне випадати BaSO4. Те саме відбудеться і при введенні в насичений розчин BaSO4 надлишку йонів Ва2+.
, то рівновага порушується, і згідно з принципом Ле-Шателье, вона зміститься вліво, тобто з розчину почне випадати BaSO4. Те саме відбудеться і при введенні в насичений розчин BaSO4 надлишку йонів Ва2+.
Отже введення однойменних йонів в розчин малорозчинного електроліту знижує його розчинність. Цей висновок має велике практичне значення, зокрема у кількісному аналізі, оскільки дає змогу практично повністю осаджувати той чи інший йон у вигляді малорозчинної сполуки. Таким чином, рівняння реакцій, які відбуваються у водних розчинах раціонально записувати в йонній формі, враховуючи, що малорозчинні, малодисоційовані речовини необхідно записувати в молекулярній формі.
6.3. Дисоціація води. Йонний добуток води. Водневий показник
Вода є типовим амфолітом. Це – слабкий електроліт, який у незначній мірі розпадається на йони (схематично): H2O ![]() Н+ + ОН–
Н+ + ОН–
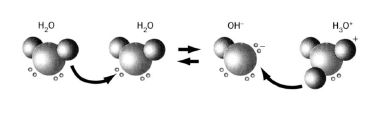
Константа рівноваги реакції дисоціації води: ![]() = [Н+]∙[ОН–]/[Н2О] за 22 С° дорівнює 1,8·10-16. Нехтуючи концентрацією молекул води, які продисоціювали і приймаючи масу 1 л води за 1000 г, можна визначити концентрацію молекул води, які не продисоціювали в 1л:
= [Н+]∙[ОН–]/[Н2О] за 22 С° дорівнює 1,8·10-16. Нехтуючи концентрацією молекул води, які продисоціювали і приймаючи масу 1 л води за 1000 г, можна визначити концентрацію молекул води, які не продисоціювали в 1л:
[Н2О] = 1000 /18 = 55,56 моль оскільки, ![]() = [Н+]∙[ОН–], тоді:
= [Н+]∙[ОН–], тоді:
[Н+]∙[ОН–] = 55,56·1,8·10-16 = 1·10-14 =Kw
Kw = [Н+]∙[ОН–] = 10-14 (6.17)
Рівняння (6.17) називають йонним добутком води. Добуток концентрацій йонів Гідрогену і гідроксид-йонів у водному розчині є величиною постійною за даної температури. Через те, що у чистій воді [Н+] = [ОН–], то кожна з цих величин дорівнює:
[Н+]=[ОН–] =![]() =107-моль-йонів/л (6.18)
=107-моль-йонів/л (6.18)
У будь-якому водному розчині присутні одночасно Н+ і ОН![]() -йони. І як би не змінювалися їх концентрації, добуток [Н+]·[ОН–] буде постійною величиною за постійної температури. Для нейтрального середовища – [Н+]·[ОН–]=10-7 моль/л; у кислому середовищі – [Н+]>10-7; [ОН–]<10-7; у лужному середовищі – [Н+]<10-7 , а [ОН–]>10-7.
-йони. І як би не змінювалися їх концентрації, добуток [Н+]·[ОН–] буде постійною величиною за постійної температури. Для нейтрального середовища – [Н+]·[ОН–]=10-7 моль/л; у кислому середовищі – [Н+]>10-7; [ОН–]<10-7; у лужному середовищі – [Н+]<10-7 , а [ОН–]>10-7.
Для характеристики кислотності (лужності) середовища можна використати будь-яку із цих величин:
[Н+]= 10-14/[ОН–] (6.19) або [ОН–]= 10-14/[Н+] (6.20)
Для водних розчинів сильних кислот і основ сталість йонного добутку води справедлива, якщо замість концентрації йонів використовувати їх активності.
Більш зручніше виражати кислотність середовища у логарифмічних одиницях (через водневий або гідроксильний показники рН і рОН відповідно):
pH = -lg[H+] (6.21) або pOH = -lg[ОН–] (6.22)
Ці величини введені Дж. Серенсеном.
Наприклад: [Н+] = 10-5моль/л, тоді pH = -lg[Н+]; pH =-lg10-5 = 5.
Отже, в нейтральному середовищі (розчині) рН = 7; у кислому – рН < 7 і у лужному рН > 7. Сума рН + рОН = 14.
Оскільки ![]() , то рН слабких кислот обчислюють за формулою:
, то рН слабких кислот обчислюють за формулою:
рН=1/2рКа -1/2 lgCa, (6.23)
Для слабкої основи
рН =14 - 1/2 рКb + 1/2lgCb (6.24)
Водневий показник вимірюють різними методами. Грубо, але швидко, його вимірюють індикаторами (спеціальними реактивами, які змінюють своє забарвлення залежно від концентрації Н+ і ОН–-йонів, наприклад, метиловий оранжевий, фенолфталеїн, лакмус, універсальний індикатор та ін.). Значно точніше – за допомогою рН-метрів на основі потенціометричного методу.
Значення рН розчину відіграє велику роль у природі та техніці (рисунок 6.1). Наприклад, рН плазми крові людини дорівнює: рН=7,36. Це величина постійна. Якщо рН крові відхиляється від величини 7,36, це свідчить про захворювання людини. Допустимі відхилення становлять: рН = 7,36 ± 0,05, при більших відхиленнях може наступити смерть.
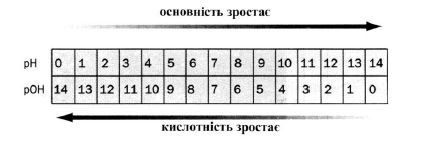
Рисунок 6.1 – Різні напрямки зростання кислотності та основності розчину
Від величини рН залежить корозійна активність природних вод, швидкість багатьох реакцій.
6.4 Поняття про буферні розчини
Для підтримання значення pH практично незмінним застосовують буферні розчини. Це суміші слабкої кислоти (основи) та їхніх солей і здатні зв’язувати йони H+ і ОН![]() при додаванні незначних, помірних кількостей сильних кислот (лугів). Наприклад:
при додаванні незначних, помірних кількостей сильних кислот (лугів). Наприклад:
- кислотний буфер: СH3СООН + СH3СООNа (ацетатний буфер);
- основний буфер: NH3∙H2O + NH4Cl (аміачний).
На практиці знаходять застосування й інші буфери:
Н2СО3 + NaHCO3 – дикарбонатний буфер;
NaH2PO4 + Na2HPО4 – фосфатний буфер та ін.
Механізм дії буферного розчину розглянемо на прикладі ацетатного буферу: CH3COOH/ CH3COO![]() , CH3COOH
, CH3COOH ![]() H+ + CH3COO
H+ + CH3COO![]()
В результаті додавання до розчину кислоти (надлишку H+) рівновага зміщується вліво за рахунок зв’язування цих Н+-йонів з CH3COO![]() , з утворенням слабкої кислоти CH3СOOН. Коли ж додати луг (), то OH
, з утворенням слабкої кислоти CH3СOOН. Коли ж додати луг (), то OH![]() -йони будуть зв’язуватися в слабкий електроліт H2O: H+ + OH
-йони будуть зв’язуватися в слабкий електроліт H2O: H+ + OH![]() = H2O.
= H2O.
Буфери підтримують постійним pH і під час розбавлення розчинів. В даному випадку збільшується кількість СH3COO![]() -йонів за рахунок зростання α, але це приводить (за величиною К) до підвищення СH3COOН – дія однойменного йона. За формулою величини К:
-йонів за рахунок зростання α, але це приводить (за величиною К) до підвищення СH3COOН – дія однойменного йона. За формулою величини К:
К = [H+]∙[СH3COO![]() ]/[СH3COOH] знайдемо:
]/[СH3COOH] знайдемо:
[H+] = К∙([СH3COОН]/[СH3COO![]() ]). Так як СH3COOH – слабкий електроліт, то [СH3COO
]). Так як СH3COOH – слабкий електроліт, то [СH3COO![]() ]солі > [СH3COO
]солі > [СH3COO![]() ]кислоти крім того, введення однойменного йона подавляє дисоціацію слабкого електроліту (згідно з принципом Ле-Шател’є).
]кислоти крім того, введення однойменного йона подавляє дисоціацію слабкого електроліту (згідно з принципом Ле-Шател’є).
Припустимо, що концентрація молекул СH3COОН, які непродисоціювали дорівнює загальній концентрації кислоти, а концентрація [СH3COO![]() ] – загальній концентрації солі, тоді:
] – загальній концентрації солі, тоді:
[H+] = К (кислота/сіль) або прологарифмуємо рівняння:
pH = pKa – lg(Ca /Cs).
Для основного буферу: pH = 14 – pKb + lg(CB/Cs).
Буферні розчини відіграють важливу роль в регулюванні життєвих процесів в організмах тварини і рослин, широко застосовується в лабораторній практиці.
6.5 Протолітична теорія кислот і основ
Погляд на кислоти і основи з точки зору теорії електролітичної дисоціації С. Арреніуса, справедливий лише для їх водних розчинів.
Використовують декілька узагальнених теорій кислот і основ: протолітична теорія (Бренстед, Лоурі), теорія сольватосистем (Кеді, Франклін, США) і електронна теорія (Льюіс, США).
Згідно з цими теоріями визначення кислот і основ пов’язане із їх здатністю:
- віддавати йон Н+ (кислоти) та йон ОН– (основи) – Арреніус;
- віддавати йони Н+ (кислоти) та приєднувати йони Н+ (основи) – Бренстед, Лоурі (рисунок 6.2 а);
- приймати електронні пари (кислоти) та віддавати електронні пари (основи) – Льюіс (рисунок 6.2 б).
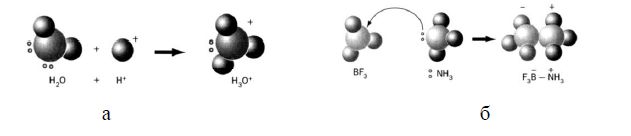
Рисунок 6.2 – Донори і акцептори протонів
Згідно із протолітичною (протонною) теорією кислот і основ: кислота (acidum) – це донор протонів; основа (basicum) – акцептор протонів.
Отже, всі протолітичні реакції полягають у перенесенні протона від молекули кислоти до молекули основи. Вони є оборотними. Наприклад, кислотно-основна рівновага у розчині оцтової кислоти:
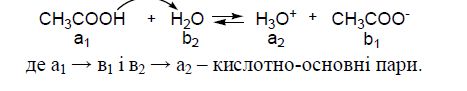
За теорією Бренстеда-Лоурі кислотою чи основою може бути:
а) нейтральна молекула
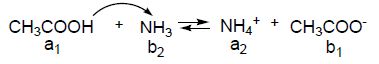
б) катіон;
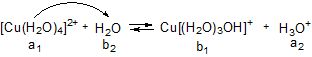
в) аніон
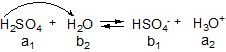
або
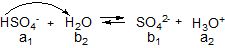
Реакції кислота-основа частіше за все відбуваються за участю молекул розчинника. Молекули води є амфолітами:
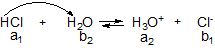
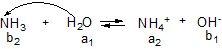
Для кислотно-основних пар існує таке загальне правило: кислота реагує в першу чергу з найбільш сильною у даних умовах основою, а основа – з найбільш сильною кислотою. Розрізняють:
а) речовини, які легко віддають протони – протогенні: H2SO4, HNO3, СН3СООН; вони є кислотами;
б) речовини, які легко приєднують протон – протофільні: NH3, аміни та ін.; вони є основами (як розчинники називаються протофільними розчинниками);
в) речовини, які не проявляють ні основних, ні кислотних властивостей (не здатні ні приєднувати, ні віддавати протони), вони називаються апротонними розчинниками (бензен, толуен та ін.).
Константа дисоціації спряженої кислоти і основи
Якщо спряжена пара кислота-основа знаходиться у розчині з будь-яким розчинником, то у такій системі встановлюється рівновага:![]()
Здатність кислоти донувати протон молекулі води (відносна сила кислоти як донора протона) характеризується константою дисоціації кислоти (константа йонізації):
Ка= [Н3О+] [СН3СОО![]() ] / [СН3СООН],
] / [СН3СООН],
яка показує силу оцтової кислоти у водному розчині.
Аналогічно, для реакції основи з водою:
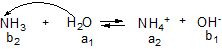
Кb = [NН![]() ] [OH
] [OH![]() ] / [NH3],
] / [NH3],
де Кв – константа йонізації основи. Константу йонізації основи можна записати для будь-якої основи, спряженої з кислотою. Наприклад:
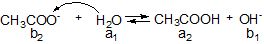
Тоді:
Кb = [СН3 СООН] [OH![]() ] / [СН3СОО
] / [СН3СОО![]() ]
]
Добуток Ка∙Кb (констант йонізації кислоти і основи) дорівнює йонному добутку розчинника. Для води:
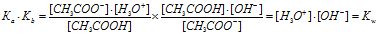
Таким чином, добуток Ка ∙ Кв - це функція дисоціації розчинника, яка не залежить від індивідуальних властивостей супряженої пари а1 → в1
Кb легко обчислити за величиною Ка. Наприклад: Ка для NH![]() =5,5 ∙ 10-10 Визначити Кb. Оскільки Ка ∙ Кb = Kw, то:
=5,5 ∙ 10-10 Визначити Кb. Оскільки Ка ∙ Кb = Kw, то:
Kb = Kw/Ka=l0-14/5,5 ∙ 10-10=1,8 ∙ 10-5, або, як показано вище:
рKb = -lgKb звідки рKb=14 - pKa
Так, якщо Кb для аміаку (водного розчину) дорівнює 11,8 ∙ 10-5, то
pKb = -lgKb = -lg 1,8 ∙ 10-5; pКb = 4,75
Якщо ввести у водне середовище молекулу (йон) з більшою здатністю до віддачі протона, ніж у Н3О+, то вона (він) прореагує з молекулами води необоротно:
HNO3 + Н2О → Н3О+ + NO![]() ;
;
НСlO4 + Н2О → Н3О+ + ClO![]() ;
;
Типи протолітичних реакцій
Протолітичними реакціями є: а) дисоціація (йонізація), б) нейтралізація і в) гідроліз.
Реакції дисоціації – згідно із протонною теорією під час дисоціації молекулярних кислот і основ молекули розчинника відіграють значну роль, виконуючи функції акцептора або донора протонів. Наприклад:
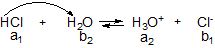
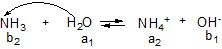
Для реакцій нейтралізації (за теорією Бренстеда-Лоурі) характерні такі випадки:
1) нейтралізація сильної кислоти сильною основою:
![]()
2) нейтралізація слабкої кислоти сильною основою:
![]()
3) нейтралізація сильної кислоти слабкою основою:
![]()
4) нейтралізація слабкої кислоти слабкою основою:
![]()
Різниця між реакціями дисоціації і нейтралізації полягає в тому, що при дисоціації нейтральні молекули розчинника приймають участь у реакції як реагенти,а при нейтралізації-вони є продуктами реакції (виняток випадок 4).
6.6 Гідроліз солей
Гідроліз – це взаємодія речовин з водою (солі, вуглеводи, білки, естери, жири та ін.)
Гідроліз солей – це окремий випадок протолітичних реакцій. Його розглядають залежно від участі катіону чи аніону в цьому процесі. Гідроліз солей характеризується величинами: Kг, h (ступінь гідролізу, рН).
Гідроліз за катіоном. Катіони металів існують у водних розчинах у вигляді аквакомплексів певного складу. Наприклад: [Cu(H2O)4]2+, [Cr(H2O)6]3+ тощо, у яких молекули води зв’язані з центральним атомом (катіоном металу) ковалентними зв’язками, утвореними за донорно-акцепторним механізмом (катіон – акцептор, молекули води – донори електронних пар).
Подальша гідратація таких аквакомплексів здійснюється за рахунок водневих зв’язків. Наприклад:
CuSO4 → Cu2+ + SO42-
йон Cu2+ утворює з молекулами води аквакомплекс
Cu2+ + 4Н2О ![]() [Cu(H2O)4]2+
[Cu(H2O)4]2+
Щоб пояснити механізм гідролізу за катіоном, необхідно з’ясувати вплив центрального атома Cu2+ на одну із координованих біля нього молекул води, яка зв’язана слабшим водневим зв’язком у гідратній оболонці (за схемою):
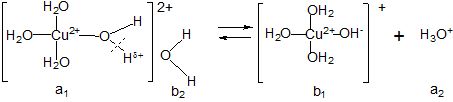
Центральний атом поляризує зв’язок –О––Нδ+ у молекулі води, відштовхуючи від себе позитивно поляризований атом Гідрогену, що призводить до послаблення і розриву цього зв’язку зі зміцненням водневого зв’язку і переносом протону на молекулу води у гідратній оболонці (з утворенням Н3О+).
Таким чином, аквакомплекс у даній рівноважній системі виступає як донор протону, тобто як кислоти (а1), якій відповідає спряжена основа (b1). Основою (b2) є молекула води (розчинника), якій відповідає спряжена кислота Н3О+ (а2). Вона зумовлює кисле середовище розчину. Спрощено записують так:
І
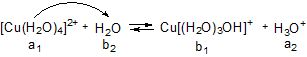
ІІ
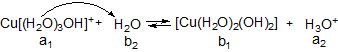
Гідролізу за катіоном піддаються солі, утворені слабкими основами (рисунок 6.3). Для них характерна така закономірність: чим менше Кb (або більше рКb) основи тим більше гідролізується сіль. Солі, утворені сильними основами, гідролізу за катіоном не піддаються.
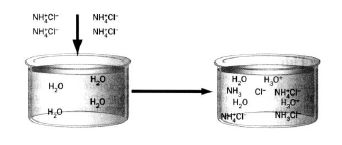
Рисунок 6.3 – Гідроліз за катіоном амоній хлориду
Гідроліз за аніоном: гідратація аніонів здійснюється за рахунок водневих зв’язків, утворених негативно поляризованим атомом аніона і позитивно поляризованим атомом Гідрогену молекули води у гідратній оболонці невизначеного складу (залежить від низки умов).
Наприклад, карбонат натрію у водному розчині дисоціює на йони
Na2CO3 → 2Na+ + CO![]()
Негативно заряджений СО32--йон притягує до себе позитивно поляризований атом водню молекули води, додатково поляризує її з перетворенням водневого зв’язку у ковалентний, в результаті чого протон переноситься від молекули води до аніона за схемою:
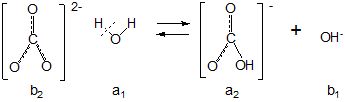
Скорочено записують так:
СО32 - + Н2О ![]() НСО3- + ОН
НСО3- + ОН![]()
b2 а1 а2 b1
Реакція середовища лужна, що зумовлено нагромадженням у розчині
ОН–-йонів.
Чим більший заряд і менший розмір аніона, тим краще гідролізується сіль. Такі реакції найбільш характерні для аніонів CO32-, PO43-, SO32-, CN-, NO2-, CH3COO- та ін., тобто гідролізу за аніоном піддаються солі, утворені слабкою кислотою (рисунок 6.4). Для них характерна така закономірність: чим менше Ка (або більше рКа) кислоти тим краще гідролізується сіль.
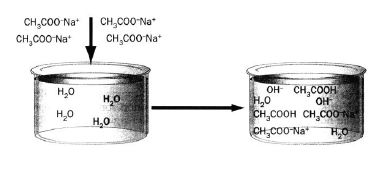
Рисунок 6.4 – Гідроліз за аніоном натрій ацетату
Сіль слабкої кислоти і слабкої основи гідролізується і за катіоном і за аніоном сумарний вираз процесу гідролізу записують таким чином:
CH3COONH4 → NН![]() + СН3СОО
+ СН3СОО![]()
![]()
Більшість солей такого типу повністю розкладаються водою і процес гідролізу стає необоротним, що особливо є характерним для сульфідів і карбонатів Аl3+, Сг3+, Fe3+.
Al2S3 + 6Н2О → 2Аl(ОН)3 + 3H2S
2FeCl3 + 3Na2S + 6Н2О → 2Fe(OH)3 + 3H2S + 6NaCl
Для розрахунку ступеня гідролізу використовують закон розведення Оствальда :
![]() (6.25)
(6.25)
де h - ступінь гідролізу; Кг – константа гідролізу і С – концентрація солі.
Для розрахунку константи гідролізу використовують формули:
- якщо гідроліз відбувається за аніоном
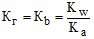 (6.26)
(6.26) - якщо гідроліз відбувається за катіоном
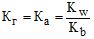 (6.27)
(6.27) - для солей слабкої кислоти і основи
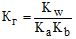 (6.28)
(6.28)
де Кг, Кb, Ка – константа відповідно гідролізу, йонізації основи, йонізації кислоти.
Константа гідролізу Кг залежить від температури і природи солі (природи слабких кислот, основ). Ступінь гідролізу залежить від природи солі, її концентрації і температури розчину (гідроліз – ендотермічний процес). З розбавленням і підвищенням температури розчину h зростає.
Для розрахунку рН солі, яка піддається гідролізу, використовують формули:
- для солі, що утворена слабкою кислотою та сильною основою:
рН = 7 + ½ pKa + ½ lgCs (6.29)
- для солі, що утворена слабкою основою та сильною кислотою:
pH = 7 – ½ pKb – ½ lgCs (6.30)
- для солі, що утворена слабкою кислотою та слабкою основою:
pH = 7 + ½ pKa – ½ pKb (6.31)
Гідроліз солей має велике значення у техніці і природі. Значенням рН обумовлюється агресивність середовища робочих розчинів, що необхідно враховувати при експлуатації металоконструкцій і металовиробів у розчинах солей.