Тема 7 Теорія окиснювально-відновних процесів
План
7.1 Ступінь окиснення елементів
7.2 Основні поняття: окисник, відновник, окиснення, вiдновлення. Активні окисники i відновники
7.3 Типи окиснювально-відновних реакцій
7.4 Складання рівнянь ОВР. Еквіваленти речовин
7.5 Гальванічні елементи. Електрохімічний ряд напруг металів. Стандартні потенціали окисників i відновників
7.6 Напрямок ОВР
7.1 Ступінь окиснення елементів
Ступінь окиснення – це умовний заряд атома, якого він набуває, якщо віддає або приєднує електрони, розрахований виходячи з припущення, що сполука складається iз йонів і в цілому є електронейтральною.
Для знаходження ступеня окислення користуються наступними правилами :
1. Ступінь окиснення елементів в простих речовинах дорівнює нулю.
2. Ступінь окиснення Гідрогену дорівнює +1, за винятком гідридів – -1, наприклад : NaH.
3. Ступінь окиснення Оксигену дорівнює -2, за винятком пероксидів – Н2О2 (ст. ок. = -1); надпероксидів – KO2 (ст. ок. = -1/2); озонідів – KO3 (ст. ок. = -І/3); дифториду Оксигену – OF2 (ст. ок. = +2).
4. Ступінь окиснення лужних металів завжди дорівнює +1, лужноземельних +2.
Існують елементи для яких характерний тільки один ступінь окиснення. Але в більшості випадків елементи мають декілька ступенів окиснення. Так наприклад, ступінь окиснення Мангану в сполуках дорівнює: ![]() ,
, ![]() ,
, ![]()
![]() .
.
У багатьох випадках значення ступеня окиснення елемента не співпадає з числом утворених зв'язків. Наприклад:
![]()
![]()
![]()
![]() ,
, ![]() ,
, ![]() ,
, ![]() ,
, ![]()
Визначити ступінь окиснення можна за номером групи періодичної системи хімічних елементів, в якій знаходиться елемент.
Вищий ступінь окиснення, відповідає номеру групи. Наприклад: ![]() ,
, ![]() ,
, ![]()
![]() та ін.
та ін.
Винятком є F, O, Не, Nе, Аг, Fе, Со, Ni, вищий ступінь окиснення яких нижчий, ніж відповідний номер групи. Елементи Сu, Аg, Аu мають вищий ступінь окиснення +3, хоча вони належать до першої групи. Наприклад: ![]() ,
, ![]() ,
, ![]() .
.
Нижчий ступінь окиснення елемента визначається за різницею номера групи, в якій знаходиться елемент і восьми. Наприклад, Нітроген має мінімальний ступінь окиснення –3 (5 – 8 = -3).
Нижчий ступінь окиснення визначає відновні властивості елемента, вищий – окиснювальні, а проміжний характеризує двоїсту природу елемента.
7.2 Основні поняття: окисник, відновник, окиснення, відновлення. Активні окисники і відновники
Зміна ступеня окиснення елемента пов’язана зі зміною електронної структури частинок: віддаванням або приєднанням електронів.
Процес віддавання електронів супроводжується підвищенням ступеня окиснення і називається окисненням.
Процес приєднання електронів супроводжується зниженням ступеня окиснення і називається відновленням.
Реакції, які супроводжуються зміною ступенів окиснення елементів називаються окисно-відновними (редокс-реакціями). Під час цих реакцій відбуваються два процеси: окиснення і відновлення.
Частинки, які приєднують електрони – окисники (акцептори електронів); частинки, які віддають електрони – відновники (донори електронів). Таким чином, у цьому випадку має місце окисно-відновна рівновага:
Ох1+ Red2 ![]() Ox2 + Red1
Ox2 + Red1
Для реакції:
CuSO4 + Fe ![]() FeSO4 + Cu
FeSO4 + Cu
окисник – Cu2+, відновник – Fe.
Cu2+ + 2![]()
![]() Cu° – процес відновлення
Cu° – процес відновлення
Fe° – 2![]()
![]() Fe2+ – процес окиснення,
Fe2+ – процес окиснення,
або сумарне рівняння Cu2+ + Fe°![]() Fe2+ + Cu°
Fe2+ + Cu°
Великий вклад у розвиток теорії окисно-відновних процесів внесли Л.В. Писаржевський, Я.Л. Михайленко, М.О. Шилов, Г.В. і С.В. Дайни та ін.
Всі речовини за їх здатністю до окиснення чи відновлення поділяються на три групи:
І – безумовні окисники – речовини, які можуть тільки відновлюватися (приймати електрони). До них належать прості речовини, утворені елементами, що характеризуються великими значеннями електронегативності, наприклад: F2, O2, Cl2. Складні речовини є безумовними відновниками тільки тоді, коли до їх складу входить елемент з вищим ступенем окиснення (![]() ,
, ![]() ). Складні йони (аніони) що містять елементи з вищим або високим ступенем окиснення: MnO
). Складні йони (аніони) що містять елементи з вищим або високим ступенем окиснення: MnO![]() , Cr2O
, Cr2O![]() , SO
, SO![]() та ін., вони відновлюються за схемами рівнянь:
та ін., вони відновлюються за схемами рівнянь:
MnO![]() + 8H
+ 8H![]() +5
+5![]()
![]() Mn2
Mn2![]() + 4Н2О
+ 4Н2О
MnO![]() + 2H2O +3
+ 2H2O +3![]()
![]() MnO2 + 4OH
MnO2 + 4OH![]()
MnO![]() + 1
+ 1![]()
![]() MnO
MnO![]()
Cr2O![]() + 14H
+ 14H![]() + 6
+ 6![]()
![]() 2Cr
2Cr![]() + 7H2O
+ 7H2O
Cr2O![]() + 7H2O + 6
+ 7H2O + 6![]()
![]() 2Cr(OH)3 + 8OH
2Cr(OH)3 + 8OH![]()
SO![]() + 4H
+ 4H![]() + 2
+ 2![]()
![]() SO2 + 2H2O
SO2 + 2H2O
SO![]() + 8H
+ 8H![]() + 6
+ 6![]()
![]() S + 4H2O
S + 4H2O
В залежності від концентрації кислоти-окисника (концентрована H2SO4, HNO3) і сили відновника, процес відновлення може відбуватися за схемами:
SO![]() → SO2 → S → H2S
→ SO2 → S → H2S
NO![]() → NO2 → NO → N2O → N2→ NH3 (NH
→ NO2 → NO → N2O → N2→ NH3 (NH![]() )
)
![]()
концентрація HNO3 знижується
ІІ – безумовні відновники – речовини, здатні віддавати електрони. Це можуть бути прості речовини – метали (найбільш активні лужні та лужно-земельні), та неметали – водень і вуглець; складні сполуки, що містять елементи з мінімальним ступенем окиснення (NH3, H2S, KJ, CO, NH3, As2S3); прості йони (катіони) з нижчим ступенем окиснення елементів: Fe2+, Cu+, Sn2+, Cr![]() ,Ті2+; прості аніони з нижчим ступенем окиснення елементів: J
,Ті2+; прості аніони з нижчим ступенем окиснення елементів: J![]() > Br
> Br![]() > Cl
> Cl![]() , S
, S![]() , N3
, N3![]() (нітридний Нітроген).
(нітридний Нітроген).
Деякі схеми окиснення відновників:
H2S – 2![]()
![]() S + 2Н+
S + 2Н+
H2S + 4H2O – 8![]()
![]() SO
SO![]() +10H+
+10H+
Sn2+-2![]()
![]() Sn+4
Sn+4
Cr3+ + 8OH![]() – З
– З![]()
![]() CrO
CrO![]() + 4H2O
+ 4H2O
ІІІ – сполуки, які можуть проявляти властивості як окисників, так і відновників залежно від умов.
Наприклад:
![]() – окисник, може тільки приймати електрони;
– окисник, може тільки приймати електрони;
![]() – відновник;
– відновник;
![]() – двоїста природа, може бути і окисником, і відновником:
– двоїста природа, може бути і окисником, і відновником:
2![]() + O2
+ O2 ![]() 2
2![]()
![]() + 2
+ 2![]()
![]() 3S° + 3H2О
3S° + 3H2О
7.3 Типи окиснювально-відновних реакцій
Розрізняють такі типи окиснювально-відновних реакцій:
а) міжмолекулярні реакції, які відбуваються між різними молекулами (найбільш широка група реакцій):
2![]() + C12°
+ C12°![]() 2
2![]()
б) внутрішньомолекулярні реакції, які відбуваються зі зміною ступеня окиснення різних атомів однієї й тієї ж молекули (це, головним чином, реакції термічного розкладу речовин):
2![]()
![]() 2Hg° + O2
2Hg° + O2
![]()
![]()
![]() + N2° + 4H2O
+ N2° + 4H2O
в) реакції самоокиснення-самовідновлення (диспропорціонування) – перебігають з одночасним збільшенням і зменшенням ступеня окиснення одного й того ж елемента:
![]() +
+ ![]() + H2O →
+ H2O → ![]() +
+ ![]() .
.
Внутрішньомолекулярні реакції окиснення-відновлення, в ході яких відбувається вирівнювання ступеня окиснення одного й того ж елемента, є процесами контрдиспропорціонування (комутації):
![]() .
.
7.4 Методики складання рівнянь окисно-відновних реакцій. Еквіваленти речовин
Для розрахунку коефіцієнтів ОВР використовують два методи: метод електронного балансу та йонно-електронний. Обидва методи базуються на одних і тих же положеннях: в ОВР загальне число електронів, що віддає відновник, дорівнює загальному числу електронів, які приєднує окисник. Причому, трактування окисно-відновного процесу як простого переходу електронів – це лише зручний спосіб для написання рівняння реакції і підбору коефіцієнтів. Наприклад:
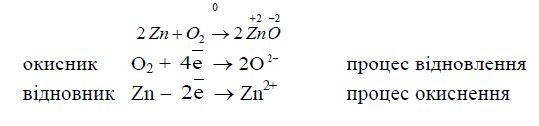
Чисто формальним є те, що Цинк втрачає два електрони, а Оксиген їх приєднує, тому що йонів О![]() взагалі бути не може у вільному вигляді, особливо поряд з катіонам. В дійсності зв'язок між Цинком і Оксигеном в молекулі ZnO – полярний, де
взагалі бути не може у вільному вигляді, особливо поряд з катіонам. В дійсності зв'язок між Цинком і Оксигеном в молекулі ZnO – полярний, де ![]() , що приблизно вдвічі менше за ступінь окиснення +2.
, що приблизно вдвічі менше за ступінь окиснення +2.
Метод електронного балансу ґрунтується на підрахунку числа приєднаних або втрачених електронів, проводиться виходячи із значень ступенів окиснення елементів до і після реакції.
Наприклад для реакції:
![]() +
+ ![]() + H2SO4 →
+ H2SO4 → ![]() +
+ ![]() + Na2SO4 + H2O
+ Na2SO4 + H2O
Ступінь окиснення змінюють тільки Манган і Сульфур.
Переходу Mn![]() → Mn
→ Mn![]() формально відповідає приєднання п'яти електронів, а переходу S
формально відповідає приєднання п'яти електронів, а переходу S![]() → S+6 – втрата двох електронів. Отже, KMnO4 – окисник, a Na2SO3 – відновник. Баланс "електронного обміну" такий:
→ S+6 – втрата двох електронів. Отже, KMnO4 – окисник, a Na2SO3 – відновник. Баланс "електронного обміну" такий:
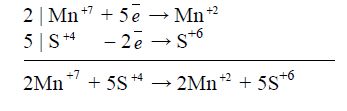
Знайдені коефіцієнти (множники) переносять в рівняння реакції:
2KMnO4 + 5Na2SO3 + 3H2SO4 = 2MnSO4 + K2SO4 + 5Na2SO4 + 3H2O
Інші коефіцієнти знаходять за підрахунком балансу інших елементів: за SO![]() визначають число молекул сульфатної кислоти (три), а за балансом атомів Гідрогену визначають число молекул води (три).
визначають число молекул сульфатної кислоти (три), а за балансом атомів Гідрогену визначають число молекул води (три).
Розглянуті операції здійснюють без багаторазового переписування рівняння реакції,
Для спрощення можна також використати наступний спосіб підбору коефіцієнтів:
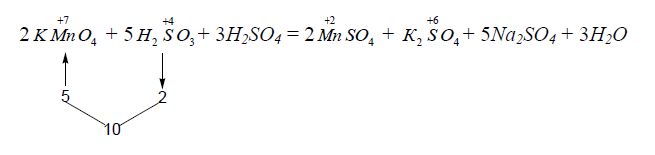
Йонно-електронний метод ґрунтується на складанні окремих рівнянь реакцій відновлення і окиснення (напівреакцій), які потім сумують в загальне рівняння. Дотримуються наступних правил:
1. Сильні електроліти записуються у вигляді йонів.
2. Неелектроліти, слабкі електроліти, гази і осади – у вигляді молекул.
3. Йони, які не змінюються в ході реакції, в йонну схему не включаються.
4. Напівреакція повинна бути урівняна за кількістю всіх атомів елементів, що приймають в ній участь. Для цього враховують наступне:
а) у кислому середовищі урівнювання Оксигену здійснюють шляхом додавання води в ту частину напівреакції, де Оксигену не вистачає, в кількості, що дорівнює його нестачі, а до протилежної частини додають Н![]() -йони , в кількості в два рази більшій, ніж добавленої води (2Н+→Н2О, або Н2О→2Н+). Наприклад:
-йони , в кількості в два рази більшій, ніж добавленої води (2Н+→Н2О, або Н2О→2Н+). Наприклад:
SO![]() + H2O – 2
+ H2O – 2![]() → SO
→ SO![]() + 2H
+ 2H![]()
SO![]() + 6H
+ 6H![]() + 4
+ 4![]() → S + 3H2O;
→ S + 3H2O;
б) у лужному середовищі урівнювання Оксигену здійснюють за допомогою гідроксидних груп ОН![]() і води. Якщо Оксигену не вистачає – додають ОН
і води. Якщо Оксигену не вистачає – додають ОН![]() -групи в кількості у два рази більшій, ніж не вистачає Оксигену, а в протилежній частині отримують воду (Н2О→2ОН
-групи в кількості у два рази більшій, ніж не вистачає Оксигену, а в протилежній частині отримують воду (Н2О→2ОН![]() , або 2ОН
, або 2ОН![]() →Н2О). Наприклад:
→Н2О). Наприклад:
MnO![]() + 2H2O + 3
+ 2H2O + 3![]() → MnO2 + 4OH
→ MnO2 + 4OH![]()
SO![]() + 2OH
+ 2OH![]() – 2
– 2![]() → SO
→ SO![]() + H2O
+ H2O
в) у нейтральному середовищі – у ліву частину напівреакції як на надлишок, так і на нестачу Оксигену додають тільки воду (Н2О → 2ОН![]() , або Н2О → 2Н+). Наприклад:
, або Н2О → 2Н+). Наприклад:
MnO![]() + 2H2O + 3
+ 2H2O + 3![]() → MnO2 + 4OH
→ MnO2 + 4OH![]()
Мn![]() + 2H2O – 2
+ 2H2O – 2![]() → MnO2 + 4H
→ MnO2 + 4H![]()
Реакції окиснення-відновлення, що відбуваються в кислому середовищі розглянемо на такому прикладі:
Молекулярна схема:
KMnO4 + Na2SO3 + H2SO4 = MnSO4 + K2SO4 + Na2SO4 + H2O
Йонна схема реакції:
MnO![]() +SO
+SO![]() + Н
+ Н![]() → Mn2+ + SO
→ Mn2+ + SO![]() + Н2О
+ Н2О
Напівреакції:
SO![]() – відновлена форма
– відновлена форма![]() SO
SO![]() – окисна форма
– окисна форма
MnO![]() – окисна форма
– окисна форма![]() Mn2+ – відновлена форма
Mn2+ – відновлена форма
Процес окиснення:
SO![]() → SO
→ SO![]()
1) урівнюють кількість атомів Сульфуру в лівій і правій частинах напівреакції (у даному випадку не потрібно);
2) урівнюють кількість атомів Оксигену (див. вище):
SO![]() + H2O → SO
+ H2O → SO![]() + 2H
+ 2H![]()
3) урівнюють заряд: для балансу зарядів в лівій частині рівняння необхідно відняти два електрони:
SO![]() + H2O – 2
+ H2O – 2![]() → SO
→ SO![]() + 2H
+ 2H![]()
Процес відновлення:
MnO![]() → Mn2+
→ Mn2+
1) урівнюють кількість атомів Мангану (у даному випадку не потрібно);
2) урівнюють кількість атомів Оксигену:
MnO![]() +8Н
+8Н![]() → Mn2+ + 4Н2О;
→ Mn2+ + 4Н2О;
3) урівнюють заряд: для балансу зарядів в лівій частині рівняння необхідно додати п'ять електронів:
MnO![]() +8Н
+8Н![]() + 5
+ 5![]() → Mn2+ + 4Н2О;
→ Mn2+ + 4Н2О;
4) складають обидві напівреакції, перемноживши їх на додаткові множники для балансу електронів:
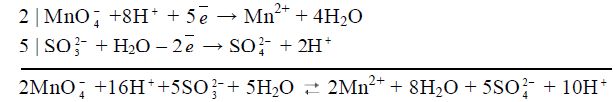 .
.
Вірність розрахунку коефіцієнтів перевіряють за числом зарядів, яке повинно бути рівним у лівій і правій частинах рівняння (в даному випадку +6=+6);
5) скорочують однакові йони і молекули (у даному випадку Н+ і Н2О) у лівій і правій частинах рівняння і записують рівняння у молекулярному вигляді таким чином:
2KMnO4 + 5Na2SO3 + 3H2SO4 ![]() 2MnSO4 + 5Na2SO4 + K2SO4 + 3H2O
2MnSO4 + 5Na2SO4 + K2SO4 + 3H2O
На практиці користуються спрощеною схемою (без багаторазового переписування рівнянь напівреакцій).
Реакції окиснення-відновлення, які відбуваються в лужному середовищі розглянемо на такому прикладі:
Молекулярна схема:
MnSO4 + KСlO3+KOH → К2MnО4 + КСl + K2SO4 + Н2О
Йонна схема реакції:
Mn![]() + ClO
+ ClO![]() + OН
+ OН![]() → MnO
→ MnO![]() + Cl
+ Cl![]() + H2O
+ H2O
Процеси окиснення і відновлення складають окремо аналогічно попередньому прикладу, урівнюють кількість атомів Оксигену в лужному середовищі (див. вище). Сумують обидві напівреакції, перемножуючи їх на додаткові множники для балансу електронів і скорочуючи однакові йони та молекули в сумарному рівнянні:
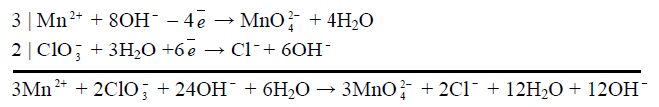
Після скорочення:
3Mn![]() + 2ClO
+ 2ClO![]() + 12OН
+ 12OН![]() → 3MnO
→ 3MnO![]() + 2Cl
+ 2Cl![]() + 6H2O
+ 6H2O
Записують реакцію в молекулярному вигляді :
3MnSO4 +2 KСlO3+12KOH → 3К2MnО4 + 2КСl + 3K2SO4 + 6Н2О
Реакції окиснення-відновлення, які відбуваються в нейтральному середовищі розглянемо на прикладі:
Молекулярна схема:
KMnO4 + Na2SO3 + H2O → MnO2 + Na2SO4 + КОН
Йонна схема:
MnO![]() +SO
+SO![]() +Н2О → MnO2 + SO
+Н2О → MnO2 + SO![]() +ОН
+ОН![]()
Процеси окислення і відновлення складають аналогічно наведеним вище прикладам. При цьому враховують, що на кожний зайвий атом Оксигену приписують молекулу води, а вправу частину переносять два ОН![]() -йони. На кожний атом Оксигену, якого бракує – молекулу води, а в праву частину – два ОН
-йони. На кожний атом Оксигену, якого бракує – молекулу води, а в праву частину – два ОН![]() -йони.
-йони.
Сумують обидві напівреакції, перемножуючи їх на додаткові множники для балансу електронів і скорочуючи однакові йони та молекули в сумарному рівнянні:
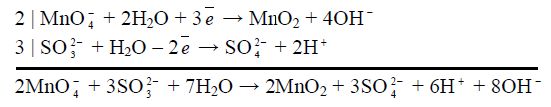
Після скорочення:
2MnO![]() + 3SO
+ 3SO![]() H2O → 2MnO2 + 3SO
H2O → 2MnO2 + 3SO![]() + 2OH
+ 2OH![]()
Записують реакцію в молекулярному вигляді :
2KMnO4 + 3Na2SO3 + H2O → 2 ΜnΟ2 + 3Na2SO4 + 2КОН
Еквівалентні маси окисника і відновника обчислюють за формулою: me=М/n, де М – молекулярна маса; n – число прийнятих (відданих) електронів одним атомом, йоном або молекулою.
Для реакції:
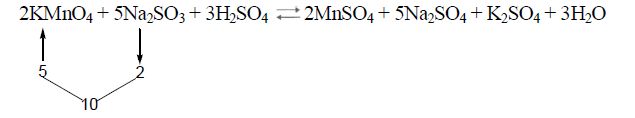
![]() =
= ![]() ;
; ![]() =
= ![]() .
.
7.5 Гальванічні елементи. Електрохімічний ряд напруг металів. Стандартні потенціали окисників і відновників
Окиснювально-відновні реакції кількісно характеризуються: константою хімічної рівноваги, зміною енергії Гіббса ![]() ,швидкістю, еквівалентами речовин, які беруть участь в реакції, а також величинами їх електродних (
,швидкістю, еквівалентами речовин, які беруть участь в реакції, а також величинами їх електродних (![]() ), або окислювально-відновних потенціалів (редокс-потенціалів) і електрорушійної сили (
), або окислювально-відновних потенціалів (редокс-потенціалів) і електрорушійної сили (![]() , В).
, В).
Якщо сила окисників і відновників, наприклад, неметалів, металів та їх солей в твердому вигляді визначається за величинами енергій спорідненості електрона до атому (окисник) і енергії йонізації (відновник), то для характеристики сили окисників і відновників у водних розчинах користуються величинами стандартних електродних потенціалів (для металічних пар, наприклад: ![]() = -0,76 В,
= -0,76 В, ![]() = +0,34 В та ін.), або стандартною величиною редокс-потенціала (окислювально-відновного потенціалу для інших окиснювально-відновних систем, наприклад,
= +0,34 В та ін.), або стандартною величиною редокс-потенціала (окислювально-відновного потенціалу для інших окиснювально-відновних систем, наприклад, ![]() = +0,77 В;
= +0,77 В; ![]() = +0,96 В;
= +0,96 В; ![]() = +1,61 В та ін.).
= +1,61 В та ін.).
Електродний потенціал – це різниця потенціалів, яка виникає на межі розділу фаз «метал-розчин» при занурені електроду (металічної пластини, дроту) в розчин електроліту, за рахунок утворення подвійного електричного шару.
На межі метал-розчин встановлюється рівновага:
Mе + mH2O → Mе![]() + n
+ n![]()
Для активних металів позитивні йони металів в гідратованому вигляді переходять в розчин, а пластинка заряджається негативно за рахунок надлишку електронів, спрощено:
Zn → Zn![]() + 2
+ 2![]()
Для неактивних металів (Cu, Ag, Hg та ін.): Cu![]() + 2
+ 2![]() → Cu0 йони металу (Cu
→ Cu0 йони металу (Cu![]() ) будуть розряджатися на мідній пластинці, забираючи з електроду електрони. Внаслідок цього Cu-електрод буде заряджатися позитивно. Негативно і позитивно заряджені електроди будуть притягувати з розчину протийони. Таким чином, утворюється подвійний електричний шар, який характеризує певну різницю потенціалів на межі "метал-розчин". Якщо з’єднати обидва електроди через гальванометр, то він зафіксує в системі електричний струм. Так утворюється гальванічний елемент:
) будуть розряджатися на мідній пластинці, забираючи з електроду електрони. Внаслідок цього Cu-електрод буде заряджатися позитивно. Негативно і позитивно заряджені електроди будуть притягувати з розчину протийони. Таким чином, утворюється подвійний електричний шар, який характеризує певну різницю потенціалів на межі "метал-розчин". Якщо з’єднати обидва електроди через гальванометр, то він зафіксує в системі електричний струм. Так утворюється гальванічний елемент:
Zn / Zn![]() //Cu
//Cu![]() / Cu0
/ Cu0
Цю різницю потенціалів безпосередньо виміряти неможливо. Тому її визначають непрямим шляхом: відносно стандартних електродів, потенціал яких відомий (наприклад, водневого, каломельного, хлорсрібного та ін.).
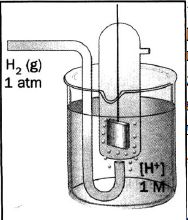
|
Рисунок 7.1 – Водневий електрод |
Водневий електрод (рисунок 7.1) – це платиновий дротик, на який нанесені дрібнодисперсні частинки Рt, занурений у водний розчин H2SO4 ([H |
Для вимірювання електродних потенціалів металів складають гальванічний елемент (ГЕ) із металічного електроду, наприклад, цинкового і водневого. В результаті чого відбуваються такі процеси:
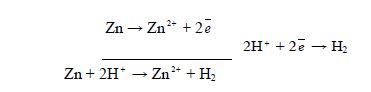 Вимірюють електрорушійну силу (Е.р.с.) цього ГЕ за допомогою гальванометра. У даному випадку Е.р.с = 0,76 В =
Вимірюють електрорушійну силу (Е.р.с.) цього ГЕ за допомогою гальванометра. У даному випадку Е.р.с = 0,76 В = ![]() :
:
![]()
Тому можна записати:
![]() =
=![]() –
–![]() =0,76 В, де
=0,76 В, де ![]() = 0 В;
= 0 В; ![]() = -0,76 В.
= -0,76 В.
Таким чином були встановлені стандартні електродні потенціали (СЕП), для інших металів, за якими складено електрохімічний ряд напруг :
Li K Ca Na Mg Αl Mn Zn Fe Ni Sn Pb H Cu Ag Au
СЕП враховують особливості взаємодії йонів металу із молекулами розчинника. Наприклад, йон Літію характеризується високим значенням енергії гідратації, в порівнянні з іншими металами, чим і пояснюється його місце в ряді напруг: ![]() = -3,05 В, тоді як для
= -3,05 В, тоді як для ![]() =-2,71 В.
=-2,71 В.
Цей ряд, який раніше називали витискувальним рядом М.М. Бекетова, характеризує активність металів як відновників (максимальна активність у літію та інших лужних металів, мінімальна – в кінці ряду – у Аргентуму, Ауруму), а також активність йонів металів як окисників (максимальна активність у Au![]() :
: ![]() =1,692 В, велика у Pt
=1,692 В, велика у Pt![]() :
: ![]() =1,188 B, Ag
=1,188 B, Ag![]() :
: ![]() = 0,8 В).
= 0,8 В).
Таким чином, ряд напруг характеризує хімічні властивості металів:
1. Чим більше негативне значення ![]() ,тим більша відновлювальна здатність металів і менша окиснювальна здатність їх йонів.
,тим більша відновлювальна здатність металів і менша окиснювальна здатність їх йонів.
2. Чим лівіше знаходиться метал в ряді напруг, тим він більш хімічно активний, і навпаки, чим правіше – тим менш активний.
3. Кожний метал ряду відновлює катіони всіх наступних за ним металів із розчинів їх солей:
![]() + Fe →
+ Fe → ![]() + Hg
+ Hg
4. Метали, що знаходяться лівіше Гідрогену, відновлюють його із розбавлених кислот (крім HNO3), а Мg і метали, що знаходяться лівіше від нього витісняють Гідроген із води (за звичайних умов). Метали, які розмішені правіше Гідрогену, не витісняють його із кислот.
Отже, за алгебраїчним значенням стандартного електродного (редокс- потенціалу) можна встановити напрямок окисно-відновної реакції. Для цього потрібно порівняти значення стандартних ![]() , знайти окиснювач (той, якому відповідає більший
, знайти окиснювач (той, якому відповідає більший ![]() ) і відновник (з меншим значенням
) і відновник (з меншим значенням ![]() ), величина
), величина ![]() повинна мати позитивне значення (
повинна мати позитивне значення (![]() >0).
>0).
Наприклад, реакція Cu0 + Zn![]() → Cu
→ Cu![]() + Zn буде відбуватися в зворотному напрямку, тому що
+ Zn буде відбуватися в зворотному напрямку, тому що ![]() = -0,76 В а
= -0,76 В а ![]() =+0,34 В. Тобто Cu
=+0,34 В. Тобто Cu![]() – окисник, а Zn – відновник. Дійсно
– окисник, а Zn – відновник. Дійсно ![]() > 0:
> 0: ![]() = 0,34 – (-0,76) = +1,1 В.
= 0,34 – (-0,76) = +1,1 В.
Якщо умови реакції відрізняються від стандартних, Е знаходять за рівнянням Нернста
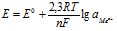 , (7.1)
, (7.1)
де ![]() – стандартний електродний потенціал, В; R – універсальна газова стала; Т – абсолютна температура, К; n – число електронів, які віддає відновник або приймає окисник; F – число Фарадея.
– стандартний електродний потенціал, В; R – універсальна газова стала; Т – абсолютна температура, К; n – число електронів, які віддає відновник або приймає окисник; F – число Фарадея.
Врахувавши, що ![]() :
:
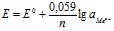 або
або 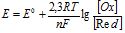 (7.2)
(7.2)
Е.Р.С. (![]() ) зв’язана з енергію Гіббса:
) зв’язана з енергію Гіббса: ![]() але:
але: ![]() , де К – константа хімічної рівноваги, тому
, де К – константа хімічної рівноваги, тому
![]() (7.3)
(7.3)
оскільки ![]() , то
, то
![]() (7.4)
(7.4)
За величиною К можна також встановити напрямок ОВР
K > 104 – реакція відбувається необоротно;
K = 103…10-3 – оборотні реакції;
K > – можуть відбуватися за умови надлишку реактиву;
К < – реакції не відбуваються.
Таким чином напрямок ОВР можна встановити за величиною ![]() ,
, ![]() , К (lgK): реакція відбувається в заданому напрямку якщо:
, К (lgK): реакція відбувається в заданому напрямку якщо:
1) ![]() < 0
< 0
2) ![]() > 0
> 0
3) К > 1; lgK > 0.
Величина ![]() залежить від значення pH розчину (концентрації
залежить від значення pH розчину (концентрації
Н![]() -йонів). Наприклад, для реакції
-йонів). Наприклад, для реакції
MnO4- + 8H++![]() = Mn2+ + 4H2O
= Mn2+ + 4H2O
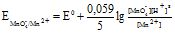
Враховуючи величину pH визначають К: ![]() , в даному випадку Z = 8 (8H
, в даному випадку Z = 8 (8H![]() ).
).
Для реакції Red = Ox + – n![]() + zH
+ zH![]() (йони Гідрогену в правій частинні рівняння):
(йони Гідрогену в правій частинні рівняння): ![]() .
.
Величина Е залежить також від Т за рівнянням Нернста-Петерса:
![]() . (7.5)
. (7.5)
Гальванічні елементи (ГЕ) - хімічні джерела електричної енергії. ГЕ є незворотним джерелом одноразової дії. Гальванічний елемент працює доти, доки не витратиться один з електродів. В ГЕ завжди розчиняється найбільш активний метал. Згідно схемі ГЕ, наприклад: Ag – Сu (рисунок 7.2) в ньому відбуваються таки процеси:
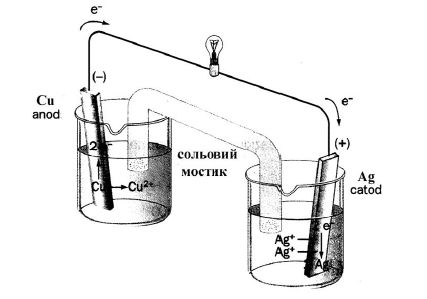
Рисунок 7.2 – Принципова схема гальванічного елемента.
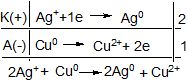
Електрони прямують з мідного електроду до срібного. Негативно зарядженим електродом буде мідь (анод), а срібло – позитивно заряджений електрод (катод) (у випадку електролізу анод (+) ,катод (-)). Тут не має протиріччя, бо на аноді завжди проходить окиснення, а на катоді – відновлення. Дійсно Cu0 → Cu![]() окиснюється, а Ag
окиснюється, а Ag![]() → Ag0 відновлюється.
→ Ag0 відновлюється.
![]() =
=![]() –
–![]() = 0,8 – 0,34 = 0,46 B.
= 0,8 – 0,34 = 0,46 B.
Перший ГЕ був запропонований італійським вченим Вольтом. Це цинкові і мідні пластини, між якими знаходиться сукно, зволожене сульфатною кислотою: Zn / H![]() /Cu . Тоді на цинковій пластині: Zn → Zn
/Cu . Тоді на цинковій пластині: Zn → Zn![]() + 2
+ 2![]() ; на мідній (інертний електрод в даному випадку): 2H
; на мідній (інертний електрод в даному випадку): 2H![]() + 2
+ 2![]() → 2H2. Сумарний процес:
→ 2H2. Сумарний процес:
Zn + 2H![]() → Zn
→ Zn![]() + H2,
+ H2, ![]() =0,76 В.
=0,76 В.
В техніці широко використовують сухі гальванічні елементи (радіотелеграф, телефонна апаратура та ін.)
Наприклад ГЕ Ле-Клакше (рисунок 7.3 а):
А(-) Zn / NH4Cl // MnO2 / C K (+)
2Zn + 4NH![]() + MnO2 → [Zn(NH3)4]2+ + Zn
+ MnO2 → [Zn(NH3)4]2+ + Zn![]() + MnOOH + 3H
+ MnOOH + 3H![]()
![]() =1,5 В.
=1,5 В.
ГЕ Грене:
3Zn + Cr2O![]() + 14H
+ 14H![]() → 3Zn
→ 3Zn![]() + 2Cr
+ 2Cr![]() + 7H2O.
+ 7H2O.
ГЕ окиснортутний (рисунок 7.3 б):
HgO + Zn + 2KOH → Hg + K2ZnO2 +H2O
ГЕ срібно-магнієвий (може працювати за низьких температур):
2AgCl + Mg → 2Ag + MgCl2.
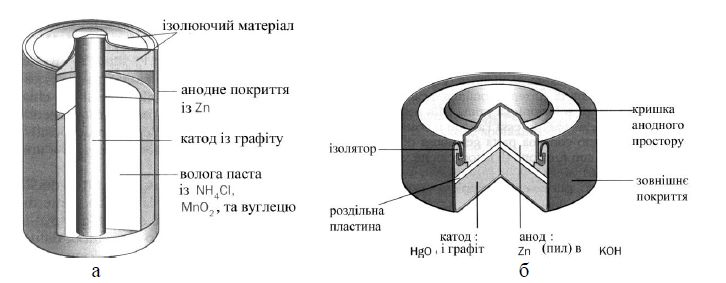
а – гальванічний елемент Ле-Клакше; б – окиснортутний гальванічний елемент
Рисунок 7.3 – Гальванічні елементи
Акумулятори – це оборотні джерела електричної енергії (багаторазової дії). Вони бувають:
– кислотними (плюмбумні) ![]() =2,1 В; під час розрядки густина електроліту H2SO4 знижується:
=2,1 В; під час розрядки густина електроліту H2SO4 знижується:
Pb + PbO2 +2H2SO4 ![]() 2PbSO4 + 2H2O
2PbSO4 + 2H2O
– кадмій-нікелеві (Юнгера), електроліт – КОН
2Ni(OH)3 + Cd → 2Ni(OH)2 + Cd(OH)2
– срібно-цинкові
Ag2O + 2Zn +2H2O → 2Ag + 2Zn(OH)2
Можливе утворення цинкатів за тривалого режиму розрядки акумулятора.
Дуже перспективними і екологічно чистими є паливні елементи, наприклад воднево-кисневий.
Перший паливний елемент запропонував російський вчений П.І.Яблоков (в 80-х роках 19 сторіччя він одержав на нього патент). Але використаний вперше він був лише у ХХ сторіччі на американському космічному кораблі «Джемінай». Паливом в цих елементах може бути не тільки водень, але і вуглеводні, гідразин, та ін.