Тема 7 Загальні властивості металів
|
План 7.1 Особливості будови атомів металів 7.2 Фізичниі властивості металів 7.3 Хімічні властивості 7.4 Способи отримання металів 7.5 Сплави |
7.1. Особливості будови атомів металів
За найпершою класифікацією (А.Л. Лавуазьє та Й.Я. Берцеліус) прості речовини розділили на метали та неметали. До металів віднесли речовини з характерним „металічним” блиском, які можна кувати. М.В. Ломоносов дав таке визначення металів: ”Металлом называется светлое тело, которое ковать можно”. З розвитком хімії були виявлені інші властивості, характерні лише для металів.
Якщо в періодичній системі провести діагональ від бору до астату, то в правій верхній частині будуть знаходитись неметали (за виключенням елементів побічних підгруп), а в лівій нижній – метали. Елементи головних підгруп, які розташовані поблизу діагоналі (Be, Al, Ga, Sn, Pb), мають подвійний характер, тобто проявляють проміжні властивості. Поділ на метали і неметали є умовним. Деякі елементи (Te, As, Sb, Ge) поводяться як метали в одних умовах і як неметали в інших.
Атоми металів, на відміну від атомів неметалів, мають значно більший розмір атомних радіусів. Тому вони легко віддають валентні електрони, виступаючи відновниками. Відновні властивості металів зростають в електрохімічному ряду напруг металів від Au до К.
Найактивнішими є метали головної підгрупи І групи (валентність І), особливо Fr. Активними металами є також елементи головної підгрупи ІІ групи (валентність ІІ), найактивніший з яких Ra.
Атоми металів побічних підгруп мають, як правило, у зовнішньому електронному шарі 1-2 електрони, а в передзовнішньому – більше восьми. Для цих металів характерні різні ступені окислення (залежно від кількості d-електронів на передзовнішньому енергетичному рівні).
Наприклад:
+24 Cr 1s22s22p63s23p64s23d4
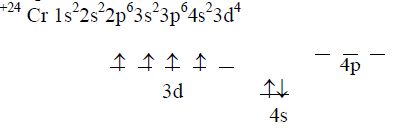
У цьому стані характерний ступінь окислення для Хрому +2.
У збудженому стані:
+24 Cr*
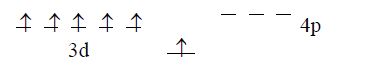
Тому можливі ступені окислення для Хрому у збудженому стані +3 (кожний із трьох електронів іону Cr3+ займає одну з орбіталей dxy, dxz, dyz, утворюючи систему з мінімальною енергією) та +6.
В атомах d-елементів (перехідні метали) електрони заповнюють внутрішні енергетичні рівні, тому утримуються ядром сильніше, ніж електрони, розташовані на останньому енергетичному рівні. Цим і пояснюється те, що радіуси атомів елементів побічних підгруп менші, ніж передбачалися за аналогією з атомами металів головних підгруп за нормального заповнення електронних шарів. Тому й виникає різка зміна активності металів головних і побічних підгруп.
7.2 Фізичні властивості металів
Твердий агрегатний стан (за винятком ртуті), кристалічна структура, електро- та теплопровідність, специфічні механічні властивості (наприклад, пластичність). Вони непрозорі, мають металічний блиск. У найбільшій мірі властивість відбивати світло проявляється у срібла та індію, тому ці метали застосовуються при виготовлені звичайних та прожекторних дзеркал, рефлекторів. Метали мають блиск лише в компактному стані, а в дрібнодисперсному стані більшість з них чорного кольору і не мають блиску. Алюміній і магній зберігають металічний блиск навіть у порошкоподібному стані, вони здатні відбивати радіохвилі (ця властивість використовується в радіолокації).
Найкраще проводять струм золото, срібло, мідь, алюміній. З підвищенням температури електропровідність зменшується. Пластичність металів (здатність прокатуватися в тонкі листи, витягуватися в дріт) зменшується в ряду: золото, срібло, мідь, свинець, цинк, залізо.
За ступенем твердості всі метали значно відрізняються один від одного. Наприклад, калій та натрій – м’які метали, їх можна різати ножем, а хром за твердістю близький до алмазу.
Температура плавлення та густина металів також змінюється в широких інтервалах. Найбільш легкоплавкий метал – ртуть (температура плавлення -38,8 оС), найбільш тугоплавкий – вольфрам (температура плавлення 3390 оС). Тому вольфрам застосовують для виготовлення ниток розжарювання для електричних ламп. Метали, які мають температуру плавлення вище 1000оС, називаються тугоплавкими, нижче – легкоплавкими.
За густиною всі метали поділяють на легкі та важкі. До легких належать метали, густина яких менше 6 г/см3: лужні (Li, Na, K, Rb, Cs), лужноземельні (Ca, Sr, Ba), а також магній, берилій, скандій, титан, алюміній, ітрій тощо. Але не всі з цих металів мають необхідні в практичній діяльності людини механічні властивості. З іншого боку широке використання металу обмежується його вартістю. Найбільш легким металом є літій, густина якого 0,53г/см3, а найбільш важким – осмій, густина якого 22,7г/см3.
Метали відрізняються відношенням до електромагнітного поля. За цією властивістю вони поділяються на:
- феромагнітні метали – здатні намагнічуватися при дії слабких магнітних полів (наприклад, залізо, кобальт, нікель, гадоліній);
- парамагнітні метали – мають слабку здатність до намагнічування (алюміній, хром, титан та більша частина лантаноїдів);
- діамагнітні метали – не притягуються магнітом і навіть трохи відштовхуються від нього (наприклад, олово, мідь).
Схожість фізичних властивостей металів (електропровідність, блиск, пластичність, тугоплавкість) пояснюється особливістю будови їх кристалічних ґраток та металічним зв’язком. Метали мають кристалічну структуру, і для них характерні три типи кристалічних ґраток: кубічна гранецентрована, кубічна об’ємноцентрована і гексагональна. Характерні властивості металів є наслідком їхньої будови. Електрони, які заповнюють міжатомний простір, відбивають світлові промені. Це викликає непрозорість і блиск металів. Електрони в процесі свого переміщення всередині кристалічної ґратки металу переносять теплову енергію від нагрітих шарів до холодних. Хаотичний рух електронів у середині металу під дією прикладеної електричної напруги перетворюється в направлений, тобто метали проводять електричний струм. При підвищенні температури металу збільшується амплітуда коливання атомів та іонів, розташованих у вузлах кристалічної ґратки. Це ускладнює переміщення електронів, і електрична провідність металу зменшується. Від удару метал не руйнується, хоча окремі шари кристалічної ґратки при цьому зміщуються. Зчеплення між шарами весь час зберігається завдяки можливості вільного перерозподілу електронів.
7.3 Хімічні властивості
Метали мають відновні властивості. В цьому полягає їх головна, найбільш важлива загальна хімічна властивість.
В ряду Al, Be, Mg, Ca, Li, Na, K, Rb, Cs відновна властивість збільшується. Метали як відновники вступають в реакції з різними окисниками, серед яких можуть бути прості речовини, кислоти, солі менш активних металів і деякі інші сполуки.
Відношення металів до простих речовин:
Метали утворюють оксиди, наприклад:
2Са + O2 → 2СаO; 2Fe + O2 → 2FeO,
лужні метали поводять себе по-різному по відношенню до кисню:
4Li + O2 → 2Li2O; літій оксид
2Na + O2 → Na2O2; натрій пероксид
K + O2 → KO2. калій надпероксид,
Метали взаємодіють із галоґенами:
Ca + Cl2 → CaCl2.
Найбільш активні метали головних підгруп настільки сильні відновники, що відновлюють навіть водень до ступеня окислення -1:
Ca + H2 → CaH2
кальцій гідрид
Менш енергійно метали взаємодіють із сіркою:
Fe + S ![]() FeS.
FeS.
Ще менш енергійно метали реагують з азотом і фосфором:
3Mg + N2 → Mg3N2; 3Ca + 2P → Ca3P2.
Відношення металів до кислот:
Метали, що знаходяться в електрохімічному ряду напруг до водню, відновлюють йони водню з розбавлених кислот (за винятком йонів водню в HNO3):
2Al + 6HCl → 2AlCl3 + 3H2↑;
Fe + 2HCl → FeCl2 + H2↑.
Метали, що знаходяться в ряду напруг після водню, не відновлюють водень з розбавлених розчинів кислот.
Розчини концентрованої сірчаної та азотної кислот, а також розбавлені розчини азотної кислоти, специфічно реагують з металами:
Взаємодія з концентрованою сірчаною кислотою:
– якщо метал знаходиться в електрохімічному ряду напруг до водню, то в результаті взаємодії з H2SO4 в залежності від умов перебігу реакції може відновлюватись SO2, S, H2S, наприклад:
Zn + 2H2SO4 ![]() ZnSO4 + SO2↑ + 2H2O;
ZnSO4 + SO2↑ + 2H2O;
3Zn + 4H2SO4 ![]() 3ZnSO4 + S + 4H2O;
3ZnSO4 + S + 4H2O;
4Mg + 5H2SO4 → 4MgSO4 + H2S↑ + 4H2O.
– якщо метал знаходиться в ряду напруг після водню, то з розчину H2SO4 відновлюється SO2:
Cu + 2H2SO4 → CuSO4 + SO2↑ + 2H2O;
2Ag + 2H2SO4 → Ag2SO4 + SO2↑ + 2H2O.
Взаємодія металів з азотною кислотою:
Таблиця 7.1 – Взаємодія металів з азотною кислотою
|
Активні метали (Mg, Zn) |
Метали середньої активності (Fe, Cr, Ni) |
Малоактивні метали (Pb, Cu, Hg, Ag) |
Благородні метали (Au, Pt, Os, Ir) |
||||
|
з HNO3 конц. |
з HNO3 розб. |
з HNO3 дуже розб. |
з HNO3 конц. |
з HNO3 різної конц. |
з HNO3 конц. |
з HNO3 розбав. |
з HNO3 будь-якої конц. |
|
NO |
N2O або N2 |
NH3 (солі амонію) |
Не реагують |
NO2, NO, N2O або NH3 |
NO2 |
NO |
не реагують |
Відношення металів до розчинів солей:
При взаємодії з водними розчинами солей виконується таке правило: метали, які розташовані в електрохімічному ряду напруг ліворуч, відновлюють метали, що розташовані праворуч від них, з розчинів солей цих металів:
Zn + Pb(NO3)2 → Zn(NO3)2 + Pb↓.
Тобто більш активний метал здатний відновлювати менш активний метал із розчину його солію
Найбільш активні метали (Сa, Li, Na, K, Rb, Cs) реагують з водою за звичайних умов:
2Na + 2H2O → 2 NaOH + H2↑ (утворюються розчинні у воді основи – луги, і виділяється водень).
Менш активні метали реагують з водою за підвищеної температури з виділенням водню і утворенням оксиду або гідроксиду відповідного металу:
Zn + H2O ![]() ZnO + H2↑.
ZnO + H2↑.
Відношення металів до основ:
Метали, гідроксиди яких амфотерні (Be, Al, Zn), як правило, взаємодіють з розчинами і кислот, і лугів, наприклад:
Be + 2HCl → BeCl2 + H2↑;
Be + 2KOH + 2H2O → K2[Be(OH)4] + H2↑
Таким чином, відношення металів до неметалів, води, кислот, лугів, розчинів солей менш активних металів підтверджує їх головну хімічну властивість – відновну здатність.
Метали можуть утворювати хімічні сполуки між собою. Вони називаються інтерметалічні сполуки або металіди (наприклад, Na2Sb, AlSb, NiSb тощо). У них найчастіше не зберігаються ступені окиснення, характерні для сполук з неметалами. Хімічний зв’язок у металідах – металічний. За зовнішнім виглядом вони схожі на метали. Їх твердість вища, а пластичність набагато менша, ніж у металів, що утворюють металід. Металіди знайшли практичне застосування як напівпровідники.
7.4 Способи одержання металів
Значна хімічна активність металів призводить до того, що в земній корі вони зустрічаються переважно у вигляді сполук: оксидів, сульфідів, сульфатів, хлоридів, карбонатів тощо. Тільки деякі метали зустрічаються у вільному стані (наприклад, золото, платина, іноді срібло та мідь, може зустрічатися ртуть). Метали, які розташовані в електрохімічному ряду напруг ліворуч від водню, у вільному стані не зустрічаються.
Золото та платину отримують або шляхом механічного відділення їх від тієї породи, в якій вони містяться, наприклад, шляхом промивання водою, або шляхом вилучення їх з породи різними реагентами з наступним виділенням з розчину. Всі інші метали добувають хімічною переробкою їх природних сполук.
Мінерали та гірські породи, що містять в своєму складі метали або їх сполуки та придатні для промислового отримання металів, називаються рудами.
Для виділення металів з їхніх сполук, що містяться в рудах, необхідно здійснити процес їх відновлення:
Men+ + ne → Me0.
Отримання металів з руд – завдання металургії. Металургія – це наука про промислові способи отримання металів із природної сировини. Сучасна металургія отримує більше 75 металів та сплави на їх основі.
Розрізняють чорну та кольорову металургію. До чорної металургії відноситься виробництво заліза, а також марганцю та хрому, тобто металів, які використовують в якості добавок до заліза, а до кольорової – виробництво всіх інших металів та їхніх сплавів.
Залежно від способів отримання металів розрізняють піро-, гідро- те електрометалургію.
Пірометалургія займає провідне місце у металургії. Вона охоплює способи отримання металів з руд за допомогою реакцій відновлення, що проходять за високої температури. В якості відновників застосовують вугілля, чадний газ, водень, метан:
Сu2O + C → 2Cu + CO; Сu2O + CO → 2Cu + CO2.
куприт кокс куприт чадний газ
Якщо руда – сульфід металу, її попередньо переводять в оксид шляхом випалювання:
2ZnS + 3O2 → 2ZnO + 2SO2,
потім оксид металу відновлюють:
ZnO + C → Zn + CO.
Відновлення металів за допомогою більш активних металів, називають металотермією. Наприклад:
Cr2O3 + 2Al → 2Cr + Al2O3;
TiCl4 + 2Mg → Ti + 2MgCl2.
Металотермією зазвичай отримують ті метали, які при відновленні їхніх оксидів вуглецем утворюють карбіди. Це Mn, Cr, Ti, Mo, W тощо.
Іноді метали відновлюють з оксидів воднем. Наприклад:
MoO3 + 3H2 → Mo + 3H2O;
WO3 + 3H2 → W + 3H2O, так отримують більш чисті метали.
Гідрометалургія охоплює способи отримання металів з розчинів їхніх солей. При цьому метали, що входять до складу руди, спочатку переводять у розчин за допомогою відповідних реактивів, а потім вилучають з цього розчину:
CuO + H2SO4 → CuSO4 + H2O.
Мідь переходить у розчин у вигляді сульфату, потім її вилучають з розчину електролізом або витісняють за допомогою порошку заліза.
CuSO4 + Fe → Cu + FeSO4.
Гідрометалургійним методом отримують до 25% усієї міді, яку видобувають. Так добувають і золото, якщо воно розсіяне у руді:
4Au + 8KCN + O2 + 2H2O → 4K[Au(CN)2] + 4KOH;
2K[Au(CN)2] + Zn → K2[Zn(CN)4] + 2Au.
Електрометалургія охоплює способи отримання металів за допомогою електролізу. Цим способом добувають із розплавлених оксидів головним чином легкі метали: алюміній, натрій тощо. Наприклад, з розплаву ![]() при використанні інертних електродів:
при використанні інертних електродів:
![]()
|
–К |
|
2 |
|
+А |
|
1 |
|
|
|
|
Отже в основі всіх способів отримання металів з їхніх сполук лежать окисно-відновні процеси.
7.5 Сплави
Поряд з цінними властивостями, метали мають і таки характеристики, які небажані при виготовленні різних виробів. Наприклад, мідь та алюміній мають гарну електро- і теплопровідність, пластичність, але вони м’які, легко деформуються, і тому в чистому вигляді є непридатними для виготовлення металічних виробів. Тому частіше використовують сплави. Сплави – це системи, які складаються з двох або декількох металів та мають властивості, характерні для металічного стану.
Ознаки, за якими можна класифікувати сплави:
- за кількістю компонентів: подвійні, потрійні тощо;
- за структурою: гомогенні (однофазні), гетерогенні (суміші), що складаються з декількох фаз;
- за характером металу, що складає основу сплаву – чорні (сталь, чавун), кольорові (сплави алюмінію, міді, нікелю і т.д.);
- за характерними властивостями (тугоплавкі, легкоплавкі, жароміцні, високоміцні, тверді, корозійностійкі);
- за технологічними ознаками: ливарні (для виготовлення деталей ливарними шляхом) та деформаційні (піддаються штампуванню, прокату та іншим видам обробки).
До складу сплавів можуть входити також неметали, наприклад, вуглець, кремній, бор. Властивості сплавів дуже різноманітні, вони залежать від складу сплаву та його внутрішньої структури.
Температура плавлення сплавів зазвичай нижча, а міцність і твердість вища, ніж у компонентів, які його утворюють. Сплав золота і срібла має більшу твердість, тоді як окремі метали є порівняно м’якими. Хімічний зв’язок у сплавах металічний. Сплави мають меншу електричну провідність і теплопровідність, ніж метали, що їх утворюють. Корозійна стійкість багатьох сплавів вища, ніж індивідуальних металів.
Найбільш важливі сплави кольорових металів:
Сплави на основі міді:
Латунь – сплав міді (від 60 до 90%) і цинку (40-10%). Міцніший за мідь, стійкий до окиснення. Застосовується в машинобудуванні, виготовленні побутових виробів.
Бронза. Давня справжня бронза – це сплав міді і 8-10% олова. Зараз олов’яна бронза поступово витісняється іншими бронзами, які мають кращі конструкційні властивості, до того ж, олово – дефіцитний метал. Алюмінієві бронзи містять 5-11% алюмінію. Наприклад, з алюмінієвої бронзи роблять розмінну монету „мідь”, виготовляють авіаційні двигуни. Свинцева бронза містить 25-28% свинцю, застосовується для виготовлення підшипників. Кремнієва бронза містить 4-5% кремнію, використовується як дешевий замінник олов’яної бронзи.
Мідно-нікелеві сплави:
Мельхіор. Містить 29-33% нікелю, стійкий до дії морської води, перегрітого пару та інших агресивних середовищ. Застосовують для виготовлення побутових речей: виделок, ложок, ножів. Мельхіор із вмістом нікелю 18-20% іде на виготовлення монет „срібло”. Нейзільбер – сплав міді, нікелю (13,5-16,5%) та цинку (18-22%) – з нього виготовляють медичні інструменти, побутовий посуд, художні вироби.
Сплави на основі нікелю:
Ніхром – сплави нікелю з хромом і з добавкою інших металів. Наприклад, 80% нікелю, 20% хрому або 60% нікелю, 25% заліза, 15% хрому. Їх використовують для виготовлення нагрівальних приладів.
Сплави на основі алюмінію:
Силуміни. Сплав алюмінію (85-90%) з кремнієм (10-15%). За міцністю силуміни не гірші від сталі, але набагато легші і мають винятково високі ливарні властивості, широко застосовуються в машинобудуванні.
Дюралюмін. Це складний сплав: ≈ 4% міді, 1% магнію, 1% кремнію, 1% мангану та 93% алюмінію. Для них характерні високі механічні властивості, за твердістю вони наближаються до сталі, але в 3 рази легші за неї. Алюмінієві сплави широко застосовуються в авіаційній техніці, авто- та кораблебудуванні, також їх використовують для обшивки літаків, автобусів.