Тема 9 s- Елементи ІІ А групи
|
План 9.1 Загальна характеристика елементів ІІ А групи. 9.2 Знаходження у природі. 9.3 Фізичні властивості. 9.4 Способи добування. 9.5 Хімічні властивості. 9.6 Сполуки елементів ІІ А групи. 9.7 Застосування. 9.8 Біологічна роль та токсикологія. |
9.1 Загальна характеристика елементів ІІ А групи
До ІІ А групи періодичної системи Д.І. Менделєєва належать Берилій 4Ве, Магній 12Мg та чотири лужноземельні метали (ЛЗМ): Кальцій 20Са, Стронцій 38Sr, Барій 56Ва та Радій 88Rа (радіоактивний елемент). Електронна конфігурація зовнішнього шару – ns2. Характерна ступінь окиснення в сполуках +2, але є відомості про існування сполук зі ступенем окиснення +1. Завершеність ns-атомної орбіталі (АО) передбачає інертність елементів, але наявність близько розташованих nр-АО дозволяє електронам легко переходити на гібридні sр-орбіталі та брати участь в утворенні двох зв'язків. Цей перехід характерний для першого елементу групи – Берилію та частково для Магнію. Інші елементи ковалентних зв'язків практично не утворюють і в сполуках знаходяться виключно у вигляді двозарядних катіонів Ме2+. Як і в ряді лужних металів, радіус атомів елементів та йонні радіуси збільшуються в групі зверху вниз, енергія йонізації зменшується.
Берилій, подібно до елементу першої групи Літію, значно відрізняється за властивостями від інших елементів другої групи. Це також пояснюється дуже малим розміром йонного радіуса, високою густиною заряду, великим значенням енергії атомізації та йонізації. Відсутність d-орбіталей призводить до того, що координаційне число для Берилію дорівнює 4. За багатьма властивостями Берилій схожий на Алюміній (діагональна схожість). Магній займає проміжне положення, з одного боку він схожий до лужноземельних металів (переважно іонний характер сполук, наявність координаційного числа 6), а з іншого (розчинність гідроксиду, солей) – до Берилію. Лужноземельні елементи (Са, Sr, Ва та Rа) утворюють єдину родину, в межах якої властивості змінюються більш менш монотонно. Для них характерне утворення йонних зв'язків та високі координаційні числа.
9.2 Знаходження у природі
Серед елементів другої групи найбільш розповсюдженими є Кальцій та Магній (2,96 та 2,50 мас.%).
Магній входить до складу багатьох силікатів та алюмосилікатів, наприклад, 2MgO·SiO2 – олівін, MgO·Al2O3 – шпінель, 3MgO·4SiO2·H2O – тальк. Під час випаровування морської води магній осідає у вигляді гіркої солі MgSO4∙7H2O, карналіту KCl∙MgCl2∙6H2O. Досить поширеними мінералами є MgCO3·CaCO3 – доломіт, магнезит MgCO3, азбест Mg3Ca(SiO3)4.
Берилій належить до рідкісних елементів (2·10-4 мас.%). В природі зустрічається у вигляді мінералу берилу 3BeO∙Al2O3∙6SiO2. Відомо кілька алотропних модифікацій берилу. Прозорі його зразки, забарвлені домішками в різні кольори, є коштовними каменями (аквамарини). Ізоморфне заміщення частини йонів Аl3+ на Cr3+ забарвлює берил у зелений колір, це смарагд. Берилій входить також до складу мінералів фенакіту Be2SiO4 та хризоберилу Be(AlO2)2. Прозорі кристали останнього мінералу називаються олександритом.
Кальцій утворює 385 мінералів. Більша частина кальцію знаходиться в складі силікатів та алюмосилікатів, наприклад, у польовому шпаті Са[Аl2Si2O8] анортиті. У вигляді осадових порід сполуки кальцію представлені крейдою та вапняками, які складаються в основному з мінералу кальциту CaCO3, рідше зустрічається його кристалічна форма – мармур. Доволі широко розповсюджені ангідрит CaSO4, гіпс CaSO4·2H2O, флюорит СаF2, доломіт MgCO3·CaCO3 і т.д. Наявність сполук кальцію та магнію у воді визначає її твердість.
Стронцій (0,065 мас.%) та Барій (0,065 мас.%) зустрічаються у вигляді карбонатів (вітерит ВaCO3, стронціаніт SrCO3), сульфатів (SrSO4 целестин, ВaSO4 барит).
|
|
|
|
Рисунок. 9.1 – "Гіпсова троянда" з Сахари, 10 см довжиною |
Рисунок 9.2 – Кристали смарагду |
9.3 Фізичні властивості
У вільному вигляді елементи другої групи – сріблясто-білі метали. Берилій відрізняється від інших високою твердістю та порівняно низькою пластичністю. Магній та лужноземельні метали – ковкі та пластичні метали, відносно м'які. В цілому, в порівнянні з лужними металами, метали ІІ А групи мають більшу густину, твердість, температуру плавлення. Все це свідчить про те, що металевий зв'язок міцніший, ніж у лужних металів, тому що в його утворенні беруть участь обидва валентні електрони, а зменшення атомного радіуса призводить до більш повного перекриття орбіталей.
9.4 Способи добування
Берилій та магній в промисловості добувають переважно електролізом їхніх розплавлених солей. Першою стадією вапняково-сульфатного методу одержання берилію є спікання берилу з вапном. Одержаний сплав обробляють сульфатною кислотою, переводячи берилій в берилій сульфат. Потім здійснюють такі перетворення:
BeSO4 → Be(OH)2 → BeO → BeCl2.
Також відомі лужний, фторидний, хлоридний метод переробки берилу з відокремленням сполук алюмінію, дуже схожих за властивостями на сполуки берилію.
Металічний берилій одержують електролізом розплаву BeCl2 у суміші з NaCl (знижує температуру, при якій проводять електроліз, до 350 оС).
Магній, кальцій та інші лужноземельні метали одержують, в основному, електролізом розплаву хлоридів з додаванням KCl або зневодненого карналіту, а також карботермією за реакцією:
![]() ↑
↑
Для добування ЛЗМ використовують також алюмотермію:
4СаО + 2 Аl ![]() Са Аl2О4+ 3 Са.
Са Аl2О4+ 3 Са.
9.5 Хімічні властивості
Берилій та магній значно відрізняються за своїми властивостями від лужноземельних металів
Взаємодія з простими речовинами:
Берилій безпосередньо не реагує з воднем і його гідрид одержують непрямим шляхом:
![]()
Магній гідрид одержують безпосередньо взаємодією Mg і H2 за високого тиску і наявності каталізатора – I2:
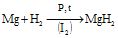
Лужноземельні метали – дуже активні, при нагріванні в атмосфері водню утворюють солеподібні гідриди – МеН2.
Реакції з киснем протікають при нагріванні за рівняннями:
![]()
![]()
При згоранні на повітрі поряд з оксидами утворюються також нітриди Е3N2.
Більш активні ЛЗМ здатні утворювати пероксиди.
Берилій за кімнатної температури безпосередньо взаємодіє з фтором, при нагріванні з вуглецем, азотом, сіркою та галогенами. Магній, кальцій при нагріванні реагують з воднем, галогенами, а також з вуглецем, азотом та сіркою, фосфором.
Взаємодія з водою:
Берилій не реагує з водою навіть за високих температур, оскільки його поверхня вкрита дуже міцною, стійкою плівкою оксиду ВеО.
Магній – стійкий у холодній воді, але інтенсивно взаємодіє з киплячою водою: ![]()
ЛЗМ легко реагують з холодною водою з утворенням лугів:
Са + 2Н2О → Са(ОН)2+ Н2↑
Взаємодія з розбавленими розчинами кислот:
Всі представники легко розчиняються в розбавлених кислотах з утворенням солі та виділенням водню:
![]() ↑
↑
![]() ↑
↑
При взаємодії з розбавленим розчином HNO3 серед продуктів відновлення переважає NH4NO3. Тобто всі ці метали активні відновники:
![]()
Взаємодія з концентрованими кислотами:
У концентрованих холодних HNO3 і H2SO4 берилій пасивується:
Ве + 2HNO3(к) → ВеO + 2NO2↑+ H2О
Ве + H2SO4(к) → ВеО + SO2↑+ H2О
Як активний метал, магній та ЛЗМ відновлюють сульфат-іон при взаємодії з конц. H2SO4 до H2S:
4Mg + 5H2SO4 → 4MgSO4 + H2S↑ + 4H2O
Взаємодія з лугами:
Берилій на відміну від магнію та ЛЗМ реагує з лугами з утворенням гідроксоберилатів:
Be + 2KOH + 2H2O → K2[Be(OH)4] + H2↑
При взаємодії з розплавами лугів за 400-5000С утворюються диоксоберилати:
Be + 2KOH → K2BeO2 + H2↑
9.6 Сполуки елементів ІІ А
Характерний ступінь окиснення у сполуках +2. Оксид BeO амфотерного характеру, за кімнатної температури він не взаємодіє з водою, кислотами, лугами. MgO – основного характеру, легко реагує з кислотами, а в подрібненому стані та при нагріванні – з водою. Оксиди ЛЗМ також мають основний характер, енергійно реагують з водою (з виділенням великої кількості теплоти).
СаО + Н2О → Са(ОН)2
(гашене вапно, водна суспензія – вапнякове молоко).
Для всіх елементів, крім берилію, отримані також пероксиди.
Кальцій оксид – негашене вапно у великих кількостях отримують розкладанням карбонату.
Гідроксиди. Be(OH)2, на відміну від магній гідроксиду Mg(OH)2 та гідроксидів ЛЗМ, одержують непрямим шляхом:
BeSO4 + 2KOH → Be(OH)2 + K2SO4
Be(OH)2 – амфотерний гідроксид:
Be(OH)2 + 2HCl → BeCl2 + 2H2O
2Be(OH)2 + 2NaOH → Na2[Be(OH)4]
Mg(OH)2 та всі гідроксиди ЛЗМ – основні (в ряду магній, кальцій, стронцій, барій збільшується активність, розчинність у воді, термічна стійкість до розкладання).
Магній гідроксид розчиняється у розчині NH4Cl:
Mg(OH)2 + 2NH4Cl → MgCl2 + 2NH3 + 2H2O
Зумовлено це тим, що Mg(OH)2 сильніша основа, ніж розчин аміаку, і NH4Cl розчиняє захисну плівку Mg(OH)2 на поверхні металу, тому металічний магній бурхливо взаємодіє з водою за наявності NH4Cl з виділенням водню.
Галоґеніди берилію – ковалентні сполуки; магнію та ЛЗМ – йонні сполуки, добре розчиняються у воді (крім фторидів, наприклад практично нерозчинний MgF2).
Нітриди Е3N2 – тугоплавкі кристалічні речовини, які незворотно гідролізуються водою.
Mg3N2 + 6H2O → 3Mg(OH)2 + 2NH3
Карбід Be2C – похідний метану, тоді як Mg2C3 – похідний алілену, СаС2 - ацетиленід:
Be2C + 4H2O → 2Be(OH)2 + CH4↑
метан
Mg2C3 + 4H2O → 2Mg(OH)2 + CH3–CCH↑
алілен
СаС2 + 2H2O → Са(OH)2 + C2H2↑
ацетилен
Розчинність сульфатів знижується в групі зверху вниз, а їхня термічна стійкість зростає. Малорозчинний у воді кальцій сульфат виділяється із водних розчинів у вигляді СаSO4·2H2O – гіпс, при нагріванні він переходить в алебастр - СаSO4·0,5H2O, потім в безводний ангідрит СаSO4, який за 12000С розкладається до оксиду СаO.
Карбонати елементів другої групи при нагріванні розкладаються:
![]()
ВеCO3 має найнижчу температуру розкладання.
Солі магнію та кальцію зумовлюють твердість води. Розрізняють некарбонатну твердість (хлориди та сульфати) та карбонатну твердість води (гідроґенкарбонати кальцію і магнію, які в природі виникають внаслідок реакції:
MgCO3 + CO2 + H2O → Mg(HCO3)2.
Розрізняють постійну твердість та тимчасову, що зумовлена гідрогенкарбонатами та видаляється кип'ятінням:
Ca(HCO3)2 ![]() CaCO3 + H2O + CO2↑ .
CaCO3 + H2O + CO2↑ .
Постійна твердість кип'ятінням не усувається.
Для видалення карбонатної твердості методом осадження використовують вапняковий, натронний та содовий методи.
Вапняковий метод використовують у випадку високої карбонатної твердості (Тк) та малої некарбонатної (Тнк):
Ca(HCO3)2 + Ca(OH)2 = 2CaCO3 + 2H2O
Натронний метод.
Ca(HCO3)2 + 2NaOH = CaCO3 + Na2CO3 + 2H2O
Содовий метод.
Ca(HCO3)2 + Na2СO3 = CaCO3 + 2NaНCO3
Для видалення некарбонатної твердості використовують содовий та фосфатний методи.
Содовий метод.
CaSO4 + Na2CO3 = CaCO3 + Na2SO4
Фосфатний метод.
3CaSO4 + 2Na3РO4 = Ca3(РO4)2 + 3Na2SO4
Останнім часом для зниження твердості води широко використовують йоннообмінний метод, який відноситься до фізико-хімічних методів очищення води.
9.7 Застосування
Сфери застосування елементів ІІ А групи та їхніх сполук наведені у таблиці 9.1.
Берилій як легкий, твердий і корозійностійкий метал широко використовується в космічній техніці. В атомній промисловості берилій застосовують у відбивачах і сповільнювачах нейтронів. У великих масштабах використовують різні берилієві сплави, наприклад, сплав міді з 2 % (мас.) берилію – берилієва бронза. Вона не поступається за твердістю сталі і має дуже високу хімічну та механічну стійкість, з неї виготовляють лопатки дробарок і млинів, інструменти, які в процесі роботи не іскрять. Її використовують в літако- і автомобілебудуванні, електротехніці, електронній промисловості та ін. Берилій застосовується у виробництві рентгенівських трубок, неонових світильних трубок та люмінофорів. Сплави берилію використовуються у зварюванні та паянні. Оксид берилію застосовується як вогнетрив, в якості каталізатора в органічному синтезі, у виробництві спеціального скла. Застосування берилію обмежене через високу вартість, шкідливу дію на живі організми та отруйність цього металу. Існує сувора заборона на застосування берилієвих сплавів для технологічного обладнання харчових підприємств, навіть за відсутності їх контакту з харчовим продуктом.
Магній використовується як протектор для захисту корпусів плаваючих засобів від корозії; суміш порошку магнію з окиснювачами використовується в піротехніці.
Додавання незначної кількості стронцію до чавунів та титанових сплавів дозволяє значно покращити їхні механічні властивості. Стронцій оксид ефективно поглинає рентгенівські промені; зі скла на його основі раніше виготовляли кінескопи телевізорів з електропроменевою трубкою. Сполуки стронцію застосовуються у піротехніці; в якості магнітних матеріалів (ферити). Стронцій чистотою 99,99 – 99,999% використовується для відновлення урану. Сполуки стронцію застосовуються в електротехніці.
Барій використовується як газопоглинач у вакуумних трубках; разом зі свинцем – у типографських сплавах. Сульфат барію застосовують в якості білого пігменту, а також наповнювача у виробництві спеціальних сортів паперу; хлорид – у текстильній та керамічній промисловості, у сільському господарстві в якості пестициду; карбонат – для виробництва оптичного скла та емалей; нітрат – у піротехніці. Сполуки барію також знайшли застосування в електроніці та електротехніці.
Таблиця 9.1 – Застосування елементів ІІ А групи та їхніх сполук*
|
Сфера застосування |
Магній |
Кальцій |
Стронцій |
|
1 |
3 |
4 |
5 |
|
Металургія, обробка Металів |
у значній кількості використовують як відновник для одержання інших металів (титану, урану, рідкоземельних елементів); як розкислювач. Основна кількість металічного магнію використовується для отримання сплавів, які крім магнію містять алюміній манган, цинк, цирконій. Це найлегші конструкційні сплави (ρ=2г/см3), які застосовуються в літакобудуванні |
Са застосовується в якості відновника в металургії, розкислювач при виробництві сталі; для легування свинцю, виробництва бабітів; СаО та Са(ОН)2, СаН2, СаF2 широко використовуються в металургійних процесах |
для легування міді та її сплавів; додавання Sr до чавунів та титанових сплавів дозволяє значно покращити їхні механічні властивості; для видалення сірки з чавуну, міді, сталей; в акумуляторних свинцевих сплавах |
|
Хімічна промисловість |
в органічних синтезах (реактив Грин'яра та ін.); магнію сульфат – у виробництві синтетичних миючих засобів |
флюорит СаF2 – сировина для добування плавневої кислоти та фтору; карбід – виробництво ацетилену, відновлення металів |
|
|
Легка промисловість (текстильна, паперова, шкіряна) |
магній сульфат – у целюлозно-паперовій промисловості (як наповнювач, незамінний компонент, що зберігає та покращує фізико-механічні властивості паперу при застосуванні відбілювачів, для отримання вогнестійких виробів з паперу); у текстильній промисловості, як наповнювач матеріалів, обтяжнювач шовку та бавовни, протрава для фарбування тканин; компонент для відбілювання; при дубленні шкіри |
гашене та негашене вапно широко використовуються у виробництві паперу, порошків, що відбілюють та білильного вапна, у дубленні шкіри; гіпохлорит – у якості відбілювача |
сульфід – засіб для видалення шерсті в шкіряній промисловості |
|
Медицина |
MgО та MgSO4·7Н2O має седативну, діуретичну, спазмолітичну, снотворну, проносну дію, знижує артеріальний тиск; карбонат, оксид – для нейтралізації НСl тощо; перекис – дезінфікуючий засіб; органічні похідні – у складі БАД, лікарських препаратів з широким спектром дії (хронічний стрес, захворювання серцево-судинної системи) |
сполуки кальцію широко застосовуються як антигістамінний засіб (хлорид, глюконат), входять до складу препаратів для профілактики остеопорозу; гіпс – як в'яжучий матеріал |
радіоактивний Sr використовують в якості аплікаторів у лікуванні захворювань шкіри та очей; раку; хлорид – у стоматології та косметології |
|
Харчова промисловість |
хлорид – харчова добавка Е511; цитрат – Е345; основний карбонат – Е504 |
гідроксид – харчова добавка E526, оксид – Е529; хлорид – Е509; карбонати – Е170. Вапняне молоко – у виробництві цукру |
гідроксид – для виділення цукру з патоки |
|
Продовження таблиці 9.1 |
|||
|
1 |
2 |
3 |
4 |
|
Енергетика, атомна енергетика, хімічні джерела енергії |
Мg та його сполуки (бромід, перхлорат) – для виробництва дуже потужних резервних електричних батарей (наприклад, магній-перхлоратний, сірчано-магнієвий елемент тощо), сухих елементів (марганцево-магнієвий, бісмутисто-магнієвий елемент тощо) |
Са та його сплави з Аl та Мg – у резервних теплових електричних батареях в якості аноду; хромат – у якості катоду. Такі батареї мають тривалий строк зберігання, експлуатуються за будь-яких умов (космос, високий тиск) |
фторид – компонент фторіонних акумуляторних батарей з дуже високою ємністю; сплав Sr з Sn та Рb – для струмовідводів акумуляторних батарей; сплав Sr–Сd – для анодів гальванічних елементів; радіоактивний 90Sr – у виробництві радіо-ізотопних джерел струму; уранат – в ядерноводневій енергетиці |
|
Сільське господарство |
магній сульфат – компонент добрив; хлорат – дефоліант та інсектицид |
вапняне молоко – для приготування суміші для боротьби з хворобами рослин; оксид, сульфат – у складі добрив; хлорат – дефоліант |
|
|
Будівництво, силікатна промисловість |
магній сульфат – у будівельній промисловості (наприклад, магнезіальний цемент) |
гіпс, гашене та негашене вапно широко використовуються в будівництві (цемент), у виробництві скла; СаО, СаF2 – виробництво вогнестійкої кераміки, крім того, в оптиці та як лазерний матеріал. |
оксид – компонент над- провідникової кераміки; карбонат – виробництво стійкої глазурі, скла стійкого до дії рентгенівських променів |
* – курсивом у таблиці виділені найбільш поширені сфери застосування елемента та його сполук
9.7 Біологічна роль та токсикологія
Магній та кальцій входять до числа біогенних елементів. Кальцій формує скелет людини та зубну тканину. Йони кальцію беруть участь у передачі нервових імпульсів, скороченні м'язів. Тривала відсутність кальцію в раціоні може викликати сонливість, судоми, біль у суглобах, дефекти росту. Більш глибокий дефіцит призводить до постійних м'язових судом та остеопорозу. Надлишкові дози кальцію та вітаміну Д можуть викликати гіперкальцемію, інтенсивну кальцифікацію кісток та тканин, порушення функціонування м'язових та нервових тканин, підвищують згортання крові.
Сполуки магнію містяться в зубній емалі, кістках, м'язах, печінці. Йони магнію входять до складу ферментів. Магній необхідний зеленим рослинам, тому що входить до складу хлорофілу.
Сполуки берилію, стронцію, барію та радію є високотоксичними. Найтоксичнішими є сполуки берилію (мають загальнотоксичну, канцерогенну, сенсибілізуючу, ембріотоксичну дію, розчинні сполуки мають також подразнюючу дію). Стронцій, схожий за властивостями на кальцій, заміщує його у кістках. Радіоактивний ізотоп стронцію, що утворюється під час ядерних вибухів, призводить до ураження кісткового мозку, викликає розвиток раку кісток. Розчинні сполуки барію при гострому отруєнні призводять до ураження міокарду, нервової системи, судин, печінки, при хронічному – кісткової тканини та кісткового мозку, статевих залоз, печінки. Радій небезпечний як α-випромінювач.
Контрольні питання
1. Подібність яких властивостей дозволяє говорити про діагональну схожість літію та магнію?
2. Чому властивості Берилію та Магнію відрізняються від властивостей Кальцію, Барію, Стронцію?
3. Поясніть, чому метали ІІ А підгрупи мають більш високі температури плавлення та кипіння, ніж метали І А підгрупи. Як ще відрізняються їх фізичні властивості?
4. Опишіть хімічні властивості елементів підгрупи І А та ІІ А. Вкажіть схожість та відмінність між елементами цих груп.
5. Охарактеризуйте здатність елементів ІІ А підгрупи до взаємодії з водою.
6. Як змінюються основні властивості оксидів та гідроксидів елементів другої групи зі збільшенням порядкового номера елементу? Напишіть рівняння реакцій, що характеризують амфотерні властивості берилій оксиду та гідроксиду.
7. Напишіть рівняння реакцій між:
а) магнієм та концентрованою сульфатною кислотою;
б) кальцієм та водою;
в) магнієм та розбавленою хлоридною кислотою;
г) берилію гідроксидом та розчином калію гідроксиду.
8. Напишіть рівняння реакцій, за допомогою яких можна здійснити перетворення:
Сa→ Сa(ОН)2→ СaCO3 → СaO→ СaСl2→ Сa;
МgО→ Мg→ Мg(ОН)2→ МgСO3 → МgО → МgСl2.
9. Напишіть чотири неоднотипні рівняння реакцій, в процесі яких відбувається утворення:
а) кальцій гідроксиду;
б) магній сульфату.
Вкажіть їх промислове значення
10. Як хімічним шляхом можна зменшити твердість води?

