Тема 2 р-Елементи VІІ А групи
|
План 2.1 Загальна характеристика елементів VII А групи. 2.2 Знаходження у природі. 2.3 Фізичні властивості. 2.4 Методи добування. 2.5 Хімічні властивості елементів VII А групи. 2.6 Сполуки галогенів. 2.7 Використання. 2.8 Біологічна роль та токсикологія. |
2.1 Загальна характеристика елементів VІІ А групи
До VІІ А групи періодичної системи Д.І. Менделєєва входять Флуор 9F, Хлор 17Cl, Бром 35Br, Іод 53І та Астат 85At (стабільних ізотопів не має). F, Cl, Br, І носять назву „галоґени” (в перекладі з грецької – солероди). Ця назва зумовлена їх властивістю утворювати солі під час безпосередньої взаємодії з металами.
Електронна конфігурація зовнішнього шару – ns2nр5. Зміна хімічних властивостей у ряду F – Cl – Br – І – At зумовлюється послідовним збільшенням розмірів ns-, nр-валентних орбіталей. Із збільшенням порядкового номера атома елемента зростає густина, збільшуються температури кипіння і плавлення, зростає сила галогеноводневих кислот, зменшується реакційна здатність.
Галогени – типові неметали, під дією відновників легко перетворюються в галогенід-іони Г-. Спорідненість атома до електрона зменшується вниз по групі. Галогени енергійно взаємодіють з металами, з s-металами утворюють йонні сполуки. Йонний характер галогенідів дещо послаблюється із збільшенням порядкового номера елементу, що є наслідком зменшення електронегативності. З більш електронегативними елементами галогени проявляють позитивні ступені окиснення.
Властивості Флуору помітно відрізняються від властивостей інших галогенів. У нього відсутні вакантні d-орбіталі, електрони 2s22р5 слабо екрановані від ядра, що призводить до високої електронної густини, енергії йонізації, електронегативності. Тому для Флуора можлива лише ступінь окиснення -1, 0, а для інших галогенів -1 (максимальна стійкість сполук), 0, +1, +3, +5, +7, імовірні також +2,+4,+6). Енергія зв'язку в молекулі F2 аномально мала, що робить її дуже реакційноздатною (фтор безпосередньо реагує з усіма елементами, крім Не, Nе, Аr, з утворенням сполук, в яких елементи знаходяться в максимально можливих ступенях окиснення). Також слід відзначити високі, порівняно з іншими галогенами, ентальпії утворення йонних та ковалентних сполук.
2.2 Знаходження у природі
У земній корі вміст Флуору становить 6·10-2%, Хлору, Брому, Йоду відповідно 2·10–2; 2·10–4; 4·10–5 %. Флуор зустрічається у вигляді флуоридів (біля 30 мінералів, найбільш важливі – СаF2 (флюорит або плавиковий шпат), 3Ca3(PO4)2CaF2 (фторапатит), Na3[AlF6] – кріоліт). Хлор утворює близько 70 власних мінералів, головним чином це хлориди легких металів (кам’яна сіль, галіт NaCl; сильвін KCl, карналіт KCl MgCl2 6H2O тощо). Основна маса галогенів сконцентрована у воді морів і океанів. Бром та йод також містяться в бурових водах, морських водоростях (наприклад, в морській капусті (ламінарії) вміст йоду досягає 0,45%).
2.3 Фізичні властивості
У газоподібному, рідкому та твердому стані галогени – двоатомні молекули Г2. Фтор – світло-жовтий газ із дуже неприємним різким запахом. Хлор – зелено-жовтий газ із різким запахом, бром – червоно-бура важка рідина з різким запахом; йод – чорні, металево блискучі кристали (під час нагрівання перетворюється на фіолетовий газ (сублімація) – рисунок 2.1. Температури плавлення та кипіння монотонно збільшуються від фтору до йоду із збільшенням розміру молекули та підсиленням міжмолекулярної взаємодії.
|
|
||
|
а |
б |
в |
|
а – хлор; б – бром; в – йод |
||
|
Рисунок 2.1 – Зовнішній вигляд хлору, брому, йоду |
||
2.4 Методи добування
Фтор одержують електролізом розплавів флуоридів (переважно КНF2, що дозволяє проводити електроліз при 1000С, тоді як КF плавиться при температурі 8570С.
Промислове виробництво хлору ґрунтується на електролізі водних розчинів NаСl. У лабораторних умовах його отримують взаємодією концентрованої HCl з окисниками:
MnO2 + 4HCl → MnCl2 + Cl2↑ + 2H2O
2KMnO4 + 16HCl → 2MnCl2 + 2KCl + 5Cl2↑+ 8H2O
Особливо чистий хлор одержують за реакцією:
2AuCl3 → 2Au + 3Cl2↑
Бром у промисловості одержують з морської води, попередньо позбувшись NаСl: 2Br – + Cl2 → Br2 + 2Cl–
Бром видувають потоком повітря і поглинають залізними стружками або іншими речовинами, наприклад:
Na2CO3 + Br2 → NaBrO + NaBr + CO2
NaBrO + NaBr + H2SO4 → Br2 + Na2SO4 + H2O
У лабораторних умовах бром отримують за реакцією:
2KBr + Cl2 → 2KCl + Br2
Йод у промисловості також добувають із морської води, води нафтових свердловин, золи морських рослин:
2NaI + Cl2 → 2NaCl + I2
У лабораторії йод отримують за реакцією:
2NaI + MnO2 + 2H2SO4 → I2 + MnSO4 + Na2SO4 + 2H2O
Йод адсорбують активованим вугіллям або екстрагують розчинниками, очищають – сублімацією.
2.5 Хімічні властивості елементів VII А групи
За хімічними властивостями галогени – найактивніші неметали. Завдяки низькій енергії дисоціації молекули фтору, найбільшій електронегативності атому та високої енергії гідратації йона, фтор – найсильніший окисник (окиснює інші елементи до вищих позитивних ступенів окиснення), енергійно реагує з простими речовинами за винятком Hе, Nе і Аr. В ряду від фтору до йоду окиснювальні властивості зменшуються, а відновні – збільшуються. Хімічні властивості галогенів при взаємодії з простими речовинами наведені в таблиці 2.1.
Таблиця 2.1 - Хімічні властивості простих сполук
|
Реагент |
F2 |
Cl2 |
Br2 |
І2 |
|
Hе, Nе і Аr |
Не реагує |
Не реагує |
Не реагує |
Не реагує |
|
Кr, Хе |
ЕFn (n=2,4,6) |
Не реагує |
Не реагує |
Не реагує |
|
Галогени (Г) |
ГFn (n=1,3,5), ІF7 |
СlFn (n=1,3,5), ВrСl, ІСl, І2Сl6 |
ВrFn (n=1,3,5), ВrСl, ІВr |
ІFn (n=1,3,5,7), ІВr, ІСl, І2Сl6 |
|
О2 |
F2О2, ОF2 (елек-тричний розряд) |
Не реагує |
Не реагує |
Не реагує |
|
S |
SF6, S2F10 |
S2Сl2; SСl2; SСl4 |
S2Вr2 |
Не реагує |
|
Р |
РF3; РF5 |
РСl3; РСl5 |
РВr3; РВr5 |
РІ3; РІ5 (?),Р2І4 |
|
Н2 |
З вибухом у темряві |
З вибухом на світлі |
Реагує при Т≥2300С, каталізатор – Рt |
H2+І2 =2HІ, рівновага зміщена вліво |
|
Лужні метали (Ме) |
МеF |
МеCl |
МеBr |
МеІ |
|
Аl |
АlF3 |
АlСl3 |
АlВr3 |
АlІ3 |
|
Сu |
СuF2 |
СuСl2 |
СuВr2 |
СuІ |
|
Au |
АuF3 |
АuСl3 |
АuВr3 |
АuІ |
Взаємодія з водою:
З водою фтор взаємодіє надзвичайно енергійно:
2F2 + 2H2O → 4HF + O2,
Реакція супроводжується утворенням озону і ОF2.
При розчиненні хлору у воді відбувається реакція:
H2O + Сl2 HOСl + HСl – при кімнатній температурі у насиченому розчині Сl2 у воді приблизно 70% хлору знаходиться у вигляді молекул, тоді як рівновага для йоду майже цілком зміщена вліво.
Взаємодія із складними речовинами:
Фтор реагує з лугами з утворенням ОF2:
2NaOH + 2F2 → 2NaF + OF2 + H2O
При дії хлору на холодні розчини лугів утворюються солі хлорнуватистої кислоти:
Сl2 + 2KOH → KOСl + KСl + H2O
калію гіпохлорит
При дії на гарячий розчин лугу (70–800С) утворюються солі хлорнуватої кислоти – хлорати:
3Сl2 + 6KOH → KСlО3 +5KСl + 3H2O
калію хлотрат
Йод і бром також переважно утворюють при взаємодії з лугами триоксогалогенати.
Хлор реагує з розчином соди:
2Na2CO3 + Cl2 + H2O → NaClO + NaCl + 2NaHCO3
“Жавелева вода”
Йод у незначній мірі виявляє властивості, характерні для металів. Так можна одержати йод нітрат, який розкладається за температури нижче 0°С.
I2 + AgNO3 ![]() AgI + INO3 ; 3INO3 → I2 + I(NO3)3
AgI + INO3 ; 3INO3 → I2 + I(NO3)3
2.6 Сполуки галогенів
ГАЛОГЕНОВОДНІ
За стандартних умов галогеноводні – безбарвні гази з різким запахом. З ростом маси та розміру молекул підсилюється міжмолекулярна взаємодія, та, як наслідок, підвищуються температури плавлення та кипіння. Фтороводень має аномально високі температури плавлення ( –83°С) та кипіння (–19,5°С), що пояснюється утворенням водневих зв'язків між молекулами НF.
Завдяки високій полярності галогеноводні добре розчиняються у воді з утворенням кислот, сила яких збільшується в ряду НF–НСl–НВr–НІ (внаслідок збільшення радіуса). Відновлювальна активність галоґенід-іонів у ряду F- →СІ–→ Br–→I– також збільшується. НІ – сильний відновник, застосовується в органічному синтезі. На повітрі водний розчин НІ поступово окислюється киснем повітря:
4HI + O2 → 2I2 + 2H2O
Аналогічно поводиться і НВr. Плавикова (НF) та соляна кислота (НСl) не реагують з концентрованою сульфатною кислотою, а НВr та НІ окислюються нею.
Основну кількість соляної кислоти отримують при хлоруванні, дехлоруванні органічних сполук, піролізі (розклад при нагріванні без доступу повітря) хлорорганічних відходів – побічних продуктів різних процесів. Крім того, галогеноводні отримують:
- прямим синтезом з елементів: Н2 + Г2 2НГ
Ця ланцюгова реакція, яка теж лежить в основі промислового добування HCl, ініціюється світлом, вологою, твердими пористими речовинами.
- витісненням НГ з їхніх солей (лабораторні методи добування):
CaF2 + H2SO4 → CaSO4 ↓ + 2HF;
NaCl + H2SO4(к)→ NaHSO4 + HCl;
NaHSO4 + NaCl → Na2SO4 + HCl.
– кислоти НВr, НІ одержують гідролізом галоґенідів фосфору:
PЕ3 + 3H2O → H3PO3 + 3HЕ (Е – Вr або І).
Особливістю НF та його водних розчинів є руйнування кварцу та скла:
SiO2 + 4HF → SiF4 + 2H2O
SiF4 + 2HF → H2[SiF6]
Тому HF зберігають у поліетиленовому посуді або скляному, але покритому всередині воском або парафіном. Рідкий НF — сильно йонізуючий розчинник. З водою змішується в будь-яких співвідношеннях. У розбавлених водних розчинах існує рівновага:
HF + H2O H3O+ + F– ;
F– + HF HF2– ;
При нейтралізації НF можна одержати калій біфторид (калій гідроґенфторид):
2HF + KOH → KHF2 + H2O
KHF2 + KOH → 2KF + H2O
Флуориди (солі плавикової кислоти) – малорозчинні у воді (виняток – NaF, KF, NH4F, AgF, SnF2), Їх поділяють, аналогічно оксидам, на кислотні (SiF4), основні (NaF) і амфотерні (AlF3). Можуть реагувати між собою:
2NaF + SiF4 → Na2[SiF6]
KF + SbF5 → K[SbF6]
3KF + AlF3 → K3[AlF6]
Хлориди – солі хлоридної кислоти – розчиняються у воді, за винятком АgСl, НgСl2, Hg2Cl2, РbСl2.
Броміди, йодиди – розчиняються у воді, за винятком АgВr, АgI, РbI2, РbВr2.
Сполуки галогенів з Оксигеном
Бінарні оксигенвмісні сполуки Флуору називаються флуоридами (Флуор більш електронегативний ніж Оксиген). Найстійкішим за звичайних умов є оксиґен дифлуорид – ОF2 , який утворюється за реакцією:
2NaOH + 2F2 → 2NaF + OF2 + H2O
ОF2 – світло-жовтий газ, реакційно активний, сильний окиснювач:
2H2 + OF2 → H2O + 2HF.
Інші галогени в сполуках з Оксигеном проявляють позитивні ступені окиснення.
Серед оксидів практичне значення має І2О5 (єдиний термодинамічно стійкий оксид галогенідів) – безбарвна кристалічна речовина. Окиснювач середньої сили, застосовується для кількісного визначення СО:
I2O5 + 5CO → I2 + 5CO2
I2 + 2Na2S2O3 → 2NaI + Na2S4O6
Оксиґеновмісні сполуки хлору одержують непрямим шляхом. Порівняно стабільними є Сl2О, ClO2 , Cl2O7:
Сl2O – темно-жовтий газ iз різким запахом, отруйний, нестійкий, може вибухати. Отримують цей оксид за реакцією: 2HgO + 2Cl2 → HgCl2 + Cl2O.
Cl2O реагує з водою: Cl2O + H2O → 2HOCl або 2НСlО – гіпохлоритна кислота. Ця кислота є нестійкою, існує тільки в розбавленому розчині.
НОСl і її солі гіпохлорити – сильні окисники:
NaOCl + 2KI + H2SO4 → I2 + NaCl + K2SO4 + H2O
ClO2 – газ зеленувато-жовтого кольору, з різким запахом, отруйний, при нагріванні може вибухати, енергійний окисник.
ClO2, єдиний з оксидів галогенів, який отримують у промислових масштабах за реакціями:
КClO3 + H2SO4 → HClO3 + KHSO4
3HClO3 → 2ClO2 + HClO4 + H2O
У воді СlО2 диспропорціонує, як і в розчинах лугів:
2СlО2 + H2O → HClO3 + HClО2
хлоратна кислота хлоритна кислота
2ClO2 + 2KOH → KClO3 + KClO2 + H2O
Сl2О7 – масляниста рідина, вибухає при нагріванні до 120°С, отримують за реакцією: 4HClO4 + Р4О10 → 2Cl2O7 + 4НРО3.
Cl2O7 реагує з водою: Cl2O7 + H2O → 2HClO4
перхлоратна кислота
Оксокислоти та їх солі
Формули та назви оксокислот та їхніх солей наведені в таблиці 2.2
Таблиця 2.2 – Вживані назви оксокислот та їхніх солей (за тривіальною та раціональною номенклатурами)
|
Ступінь окиснення |
Хлор |
Бром |
Іод |
|||
|
формула |
Назва |
формула |
назва |
формула |
Назва |
|
|
+1 |
HClO |
хлорнуватиста або гіпохлоритна (солі гіпохлорити) |
HВrO |
бромнуватиста (гіпоброміти) |
HІO |
йоднуватиста або гіпойодитна (гіпойодати) |
|
+3 |
HClO2 |
хлориста або хлоритна (хлорити) |
– |
– |
– |
– |
|
+5 |
HClO3 |
хлорнувата або хлоратна (хлорати) |
HВrO3 |
бромнувата або броматна (бромати) |
HІO3 |
йоднувата або йодатна (йодати) |
|
+7 |
HClO4 |
хлорна або перхлоратна (перхлорати) |
HВrO4 |
бромна (пербромати) |
HІO4 H5ІO6 |
метайодна ортойодна (перйодати) |
Гіпогалогенітні кислоти НГО відомі лише в розбавлених водних розчинах. Їх отримують взаємодією галогену з суспензією меркурію оксиду:
2I2 + HgO + H2O → HgI2 + 2HOI.
Це слабкі кислоти, в ряду HOCl → HOBr → HOI зменшується сила кислот, основні властивості збільшуються. HOI вже амфотерна сполука.
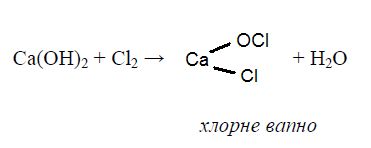
Гіпогалогеніти – нестійкі сполуки з сильними окисними властивостями, отримують при взаємодії Г2 з охолодженим розчином лугу. Таким чином одержують в промисловості хлорне вапно, яке тривалий час широко застосовувалося в якості дезінфікуючого та відбілюючого засобу:
З оксигеновмісних кислот галогенів НГО2 відома лише хлориста кислота HClO2, у вільному стані нестійка кислота середньої сили (Кд=10-2). Технічного значення вона не має. Практичне значення має NaClO2 – сильний окисник, застосовується як відбілюючий засіб для тканин, в невеликій кількості (біля 0,4%) входить до прального порошку. Отримують за реакцією:
Na2O2 + 2ClO2 → O2 + 2NaClO2
Оксокислоти НГО3 є більш стійкими, ніж НГО. HClO3 , HВrO3 існують тільки в розчинах, концентрація яких не перевищує 50 %, а HIO3 виділена як індивідуальна сполука.
У ряду HClO3 → HBrO3 → HIO3 сила кислот знижується, вони є більш слабкими окисниками, ніж НОГ.
HClO3 одержують у процесі реакцій:
6Ba(OH)2 + 6Cl2 → 5BaCl2 + Ba(ClO3)2 + 6H2O
Ba(ClO3)2 + H2SO4 → BaSO4 ↓ + 2HClO3
HBrO3 отримують за реакцією:
Br2 + 5Cl2 + 6H2O → 2HBrO3 +10HCl
HIO3 можна отримати:
3I2 + 10HNO3 → 6HIO3 + 10NO + 2H2O
Солі цих кислот, сильні окисники, одержують за реакцією:
3Г2 + 6КОН → КЕО3 + 5КЕ + 3Н2О
Широке використання в промисловості має KClO3 – бертолетова сіль – застосовується у виготовленні сірників, фєйєрверків, вибухових речовин.
Оксокислоти НГО4
НСlО4 – рідина, димить на повітрі. Її одержують в ході реакції:
KClO4 + H2SO4 → HClO4 + KHSO4
Безводна НСlО4 – дуже сильний окисник, одна із найсильніших кислот, яка застосовується в неорганічному і органічному синтезі. Солі – перхлорати, більшість яких розчиняється у воді, за винятком КСlО4, RbClO4, CsClO4, Mg(ClO4)2 (технічна назва “ангідрон”) – один з найсильніших осушувачів.
Бромна кислота відома лише у водних розчинах.
Перйодатна кислота H5IO6 – слабка кислота, добре розчинна у воді, утворює середні і кислі солі. Кислоту отримують за реакцією:
Ba5(IO6)2 + 5H2SO4 → 5BaSO4 + 2H5IO6.
Солі перйодатної кислоти можна одержати:
KIO3 + Cl2 + 6KOH → K5IO6 + 2KCl + 3H2O
Міжгалогенні сполуки
На відміну від елементів інших груп галогени взаємодіють один з одним з утворенням великої кількості інтергалогенідів із загальною формулою ХYn (n= 1, 3, 5,7) – таблиця 2.3, де Y – більш легкий та електронегативний галоген. Отримують їх безпосередньою взаємодією простих речовин, за різних співвідношень реагентів, температур та тисків.
Всі інтергалогеніди, крім ВrСl, розкладаються під дією води. Мають сильні окисювальні властивості.
Таблиця 2.3 – Міжгалогенні сполуки, стійкі при 250С
|
ХYn |
Сполука |
|
ХY |
СlF, ВrF, ІF, ВrСl, ІСl, ІВr |
|
ХY3 |
СlF3, ВrF3, ІF3, І2Сl6 |
|
ХY5 |
СlF5, ВrF5, ІF5 |
|
ХY7 |
ІF7 |
2.7 Використання
Галогени та їхні сполуки широко застосовуються в промисловості, сільському господарстві, побуті. За масштабами промислового виробництва перше місце серед галогенів займає хлор, друге – фтор. Основні сфери застосування галогенів та їхніх сполук наведені в таблиці 2.4
Крім того, оксигенвмісні сполуки галогенів застосовують у піротехніці. Сполуки флуору використовуються для виробництва глазурі та емалей; HF – для травлення скла. Хлорвмісні сполуки широко застосовують у якості бойових отруйних речовин (фосген, іприт, хлорпікрин тощо). АgВr використовують в фотографії, КВr – в оптиці. Йод та бром застосовують у галогенних лампах. Розпилювання у хмарах аерозолів АgI i PbI2 викликає (штучно) дощ, є засобом боротьби з градом. Деякі йодорганічні сполуки використовуються для виробництва надпотужних газових лазерів.
2.8 Біологічна роль та токсикологія
Фтор та його сполуки надзвичайно отруйні. F2 має подразнюючу дію, в кілька разів сильнішу ніж НF. Потрапляючи на шкіру, НF розчиняє білки, глибоко проникає в тканини, викликає тяжкі виразки. Флуор у складі фторапатита входить до складу зубної емалі, його дефіцит викликає карієс, а надлишок – підвищення ламкості кісток.
Хлор відноситься до групи задушливих речовин, викликає сильне подразнення слизових оболонок, може призвести до набряку легенів. Високі концентрації призводять до рефлекторного гальмування дихального центру. Хлор – найважливіший біогенний елемент. Хлорид-іони входять до складу шлункового соку, беруть участь у різноманітних внутріклітинних процесах – підтримці осмотичного тиску та регуляції водно-сольового обміну.
Пари брому також призводять до подразнення слизових оболонок, запаморочення, а більш високі концентрації викликають спазми дихальних шляхів; ураження нюхового нерва. При потраплянні рідкого брома на шкіру утворюються дуже болючі опіки та виразки, що важко загаюються. Сполуки брому регулюють процеси збудження та гальмування центральної нервової системи.
Вдихання парів йоду викликає ураження нирок і серцево-судинної системи, дихальних шляхів, можливий набряк легенів. При потраплянні на слизову очей з'являється біль в очах, почервоніння, сльозоточивість. Йод входить до складу тиреоїдних гормонів щитовидної залози (тироксин, трийодтиронін), які відіграють дуже важливу роль в обміні речовин.
Таблиця 2.4 – Застосування галогенів та їхніх сполук*
|
Сфера застосування |
Флуор |
Хлор |
Бром |
Йод |
|||
|
1 |
2 |
3 |
4 |
5 |
|||
|
Металургія, обробка металів |
у добуванні торію, цирконію, берилію; флюорит, калію фтороборат - флюс для пайки сталей та кольорових металів; калію фторид, гексафтороалюмінат - у виробництві Аl; НF – для зняття піску з металевого литва |
в кольоровій металургії методом хлорування добувають титан, ніобій, тантал; |
в металургії золота та платини |
для отримання високочистого Ti, Zr, Hf, Nb та ін. (йодидне рафінування металів) |
|||
|
Хімічна промисловість |
для фторування органічних сполук, синтезу фреонів (холодоагентів), одержання фторопластів (зокрема тефлону), фторкаучуків, які мають високу хімічну та термічну стійкість; входять до складу миючих засобів |
60-75% хлору – виробництво хлорвмісних органічних сполук: полімерів, (наприклад, полівінілхлорид); фреонів, барвників, розчинників; миючих засобів; 10-20% – виробництво неорганічних сполук (соляна кислота, хлорне вапно, бертолетова сіль) |
в органічному та неорганічному синтезі |
у складі каталі-заторів, барвників |
|||
|
Легка промисловість (текстильна, паперова, шкіряна) |
|
Для відбілювання тканин, целюлози |
NaBr– додають в дубильні розчини; в якості барвників (броміндиго) |
|
|||
|
Медицина |
Флуориди –перспективні компоненти в препаратах для лікування раку, регулювання спадковості, психотропних сполук, транквілізаторів, антибіотиків; входять до складу компонентів штучної крові |
В якості дезінфікуючих речовин |
Броміди К та Nа мають заспокійливу дію |
В складі дезінфі-куючих, антисеп-тичних засобів; для лікування захворювань щитовидної залози |
|||
|
Харчова промисловість |
|
Cl2 – для знезараження питної води, харчова добавка Е925; NaCl – найдавніша смакова добавка та консервант; КCl – харчова добавка Е508, НCl – харчова добавка Е507 |
сполуки брому – в якості відбілювачів борошна |
Для йодування повареної солі; в харчових добавках |
|||
|
Електроніка |
в напівпровідникових приладах, обчислювальних пристроях; SF6 – ізолятор в електротехнічній промисловості |
органічні хлорвмісні сполуки – в якості ізоляторів (але вони дуже токсичні) |
органічні бромвмісні сполуки – в якості вогнестійких добавок (але вони дуже токсичні) |
виробництво рідко-кристалічних дисплеїв |
|||
|
Енергетика, атомна енергетика, хімічні джерела енергії |
UF6 – для розділення ізотопів урану; F2, OF2 , СlF3 та інші сполуки флуору – окиснювачі ракетного палива |
перхлорати – окиснювачі у вибухових сумішах і ракетному паливі |
окиснювачі ракетного палива (ВrF5); антидетонатор моторного палива (1,2-диброметан); броміди – в нафтодобуванні |
у літієво-йодних акумуляторах для електромобілів |
|||
|
Сільське господарство |
для боротьби зі шкідниками, фтороапатит – для виробництва добрив |
в якості пестицидів, добрив (сильвін, калійна сіль) |
в якості пестицидів |
В якості добрив (біойодис та ін.) |
|||
* – курсивом у таблиці виділені найбільш поширені сфери застосування елемента та його сполук
Контрольні питання
1. Які ступені окиснення проявляють галогени в сполуках? Які особливості валентних станів Флуору? Чому метали проявляють вищі ступені окиснення в сполуках з Флуором?
2. Проаналізуйте зміни властивостей в ряду галогенів.
3. Проілюструйте реакціями промислові та лабораторні способи одержання галогенів.
4. Наведіть порівняльну характеристику окисно-відновних властивостей галогенів на прикладі різних реакцій.
5. Як змінюються фізичні та хімічні властивості в ряду НF–НСl–НВr–НІ?
6. Напишіть рівняння реакцій взаємодії галогенів з водою та лугами.
7. Як змінюються сила та окисно-відновні властивості оксигенвмісних кислот галогенів? Відповідь аргументуйте.
8. Які неорганічні сполуки Флуору, Хлору, Брому та Йоду використовуються в медицині? В яких ще галузях широко використовуються галогени та їхні сполуки?
9. Напишіть рівняння реакцій, за допомогою яких можна здійснити перетворення:
РbВr2 →HBr→ Br2→ КBrO3→ НBrO3→ FeBr3;
Сl2 →КClO3 → КClО4→ НClО4→ClO2→НClO3;
Сl2 →НCl → КCl→ Cl2→ВаCl2→НCl.
10. Яку біологічну роль в організмі людини відіграють галогени?
