Тема 4 р-Елементи V А групи
|
План 4.1 Загальна характеристика елементів V А групи. 4.2 Знаходження у природі. 4.3 Фізичні властивості та алотропія. 4.4 Способи добування простих речовин. 4.5 Хімічні властивості простих сполук. 4.6 Водневі сполуки елементів V А групи. 4.7 Оксигенвмісні сполуки елементів V А групи. 4.8 Застосування 4.9 Біологічна роль та токсикологія. |
4.1 Загальна характеристика елементів V А групи
До елементів V А групи належать Нітроген 7N, Фосфор 15Р, Арсен 33Аs, Стибій 51Sb та Бісмут 83Ві. За аналогією з галогенами та халькогенами для них запропонована загальна назва "пніктогени" (в перекладі з грецької – задушливі, ті, що мають поганий запах, які особливо відноситься до водневих сполук цих елементів).
В основному стані атоми елементів V А групи мають електронну конфігурацію зовнішнього шару ns2nр3, з трьома неспареними р-електронами. В ряду N – Р – Аs – Sb – Ві розміри атомів збільшуються, а енергії йонізації зменшуються, що призводить до підсилення металевих властивостей: у вільному вигляді Нітроген та Фосфор – типові неметали, Арсен та Стибій – металоїди, Бісмут – метал. Зі зростанням радіуса збільшуються і координаційні числа (КЧ) атомів. Для Нітрогену характерні координаційні числа 1–4, для Фосфору зазвичай реалізується КЧ = 4, але в сполуках з галогенами КЧ може досягати 6, Арсен та Стибій проявляють КЧ 4, 6, а бісмут – 7, 8, 9.
Внаслідок невеликого радіуса та високої електронегативності Нітроген відрізняється від інших елементів своєї підгрупи. Відсутність у нього енергетично доступного вакантного d-підрівня призводить до того, що атом Нітрогену може утворювати не більше чотирьох ковалентних зв'язків, в тому числі один зв'язок за донорно-акцепторним механізмом.
У зв'язку із зростанням радіуса атома і зменшенням перекриття атомних р-орбіталей, міцність одинарних σ-зв'язків у ряду N–Р–Аs–Sb–Ві зменшується. Менша міцність зв'язку N–N порівняно зі зв'язком Р –Р зумовлена малим розміром атомів Нітрогену та виникаючим внаслідок цього сильним міжелектронним відштовхуванням. Міцність кратних зв’язків, навпаки, зменшується із зростанням розміру атомних орбіталей, та, як наслідок, послабленням їх перекриття за π-типом. Таким чином, найміцнішими виявляються кратні (потрійні) зв’язки для Нітрогену. Для Фосфору та Арсену енергетично вигіднішим є утворення одинарних зв'язків.
Елементи V А групи виявляють різні ступені окиснення. Для Нітрогену характерний весь спектр – від -3 до +5 (-3, -2, -1,+1, +2, +3, +4, +5). Для Фосфору негативні ступені окиснення є менш характерними, ніж для Нітрогену. В той же час стійкість сполук з вищим ступенем окиснення збільшується, що пов'язано зі зменшенням електронегативності атома Фосфору, зменшенням енергії йонізації та збільшенням міцності зв'язків. Арсен та Стибій у сполуках мають ступені окиснення -3, +3 та +5, а для Бісмуту найстійкішими є сполуки зі ступенем окиснення +3.
Елементи V А групи в ступені окиснення +3 зберігають неподілену електронну пару, яка зумовлює їх стехіометрію та донорні властивості.
Завдяки сумарній дії різних факторів (зростанню атомного радіуса, зменшенню рπ-рπ–перекриття, збільшенню ступеня екранування зовнішніх електронів) стійкість та окисювальна здатність сполук Фосфору на наступних за ним елементів підгрупи змінюється немонотонно (вторинна періодичність) – вищий ступінь окиснення є найбільш стійким для Фосфору та Стибію, в той же час сполуки Арсену та особливо Бісмуту зі ступенем окиснення +5 часто є нестійкими чи взагалі не існують. Сполуки Бісмуту(V) – сильні окисники.
Для кисневих сполук Фосфору та, в меншій мірі, для наступних елементів групи має місце рπ-dπ – перекриття, яке підвищує кратність зв'язку Е–О та збільшує його енергію. Тому сполуки Фосфору практично не виявляють окиснювальних властивостей, на відміну від аналогічних сполук Нітрогену.
4.2 Знаходження у природі
У вигляді простої сполуки – азоту N2 – в природі знаходиться лише Нітроген (його вміст у повітрі складає приблизно 78%). Вміст Нітрогену в земній корі складає 2,5·10-3 мас.%. З природних мінералів промислове значення має чілійська (NaNO3) та калійна (КNO3) селітри.
Фосфор зустрічається у вигляді фосфатів, його вміст у земній корі складає 0,1 мас.%. Найбільш розповсюдженими мінералами є апатити – гідроксоапатит Са5(РО4)3ОН, фторапатит Са5(РО4)2F, а також фосфорит Са3(РО4)2.
Арсен (1,5·10-4 мас.%), Стибій (2·10-5 мас.%), Бісмут (5·10-6 мас.%) зустрічаються переважно у вигляді сульфідів – аурипігменту Аs2S3, антимоніту або стибійного блиску Sb2S3, бісмутового блиску Ві2S3, арсенопіриту FеАsS, тетрадиміту Ві2Те2S, а також оксигенвмісних сполук, наприклад, скородиту FеАsО4·2Н2О, бісмутової охри Ві2О3 тощо.
4.3 Фізичні властивості та алотропія
За звичайних умов азот N2 – газ без кольору, запаху і смаку, малорозчинний у воді (2,3 мл/100г Н2О при 0°C). Міцний внутрішньомолекулярний зв'язок, невеликий розмір та неполярність молекули N2 є причинами слабкої міжмолекулярної взаємодії, тому азот має низькі температури плавлення та кипіння (-2100С та -1960С відповідно).
Всі інші елементи V А групи за кімнатної температури – тверді речовини, мають декілька алотропних модифікацій.
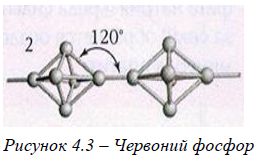
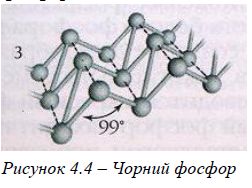
Для Фосфору відомі три алотропні видозміни: білий, червоний та чорний.

|
|
Білий фосфор – м'яка кристалічна речовина, схожа на віск з неприємним часниковим запахом. Білий фосфор – дуже отруйний, хімічно активний, легко самозаймається на повітрі, тому його зберігають під шаром води, в якій він практично не розчиняється. Добре розчиняється у сірковуглеці СS2 (якщо цим розчином зробити напис на стіні або змочити гніт свічки, то через деякий час, завдяки випаровуванню сірковуглецю, невидимий напис на стіні стане видимим, а свічка самозайметься). Білий фосфор має молекулярну гратку, у вузлах якої знаходяться тетраедричні молекули Р4. Білий фосфор – сильна отрута, при нагріванні до 320оС без доступу повітря перетворюється у червоний фосфор. |
|
|
Червоний фосфор, на відміну від білого, не є отрутою, не розчиняється у сірковуглеці, не світиться у темряві. Червоний фосфор складається із угрупувань Р8 та Р9, пов'язаних містками з двох атомів фосфору. Червоний фосфор менш активний. |
|
|
Чорний фосфор – найбільш стійка модифікація, утворюється з білого за нагрівання до 220 оС та за дуже високого тиску (1200 атм.). За зовнішнім виглядом він нагадує графіт та є напівпровідником. |
Арсен, стибій та бісмут, як і фосфор, існують у вигляді декількох модифікацій. Жовтий арсен Аs4 за будовою нагадує білий фосфор. При зберіганні він самовільно перетворюється в більш стійку гексагональну форму, що за будовою нагадує чорний фосфор. Вона є найбільш стійкою також для стибію та бісмуту.
У ряду від фосфору до бісмуту зростають координаційні числа, з'являється металевий блиск, зменшується крихкість та збільшується електропровідність.
4.4 Способи добування простих речовин
У промисловості азот отримують фракціонуванням зрідженого повітря. Для цього повітря під високим тиском переводять в рідкий стан, а потім шляхом випаровування відокремлюють азот від менш легкого компоненту – кисню (для азоту Ткип. = -195,8оС, для кисню Ткип.= -183оС).
У лабораторії азот одержують термічним розкладанням амоній нітриту, літій азиду або нагріванням суміші розчинів натрій нітриту та амоній хлориду:
NH4NO2 → N2↑ + 2H2O;
2LіN3 → 3 N2↑ + 2Lі;
NаNO2 + NH4Сl → N2↑ + 2H2O + NаСl (азот, що утворюється внаслідок цієї реакції може бути забруднений домішками нітратної кислоти та нітроген оксиду, для видалення яких газ пропускають крізь підкислений розчин К2Сr2О7).
Фосфор у промисловості одержують прожарюванням суміші подрібненого фосфориту або апатиту з піском та вугіллям у електричних печах за температури 15000С без доступу повітря:
Сa3(PO4)2 + 3SiO2 + 5C → 3CaSiO3 + 2P + 5CO↑.
Фосфор виділяється у вигляді парів, які конденсуються в приймачі під водою у вигляді білого фосфору.
Крім фосфатів, можна відновлювати, наприклад, метафосфатну кислоту.
Арсен, стибій та бісмут одержують випалом сульфідних руд з подальшим відновленням оксиду коксом:
2 Е2S3 + 9 О2 → 6 SО2 ↑+ 2 Е2O3;
2 Е2О3 + 3 С → 2 Е+ 3 СО↑.
4.5 Хімічні властивості простих сполук
Взаємодія з простими речовинами:
Молекулярний азот має дуже низьку реакційну здатність, що зумовлено наявністю в молекулі N2 потрійного зв'язку, а також неполярністю молекули. За кімнатної температури азот реагує лише з літієм, а при нагріванні з багатьма металами, наприклад, при 300оС:
3Mg + N2 → Mg3N2
магній нітрид
За температури електричної дуги (близько 3000оС) азот взаємодіє з киснем: N2 + O2 → 2NO.
За температури ≈ 450оС, тиску 30 МПа, та за присутності каталізатора (Fe або Al2O3), азот реагує з воднем з утворенням аміаку:
N2 + 3H2 → 2NH3.
Реакційна здатність Р, Аs, Sb, Ві більш висока, ніж азоту. Так, під час згорання на повітрі фосфор утворює фосфатний ангідрид P2O5 (за нестачі кисню – P4O6):
4P + 5O2 → 2P2O5 – фосфор(V) оксид
Аs, Sb, Ві окиснюються до триоксидів Е2О3.
Також інтенсивно перебігає реакція з галогенами:
2Е + 3Cl2 → 2ЕCl3.
В надлишку хлору фосфор та стибій утворюють пентахлориди ЕCl5.
В результаті нагрівання з металами в інертній атмосфері Р, Аs, Sb, Ві утворюють фосфіди, арсеніди, антимоніди та бісмутіди відповідно, (стехіометричні та нестехіометричні) наприклад:
3Ca + 2P → Ca3P2 – кальцій фосфід.
Взаємодія з кислотами та лугами наведена в таблиці 4.1:
Таблиця 4.1 – Взаємодія простих речовин з кислотами та лугами
|
Е |
Кислота-неокисник |
Кислота-окисник |
Луг |
|
N2 |
Не реагує |
Не реагує |
Не реагує |
|
Р |
Не реагує |
P+5HNO3(конц.)→ H3PO4+5NO2↑+H2O |
4Рбілий+3КОН+3H2O→ РH3↑+3КН2РО2 |
|
Аs |
Не реагує |
As+5HNO3(конц.)→ H3АsO4+5NO2↑+Н2О |
2As+6NаОН(розплав)→ 2Nа3АsO3+ЗН2↑ |
|
Sb |
2Sb+12НСl(конц.)→ 2Н3[SbСl6]+3Н2↑ |
2Sb+10HNO3(конц.)→ Sb2O5 Н2О+10NO2↑+4Н2О |
Не реагує |
|
Ві |
Не реагує |
Не реагує з HNO3(конц.), пасивація; Bi+4HNO3(розб.)→Bi(NO3)3+NO↑+2H2O |
Не реагує |
4.6 Водневі сполуки елементів V А групи
Ступінь окиснення -3
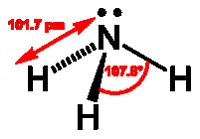
Всі елементи V А групи утворюють з воднем сполуки ЕН3, але їхня стійкість різниться. Стибін SbН3 та особливо бісмутин ВіН3 є дуже нестабільними. За кімнатної температури гідриди елементів V А групи – гази без кольору з характерним різким запахом. Молекули ЕН3 мають форму тригональної піраміди.
У ряду NH3 – РH3 – АsH3 – SbH3 – ВіH3 із зростанням радіуса атома Е збільшується довжина зв'язку Е–Н. Одночасно зменшується перекриття орбіталей, що призводить до зниження міцності зв'язку Е–Н та стійкості молекул ЕН3. Реакція утворення гідриду є екзотермічною тільки для аміаку, але навіть він розкладається вже за температури 4000С. ВіH3 за температури 250С існує тільки впродовж декількох хвилин.
Зв'язок N–Н є дуже полярним, що пояснюється високою електронегативністю нітрогену, а також більшим внеском атомних орбіталей нітрогену в молекулярні орбіталі аміаку, більшим сумарним дипольним моментом. Зменшення донорних властивостей незв'язуючої електронної пари призводить до того, що здатність до утворення йону ЕН4+ для фосфіну значно менша, а для арсину практично не існує.
Температури плавлення та кипіння в ряду NH3 – РH3 – АsH3 – SbH3 змінюються немонотонно. Високі температури фазових переходів NH3 пов'язані з наявністю водневих зв'язків, що відсутні у випадку інших гідридів. Зростання температур плавлення та кипіння при переході від РH3 до SbH3 пов'язане з підсиленням міжмолекулярної взаємодії.

Добування: Взаємодією простих речовин у промисловості отримують лише аміак NH3 за реакцією:
N2 + 3H2 → 2NH3.
Промисловий синтез аміаку впровадив німецький хімік Ф. Габер і в 1918 році отримав за це Нобелівську премію. Реакцію проводять за температури 400-5000С та за підвищеного тиску (від 10 до 300 атм. залежно від апаратури). Для прискорення реакції додають каталізатор – губчасте залізо з добавками калій, кальцій, магній, кремній оксидів.
В лабораторії аміак отримують при нагріванні за реакцією:
2NH4Cl + Ca(OH)2 → CaCl2 + 2NH3 + 2H2O.
Фосфін РH3 (прозорий газ із запахом гнилої риби), як правило, отримують за реакціями:
4P + 3NaOH + 3H2O → PH3↑ + 3NaH2PO2;
Ca3P2 + 5HCl → 3CaCl2 + 2PH3↑.
Арсен гідрид або арсин AsH3 (прозорий, дуже отруйний газ з часниковим запахом) утворюється при відновленні сполук арсену:
As2O3 + 6Zn + 6H2SO4 → 2AsH3 + 6ZnSO4 + 3H2O
Арсин є нестійким і під час нагрівання розкладається на водень і вільний арсен, який утворює на холодних частинах приладу чорний наліт (арсенове дзеркало), що є якісною реакцією на арсен.
Для водневих сполук ЕН3 найбільш характерними є реакції взаємодії з водою, реакції окиснення та заміщення атома гідрогену.
При переході від аміаку до фосфіну розчинність у воді та основні властивості різко зменшуються. Фосфін, арсин, стибін – малорозчинні у воді речовини. У водних розчинах вони практично не проявляють основних властивостей. Фосфін в той же час є кислотою (але кислотні властивості дуже слабкі): активні метали заміщують в ньому один гідроген, з утворенням фосфонідів МеРН2.
Аміак, на відміну від гідридів інших пніктогенів, дуже добре розчиняється у воді (один об'єм води розчиняє 1200 об'ємів NH3), це пояснюється утворенням водневих зв'язків та гідратів NH3·nН2О різного складу. Аміак легко випаровується, тому навіть розбавлені розчини мають характерний запах.
Водний розчин аміаку проявляє властивості слабкої основи:
NH3 + Н2O ↔ NH4+ + OН–
Наявність вільної sp2-гібридної електронної пари зумовлює його донорні властивості – здатність взаємодіяти з кислотами з утворенням солей амонію, а також утворювати комплексні сполуки – аміакати:
NH3 + HCl → NH4Cl
NіСl2 + 6 NH3 → [Nі(NH3)6]Cl2.
Солі амонію характеризуються низькою термічною стійкістю, розкладаються при нагріванні до різних продуктів в залежності від кислотного залишку.
Лужні метали при взаємодії з аміаком утворюють аміди:
NH3 + Nа → NаNH2 + ½ H2
Інші метали взаємодіють з аміаком з утворенням нітридів:
3Мg + 2 NH3 → 3МgN3+ 3 H2
Крім стехіометричних нітридів можливе утворення нестехіометричних сполук, наприклад, ТіN.
Фтор миттєво окиснює аміак до NF3. В присутності інших галогенів відбувається заміщення атомів водню, продукти реакції якого залежать від кислотності, температури, стійкості утворюваних сполук.
Відновні властивості:
Атоми елементів у ЕН3 знаходяться у нижчому ступені окиснення, тому гідриди проявляють відновні властивості.
На повітрі аміак не горить, але згорає в атмосфері кисню:
– без каталізатора: 4NH3 + 3O2 → 2N2 + 6H2O.
– з платиновим каталізатором: 4NH3 + 5O2 → 4NО + 6H2O.
Фосфін утворює з повітрям вибухонебезпечні суміші, а при підпалюванні згорає з утворенням метафосфатної кислоти:
РH3 + 2O2 → НРО3 + H2O.
Арсин та стибін при згоранні утворюють триоксиди:
2 ЕH3 + 3 O2 → Е2О3 +3H2O.
За підвищених температур аміак здатний відновлювати деякі оксиди до металів:
2NH3 + 3CuO → 3Cu + N2↑ + 3H2O.
Фосфін, арсин та стибін є більш сильними відновники, вони відновлюють солі важких металів.
Солі амонію є більш стійкими, ніж солі фосфонію. Вони можуть взаємодіяти з кислотами, лугами та іншими солями:
NH4Cl + HNO3 → NH4NO3 + HCl;
2NH4Cl + Ba(OH)2 → 2NH3 + 2H2O + BaCl2;
(NH4)2SO4 + BaCl2 → BaSO4↓ + 2NH4Cl.
Солі амонію, в яких аніон не є окисником, при нагріванні розкладаються зворотно:
NH4Cl ↔ NH3↑ + HCl↑
(NH4)2SO4 ↔ 2NH3↑ + Н2SO4
Якщо аніон окисник, то солі розкладаються до кінця:
NH4NO3 → N2O↑ + 2H2O.
Фосфіди металів під дією води повністю гідролізують:
Mg3P2 + 6H2O → 3Mg(OH)2 + 2PH3↑.
Крім аміаку, Нітроген утворює інші сполуки з воднем, наприклад, гідразин N2H4 (ступінь окиснення нітрогену -2). Гідразин – рідина з різким запахом, подібно до аміаку здатна до йонізації, більш слабка основа, ніж аміак, дуже сильний відновник. НN3 – азотисто-воднева кислота (формальна ступінь окиснення нітрогену -1/3 – НNN2, один атом нітрогену має ступінь окиснення +5, інший -3) – рідина без кольору, з різким запахом, вибухонебезпечна. Дуже сильний відновник, достатньо сильна кислота.
4.7 Оксигенвмісні сполуки елементів V А групи
Оксигенвмісні сполуки нітрогену
Нітроґен з киснем утворює шість оксидів: N2O, NO, N2O3, NO2, N2O4, N2O5 (крім того, відомі ще два нестійкі оксиди N4O, NO3). Перші два оксиди несолетворні. Інші при взаємодії з водою утворюють відповідні кислоти – нітритну та нітратну.

Всі оксиди азоту можна отримати при взаємодії металів різної активності з азотною кислотою або розкладанням нітратів при температурі. Тільки NО можна отримати прямим синтезом з простих речовин за високих температур (він також утворюється в атмосфері при грозових розрядах).
Ступінь окиснення +1:
Нітроґен(І) оксид, N2O – прозорий газ без запаху, із солодким присмаком, малорозчинний у воді. При вдиханні у значних кількостях збуджує нервову систему, тому має ще назву „звеселяючий газ”.
Одержують N2O за розкладанням при 200oC амоній нітрату:
NH4NO3 → N2O↑ + 2H2O.
З водою, кислотами та лугами N2O не реагує. Має окисні властивості, але при взаємодії з сильними окисниками поводить себе як відновник:
2N2О + 6Сl2 → 4NСl3 + O2.
Ступінь окиснення +2:
Нітроґен(ІІ) оксид, NO – прозорий газ, розчиняється у воді, але не реагує з нею.
У лабораторії його отримують за реакцією:
3Cu + 8HNO3 → 3Cu(NO3)2 + 2NO↑ + 4H2O.
У промисловості NО отримують каталітичним окисненням NH3 на платино-родієвому каталізаторі при 700 oC:
4NH3 + 5O2 → 4 NO + 6H2O.
У реакціях NO, як правило, проявляє відновні властивості – знебарвлює розчин КМnO4, легко окиснюється киснем:
2NO + O2 → 2NO2.
Але може бути і окисником:
2NO + 2H2 → N2↑ + 2H2O.
Ступінь окиснення +3:
Нітроґен(ІІІ) оксид, N2O3 – темно-синя рідина (одночасно існує також у газоподібному та твердому стані). Вже за низьких температур розкладається на NO та NO2:
N2O3 → NO↑ + NO2↑.
З водою N2O3 утворює нітритну кислоту: N2O3 + Н2О → 2НNO2.
HNO2 – слабка, нестійка кислота, проявляє окисно-відновну двоїстість, існує лише в розбавлених розчинах, з підвищенням температури розкладається:
3HNO2 → HNO3 + 2NO↑ + H2O.
Ступінь окиснення +4:
Нітроґен(ІV) оксид, NO2 – газ бурого кольору з характерним запахом, добре розчинний у воді. NO2 дімеризується при охолодженні з утворенням безбарвної рідини N2O4.
Одержати його можна при дії на мідь концентрованої нітратної кислоти або розкладанням при нагріванні нітратів металів, які знаходяться в ряду напруг від магнію до міді:
Cu + 4HNO3 → Cu(NO3)2 + 2NO2↑ + 2H2O;
2Pb(NO3)2 → 2PbO + 4NO2↑ + O2↑.
Взаємодію NO2 з водою можна записати таким чином:
6NO2 + 2H2O → 4HNO3 + 2NO.
NO здатний окиснюватись киснем повітря, тому єдиним продуктом взаємодії NO2 з водою в присутності надлишку повітря є нітратна кислота:
4NO2 + O2 + 2H2O → 4HNO3.
Ця реакція використовується для одержання азотної кислоти у промисловості.
NO2 – сильний відновник, в атмосфері якого згорають сірка, карбон, багато металів. Його можна вважати змішаним ангідридом нітратної та нітритної кислот, тому що при розчиненні у воді він утворює суміш цих кислот:
2NO2 + H2O → HNO2 + HNO3
нітритна нітратна
кислота кислота
Ступінь окиснення +5:
Нітроґен(V) оксид або азотний ангідрид, N2O5 – біла тверда кристалічна речовина, сильний окисник, проявляє кислотні властивості: в результаті розчинення у воді утворює азотну кислоту, з лугами утворює солі азотної кислоти – нітрати.
Одержати N2O5 можна за реакцією:
2HNO3 + P2O5 → 2HPO3 + N2O5;
При нагріванні розкладається за рівнянням:
2N2O5 → 4NO2 + O2.
HNO3 – нітратна або азотна кислота – летка безбарвна рідина з різким запахом, змішується з водою у будь-яких відношеннях, Тпл= -420С, Ткип= 830С.
За температури розкладається з виділенням NO2, який забарвлює її у жовтий колір:
4HNO3 → 4NO2↑ + O2↑ + 2H2O.
Вперше азотну кислоту отримав У.Ф. Глаубер під дією сульфатної кислоти на селітру. Нині цей спосіб застосовують у лабораторії для отримання азотної кислоти: NaNO3 + H2SO4 → NaHSO4 + HNO3.
У промисловості застосовується аміачний спосіб одержання азотної кислоти: 4NH3 + 5O2 ![]() 4NO↑ + 6H2O
4NO↑ + 6H2O
4NO + 2O2 → 4NO2↑
4NO2 + O2 + 2H2O ![]() 4HNO3
4HNO3
Аміачний спосіб дозволяє отримати 50% азотну кислоту. 98% HNO3 одержують перегонкою 50% азотної кислоти в присутності H2SO4. Також нітратну кислоту отримують дуговим способом, перша стадія цього процесу – утворення NO з простих речовин при 30000С.
Азотна кислота – сильний електроліт і сильний окисник, тому деякі метали при дії азотної кислоти пасивуються, інші відновлюють нітроґен азотної кислоти до різних ступенів окиснення (залежно від природи відновника та концентрації кислоти), але ніколи метали не витісняють водень з розчинів азотної кислоти.
Концентрована азотна кислота має найбільш сильні окиснювальні властивості:
- з лужними і лужно-земельними металами Na, Ca, Ba, Мg вона відновлюється до N2O, наприклад:
Mg + 10HNO3(конц.) → 4Мg(NO3)2 + N2O↑ + 5H2O
- з важкими металами Cu, Ag, Hg відновлюється до NO2, наприклад:
Cu + 4HNO3(конц.) → Cu(NO3)2 + 2NO2↑ + 2H2O
- з Fe, Сr, Al, Au, Pt – не взаємодіє.
Розбавлена азотна кислота:
- з лужними, лужно-земельними металами та Fe відновлюється до NH3 (NH4NO3), наприклад:
4Mg +10HNO3(розб.) → 4Mg(NO3)2 + NH4NO3 + 5H2O
– з важкими металами Cu, Ag, Hg відновлюється до NO, наприклад:
3Cu + 8HNO3(розб.) → 3Cu(NO3)2 + 2NO↑ + 4H2O
При взаємодії неметалів (C, S, P, Si) з концентрованою азотною кислотою азот відновлюється до NO2, а з розбавленою – до NO, наприклад:
5HNO3(конц.) + Р → Н3РО4 + 5NO2↑ + H2O;
5HNO3(розб.) + 3Р + 2Н2О → 3Н3PO4 + 5NO↑.
Суміш, яка складається з 1 об’єму концентрованої азотної кислоти і 3 об’ємів концентрованої соляної кислоти, називається „міцна (королівська, княжа) вода”, "царська водка". В цій суміші розчиняються навіть благородні метали, які з азотною кислотою не взаємодіють (це пояснюється утворенням дуже сильного, нестійкого окисника NOCl – нітрозилхлориду).
Au + HNO3 + 4HCl → H[AuCl4] + NO↑ + 2H2O
3Pt + 4HNO3 + 18HCl → 3H2[PtCl4] + 4NO2↑ + 8H2O
Солі азотної кислоти – нітрати, добре розчиняються у воді, при нагріванні розкладаються з виділенням кисню:
- нітрати лужних та лужноземельних металів розкладаються до нітритів:
2NaNO3 → 2NaNO2 + O2↑;
- нітрати металів, які стоять у ряду напруг від Mg до Cu, розкладаються до оксиду металу: 2Pb(NO3) → 2PbO + 4NO2↑ + O2↑;
- нітрати найменш активних металів (срібла, золота, платини) розкладаються при нагріванні до вільного металу:
2AgNO3 → 2Ag + 2NO2↑ + O2↑.
Оксигенвмісні сполуки Фосфору, Арсену, Стибію та Бісмуту
Ступінь окиснення +3
Оксиди Е2O3 отримують при взаємодії простих речовин з киснем. Однак якщо у випадку з Аs, Sb, Ві оксиди утворюються навіть при надлишку кисню, то процес окиснення фосфору необхідно суворо контролювати. Фосфор(ІІІ) оксид P2O3 (завдяки наявності неподіленої електронної пари існує у вигляді дімеру P4O6). P4O6 – біла пухка кристалічна речовина (Ткип. = 174оС, Тпл. = 24оС), утворюється при повільному окисненні фосфору при 50 оС та 90 мм.рт.ст.
В інтервалі температур 20–50оС він окиснюється киснем повітря (у присутності слідів фосфору – самодовільно):
Р4О6 + 2О2 → Р4О10, цей процес супроводжується хемілюменісценцією та є причиною світіння білого фосфору.
З водою утворює триоксофосфатну(V) кислоту:
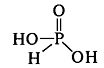
Р4О6 + 6Н2О → 4Н3РО3
Відповідно до структурної формули ця кислота є двохосновною:
Утворюється при взаємодії фосфор трихлориду з водою:
PCl3 + 3H2O → 3HCl + H3PO3.
У вільному стані H3PO3 – безбарвна кристалічна речовина, добре розчинна у воді та спирті. Є достатньо сильним відновником (більш сильний відновник, ніж азотиста кислота), відновлює метали з їхніх солей.
У групі зверху вниз кислотний характер оксидів замінюється на основний:
Арсен(ІІІ) оксиду або арсеністому ангідриду As2O3 відповідає арсен(ІІІ) гідроксид – амфотерний гідроксид, у якого превалюють кислотні властивості:
As2O3 + 3H2O → 2As(ОH)3 ↔ 2 H3AsO3.
H3AsO3 – гідроґен триоксоарсенат(ІІІ) існує лише у водному розчині. Солі цієї кислоти називаються арсеніти, їх можна одержати за реакцією:
As2O3 + 6КОH → 2К3AsО3 + 3H2O
калій арсеніт
Сполуки арсену(ІІІ) мають відновні властивості, в результаті їх окиснення утворюються сполуки арсену(V).
Sb2O3 – стибій(ІІІ) оксид або стибатний ангідрид – амфотерний оксид: Sb2O3 + 3H2SO4 → Sb2(SO4)3 + 3H2O;
Sb2O3 + 3NaOH → 2NaSbO2 + H2O
Ві2О3 – основний оксид, розчиняється в кислотах з утворенням солей бісмуту. Бісмут(ІІІ) гідроксид, Ві(ОН)3 – дуже слабка основа, тому солі бісмуту (ІІІ) гідролізують з утворенням малорозчинних основних солей. Під час гідролізу Bi(NO3)2 часто утворюється оксосіль:
Bi(NO3)2 + H2O → BiОNO3 + 2НNO3.
Ступінь окиснення +5
Фосфор(V) оксид – Р2О5 (фосфорний ангідрид) – білий пухкий порошок, що розпливається на повітрі. Гексагональна модифікація, яка утворюється при згоранні фосфору в надлишку кисню, побудована з молекул Р4О10. Енергійно взаємодіє з водою з утворенням складної суміші, що складається з метафосфатних кислот, які при кип'ятінні гідролізуються до ортофосфатної кислоти. Реакція супроводжується сильним розігріванням:
Р2О5 + Н2О → 2Н3РО4.

Н3РО4 – ортофосфатна кислота – кислота середньої сили. Утворює середні солі фосфати, наприклад, Са3(РО4)2, кислі солі гідрофосфати – СаНРО4, та дигідрофосфати – Са(Н2РО4)2. Дигідрофосфати добре розчиняються у воді, а з гідрофосфатів та середніх фосфатів добре розчинними є лише солі лужних металів та амонію.
Значну кількість Н3РО4, яка йде на виготовлення добрив, у промисловості добувають при переробці апатитів. Більш чисту кислоту, яка використовується для отримання харчових фосфатів, одержують розчиненням Р2О5 у гарячій воді. У лабораторії ортофосфатну кислоту можна отримати за реакцією:
Са3(РО4)2 + 3H2SO4 → 3CaSO4 + 2H3PO4
Фосфатна кислота, як і інші кислоти, реагує з гідроксидами, кислотами, основними оксидами та солями, наприклад:
2H3PO4 + 3BaO → Ba3(PO4)2 + 3H2O;
2H3PO4 + 3Ca(OH)2 → Ca3(PO4)2 + 6H2O;
2H3PO4 + 3MgCO3 → Mg3(PO4)2 +3CO2 + 3H2O.
Фосфати – використовують як мінеральні добрива. Найважливішими є:
– простий суперфосфат СаSО4Са(Н2РО4)2, який отримують за реакцією:
Cа3(РО4)2 + 2H2SO4 → 2CаSО4 + Cа(H2РО4)2
– подвійний суперфосфат Са(Н2РО4)2:
Са3(РО4)2 + 4H3РO4 → 3Са(H2РО4)2;
– преципітат СаНРО4 (завдяки поганій розчинності у воді преципітат вносять переважно в кислі ґрунти):
Са(ОН)2 + H3РO4 → СаНРО4 + H2О.
– амофоси – NH4Н2РО4, (NH4)2(НРО4)2 – одержують шляхом взаємодії фосфатної кислоти з аміаком.
– нітрофоска – потрійне добриво, що містить азот, фосфор та калій. Його отримують сплавленням гідрофосфату амонію, нітрату амонію та хлориду або сульфату калію.
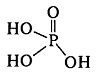
За підвищення концентрації Р4О10 в системі Р4О10 – H2O або під час нагрівання ортофосфатної кислоти утворюються поліфосфатні кислоти лінійної або циклічної будови. Найпростіший представник Н4Р2О7 – пірофосфатна кислота, яка є сильнішою за ортофосфатну. Її отримують дегідратацією ортофосфатної кислоти при 210–2300С:
2Н3РО4 → Н4Р2О7 + Н2О.
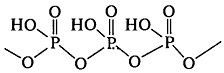
В результаті нагрівання пірофосфатної кислоти відбувається подальша конденсація з утворенням поліметафосфатної кислоти (НРО3)n, лінійного полімеру:
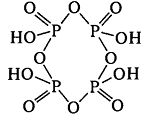
Крім того відомі циклічні метафосфатні кислоти (НРО3)n, наприклад, тетраметафосфатна кислота:
Фосфор утворює найбільшу кількість типів оксикислот та їхніх солей серед усіх елементів Періодичної системи. Крім розглянутих вище кислот, відомими є такі:
|
а |
б |
Н3РО2 (а), фосфорноватиста (гіпофосфориста) кислота (ступінь окиснення фосфору +1);
Н4Р2О6 (б), фосфорнувата (гіпофосфорна)кислота (ступінь окиснення фосфору +4).
У ряду Н3РО4 → Н3РО3 → Н3РО2 сила кислот зростає, збільшується здатність до розкладання та відновні властивості. Наприклад, Н3РО2 легко розкладається при 500С, Н3РО4 – при нагріванні до 2000С, а поліметафосфатна кислота плавиться без розкладання:
3Н3РО2 → 2Н3РО3 + РН3,
4Н3РО3(тв) → 3Н3РО4 + РН3,
As2O5 – вищий оксид арсену, арсен(V) оксид, або арсеновий ангідрид – біла, тверда речовина, утворюється під час прожарювання арсенової кислоти. H3AsO4 – арсенова кислота, добре розчинна у воді, менш сильна, ніж фосфатна. Її можна отримати при дії на арсен сильних окисників, наприклад:
2As + 5HOCl + 3H2O → 2H2AsO4 + 5HCl.
Арсенова кислота утворює три типи солей: К3AsO4 – арсенати, К2HAsO4 – гідроарсенати, КH2AsO4 – дигідроарсенати. У кислому середовищі арсенова кислота та її солі проявляють окисні властивості.
Стибій(V) оксид або стибійний ангідрид Sb2O5 має кислотні властивості. Н3SbO4 – тетраоксостибатна(VІ) кислота, її солі мають назву антимоніти, які отримують при окисненні Стибію сильними окисниками.
Для бісмуту ступінь окисння +5 не є характерним. Сполуки зі ступенем окиснення елемента +5 є сильними окисниками. Вищий оксид бісмуту та бісмутова кислота НВіО3 у чистому вигляді не виділені. Солі бісмутати можна отримати окисненням бісмуту оксиду чи гідроксиду в лужному середовищі.
4.8 Використання
Сполуки елементів V А групи – найважливіші промислові продукти. У великих масштабах виробляються мінеральні добрива (що містіть нітроген та фосфор), аміак, нітратна та фосфатна кислоти. Крім наведених в таблиці 4.2 сфер застосування, сполуки елементів V А групи використовуються:
– рідкий азот – як холодоагент і для кріотерапії. Газоподібний азот, завдяки своїй інертності – для транспортування сировини у хімічній промисловості, у нафтохімії, для продувки резервуарів та трубопроводів; в електроніці для продувки областей, де не допускається наявність повітря. Азотна кислота застосовується для одержання вибухових речовин. Аміак використовується в холодильних установках.
– червоний фосфор застосовується у виробництві сірників; вибухових речовин; а також у якості газопоглинача у виробництві ламп. Білий – для виробництва напівпровідникових матеріалів. Фосфати входять до складу миючих засобів (щорічне виробництво триметафосфату (NаРО3)6 перевищує мільйон тон), їх застосовують для усунення жорсткості води, так званий “фосфатний метод”. Також вони застосовуються в якості уповільнювачів горіння.
– арсен особливої чистоти використовується для виробництва напівпровідникових матеріалів. Наприклад, галію арсенід – напівпровідник в лазерах, сонячних батареях, люмінісцентнх світлодіодах. Також він використовується в типографських сплавах (разом зі стибієм); сульфіди – у живопису в якості фарб; в піротехніці.
– стибій все більше застосовується як напівпровідник у виробництві діодів, інфрачервоних детекторів тощо. Sb2О3, – найбільш важлива сполука стибію, використовується у виробництві оптичного скла, фарб, емалей, вогнестійких матеріалів, виготовлення сирників. Sb2S3 застосовується у виробництві сірників та гуми.
– бісмут також використовується як напівпровідник, наприклад, в термоелектричних приладах, в якості детекторів ядерного випромінювання; в приладах для вимірювання напруженості електромагнітного поля, його сплави – в автоматичних вогнегасниках; у якості запобіжників у паросилових установках; у якості припою; для отримання складних відливок у гіпсових формах; интерметалід MnВі має унікальні магнітні властивості, його використовують для отримання сильних пластичних магнітів.
4.9 Біологічна роль та токсикологія
Нітроген – необхідний елемент для існування живих організмів (входить до складу амінокислот та нуклеїнових кислот). Вміст його в білкових молекулах досягає 17 мас.%. Перетворення атмосферного азоту в розчинні сполуки (аміак та його похідні) відбувається за допомогою мікроорганізмів (азот фіксуючі бактерії бобових рослин).
Таблиця 4.2 – Застосування елементів V групи та їхніх сполук*
|
Сфера засто-сування |
Нітроген |
Фосфор |
Арсен |
Стибій |
Бісмут |
|
1 |
2 |
3 |
4 |
5 |
|
|
Металургія, обробка металів |
N2 –для захисту металів під час відпалу; рідкий азот – кріогенне різання; НNО3 – травлення; амоній хлорид – у лудінні та пайці металів (зникає оксидна плівка з металу) |
червоний Р – для виробництва фос-фористих бронз (з високою в'язкі-стю); фосфатна кислота – для травлення; фос-фати – в якості пасиваторів по-верхні металів; гіпофосфіти – відновники при нікелюванні по-верхонь |
для легування сплавів Рb; АsCl3 – при травленні металів |
компонент багатьох важливих сплавів, наприклад, корозійностійких свинцевих, бабітів – для підшипників; при гарячому цинкуванні заліза |
компонент легкоплавких сплавів; для виробництва так званих "автоматних сталей", в сплавах на основі алюмінію (що полегшує їхню обробку на верстатах) |
|
Хімічна промисловість |
N2 – виробництво аміаку; для створення інертної атмо-сфери при синтезі; NН3 – виробництво НNО3, яка в свою чергу разом з нітратами– вироб-ництво орга-нічних фарбників, добрив, вибухових речовин, волокон, пластмас тощо |
сполуки Р широко застосовуються в органічному та неорганічному синтезі |
|
Sb2S5 – для вулканізації каучуку |
в якості каталізаторів; NaBiO3 – як сильний окисник |
|
Легка промисловість (текстильна, паперова, шкіряна тощо) |
NН3 – у дублінні шкіри, забарвленні тканин; оксиди– виробництво штучного шовку; нітрати, нітрити – в текстильній, шкіряній промисловості |
сполуки Р – для вогнезахисного просочення тканин |
арсену (ІІІ) оксид – консерву-вання хутра та шкіри |
оксиди, галогеніди – в текстильній проми-словості, як протрава |
у косметичній проми-словості (глянце-утворювач лаків, помад, тощо) |
|
Енергетика, атомна енергетика, хімічні джерела енергії |
N2 – виробництво коксу; гідразин – в якості палива; NО2 – окисник ракетного палива |
червоний Р – у виробництві різних видів палива |
сполуки – в сонячних батареях |
у виготовленні пластин свинцевих акумуляторів |
бісмут у вільному вигляді – в ядерних реакторах як теплоносій; електрод в бісмуто-магнієвих та інших елементах |
|
Будівництво та силікатна промисловість |
нітрити – проти- морозні добавки до бетону |
метафосфати з солями чи оксидами перехідних металів утворюють забарвлене скло |
оксиди – в оптичному скловарінні; для надання забарвлення склу |
Sb2О5, сульфіди – виробництво скла, кераміки |
Ві2О3 – виробництво скла та кераміки (головним чином у якості флюсу) |
|
Продовження таблиці 4.2 |
|||||
|
1 |
2 |
3 |
4 |
5 |
6 |
|
Медицина |
10% розчин аміаку – нашатирний спирт – при запамороченнях; а також зовнішньо при невралгії, міозитах, укусах комах тощо; N входить до багатьох лікарських засобів, NО – регулює передачу нервових імпульсів, м'язову релаксацію, секрецію інсуліну кров'яний тиск (на його утворенні ґрунтується дія нітрогліцерину); N2О – засіб для наркозу |
сполуки фосфору широко вико-ристовуються в медицині (АТФ, кальцію тригліце-рофосфат тощо) – впливають на тканинні процеси обміну, вико-ристовуються для лікування захворювань м'язів, нервової системи, малокров'я); фосфати – в стоматології; радіоактивні ізотопи фосфору– для діагностики захворювань; променевої терапії пухлин |
в малих дозах сполуки арсену – для боротьби з мало-крів'ям; оксид – раніше застосо-вувався в стоматології |
неорганічні сполуки – загально-зміцнюючі та тонізуючі засоби; органічні сполуки –проти-мікробні, проти-протозойні засоби (для лікування сифілісу, лейшманіозу) |
Ві2О3 – виготовле-ння препаратів для лікування захворювань шлунково-кишкового тракту; антисептич-них засобів; останнім часом – лікування онкологічних захворювань; оксохлорид – ренгено-контрасний засіб; в якості наповнювача кровоносних судин; орг. сполуки – проти- виразкові засоби |
|
Харчова промисловість |
N2 – харчова добавка Е941; газове середовище для упаковки та зберігання; рідкий N2 – при розливі масел та негазованих напоїв; оксиди – харчова добавка Е918; нітрати та нітрити – харчові добавки Е250,Е251,Е252 (консерванти, зберігають натуральний колір ковбасних виробів тощо) |
в якості харчових добавок: Н3РО4 – Е338; ді– та піро-фосфати Е450, ортофосфати –Е339, Е340, Е341; трифосфати Е451; поліфосфати Е452 – диспергатори, емульгатори, стабілізатори, антиоксиданти |
|
|
|
|
Сільське господарство |
нітрати калію, натрію, амонію, кальцію (селітри) – найважливіші мінеральні добрива; . N2 – для створення інертного середовища при зберіганні овочів тощо |
фосфорні добрива – найважливіші мінеральні добри-ва; насамперед використовуються: простий супер-фосфат, подвійний суперфосфат; преципітат; амо-фоси; нітрофоска; фосфорорганічні сполуки – в якості інсектицидів |
в якості інсектицидів |
SbН3 – в якості інсектициду |
|
* – курсивом у таблиці виділені найбільш поширені сфери застосування
У звичайних умовах N2 – індиферентний газ, але практично всі леткі сполуки нітрогену – отруйні. Аміак подразнює слизові оболонки дихальних шляхів, очі, а у великих концентрація збуджує центральну нервову систему. Подібну дію має гідразин N2Н4, який крім того має ще гепатоксичну дію. Кислотоутворюючі оксиди та нітрогенвмісні кислоти мають подразнюючу дію, діють на центральну нервову систему. NО2 викликає набряк легенів. Нітрити та нітрати переводять гемоглобін в метгемоглобін, сприяють розширенню судин та зниженню кров'яного тиску.
Фосфор входить до складу нуклеїнових кислот, фосфоліпідів, фосфопротеїдів, ферментів, коферментів. Розчинні фосфати формують біологічну буферну систему, що відповідає за сталість рН внутрішньоклітинної рідини. Важкорозчинні кальцієві солі (гідроксоапатит, карбонатоапатит) – складають мінеральну основу кісткової тканини. Нерозчинні фосфати (а також оксалати та урати) є основою каменів у нирках, вони утворюються в організмі в результаті порушення водно-сольового обміну та кислотно-основної рівноваги.
Серед сполук фосфору дуже токсичним є РН3, який має подразнюючу дію, викликає різкі зміни стану нервової системи, обміну речовин, крові. Оксиди фосфору мають загальнотокичну дію, вищий оксид Р2О5 – місцеву подразнюючу дію (сильний водовіднімаючий засіб). Фосфати є малотоксичними.
Неорганічні сполуки арсену в першу чергу діють на нервову систему та стінки судин (що викликає збільшення проникненості та параліч капілярів); блокують дію ферментів, внаслідок чого спостерігаються некробіотичні ураження нирок, печінки, серця, трофічні шкіряні захворювання, злоякісні пухлини. Сполуки Аs накопичуються в щитовидній залозі, викликають ендемічний зоб. Токсичність сполук арсену залежить від розчинності. Малорозчині сполуки та безпосередньо арсен є малотоксичними.
Біологічна роль стибію та бісмуту не з'ясована. Загальне отруєння сполуками стибію проявляється в подразненні дихальних шляхів, шлункового тракту, а також шкіри. Хронічне отруєння нагадує дію сполук арсену, але вони є менш отруйними. Більш токсичними є сполуки стибію (ІІІ).
Контрольні питання
- Розгляньте особливості будови атому Нітрогену та його валентних станів порівняно з Фосфором.
- Як змінюється радіус атома та енергія йонізації в ряду нітроген – бісмут? Як це впливає на їхні фізичні та хімічні властивості?
- Складіть рівняння реакцій отримання фосфору, азоту, аміаку. Вкажіть умови їх проведення.
- Як змінюються властивості сполук у ряду аміак – бісмутін? Відповідь аргументуйте.
- Які реакції характерні для аміаку? Відповідь проілюструйте відповідними рівняннями реакцій.
- Зобразіть структури оксидів нітрогену та напишіть рівняння їх взаємодії з розчинами лугів та водою.
- Як реагує з металами нітратна кислота?
- Складіть графічні формули оксидів та кислот фосфору. Визначте валентність, координаційне число та ступінь окиснення фосфору в цих молекулах, а також основність кислот. Як у промисловості добувають фосфатну кислоту та фосфатні добрива?
- Як змінюються кислото-основні властивості гідроксидів елементів V групи?
- Напишіть рівняння реакцій, за допомогою яких можна здійснити перетворення:
NH3 → N2 → NO → КNO3 → O2;
Р → Са3Р2→ РН3 → Р2O5 → Са3(РО4)2 → Са(Н2РО4)2.