Тема 5 р-Елементи ІV А групи
|
План 5.1 Загальна характеристика елементів ІV А групи. 5.2 Знаходження у природі. 5.3 Фізичні властивості та алотропія. 5.4 Способи добування. 5.5 Хімічні властивості простих сполук. 5.6 Водневі сполуки елементів ІV А групи. 5.7 Оксигенвмісні сполуки елементів ІV А групи. 5.8 Застосування. 5.9 Біологічна роль та токсикологія. |
5.1 Загальна характеристика елементів ІV А групи
До елементів ІV А групи Періодичної системи Менделєєва відносяться Карбон 6С, Силіцій 14Sі, Германій 32Gе, Станум 50Sn та Плюмбум 82Рb. В основному стані атоми мають електронну конфігурацію зовнішнього шару ns2nр2.
У ряду С – Sі – Ge – Sn – Рb атомні радіуси збільшуються. Нерівномірність їх зміни при переході від Sі до Ge та від Sn до Рb зумовлена впливом внутрішніх 3d та 4f електронних оболонок, електрони яких слабо екранують заряд ядер атомів. Це призводить до стиснення електронних оболонок Ge та Рb внаслідок підвищеного ефективного заряду ядра. В цілому, енергії йонізації при переході від С до Рb зменшуються, що зумовлює підсилення металевих властивостей. У ІV А групі різниця між властивостями першого та останнього елемента є максимальною.
У сполуках елементи ІV А групи проявляють ступені окиснення -4, 0, +2, +4. Для Карбону відомі сполуки зі ступенем окиснення -2, наприклад, карбен СН2 та його аналоги.
Стійкість сполук із вищим ступенем окиснення максимальна для кремнію та поступово знижується в ряду Ge – Sn – Рb. Навпаки, стійкість сполук зі ступенем окиснення +2 збільшується. У групі зверху вниз міцність ковалентних зв'язків з іншими елементами зменшується, це призводить до того, що двовалентність стає більш характерною. Неорганічні сполуки Рb(ІV) є сильними окисниками, тоді як сполуки кремнію (ІV) практично не проявляють окиснювальних властивостей. Навпаки, сполуки Sі(ІІ), Ge(ІІ), Sn(ІІ) є сильними відновниками, тоді як для Рb(ІІ) відновні властивості не характерні.
В атомі карбону число валентних електронів дорівнює числу валентних орбіталей і зв'язок С–С виявляється міцним. Подвоєні та потроєні значення енергії одинарних С–С σ-зв'язків суттєво перевищують енергії подвійних та потрійних зв'язків. Тому Карбон здатний до катенації, тобто до утворення гомоатомних ланцюгових, лінійних, розгалужених та циклічних молекул. Утворення ланцюгів характерне і для інших елементів цієї підгрупи, однак із ростом атомного радіуса рπ-рπ–перекриття послаблюються, а міцність одинарних зв'язків Е–Е та довжина ланцюгів Еn зменшуються. Наприклад, для Sі n=14, для Ge n=9, для Sn n=2. В тому ж напрямку змінюється міцність кратних зв'язків Е=Е, Е≡Е. Так, для кремнію та наступних за ним елементів відсутні модифікації зі структурою графіту з π–зв'язком, а також сполуки, подібні ацетилену НС≡СН та етилену Н2С=СН2.
Для карбону найбільш характерним є стан з чотирма еквівалентними sр3-гібридними орбіталями. В такому стані його координаційне число дорівнює чотирьом. Підвищення координаційного числа інших елементів пояснюється збільшенням атомного радіуса, а також участю в утворенні хімічних зв'язків d-орбіталей. Карбон не утворює комплексних йонів, а для інших елементів характерне існування, наприклад: SіF62-, SnСl62-, GеСl62-, РbСl62-. Стійкість цих комплексів зростає зі збільшенням електропозитивності центрального атома.
5.2 Знаходження у природі
Карбон (від лат. carbo – вугілля) зустрічається у природі у вільному стані, у вигляді оксидів (вуглекислий газ СО2, чадний газ СО), карбонатів (вапняк, мармур – СаСО3, магнезит МgСО3, доломіт СаСО3·МgСО3, сидерит FеСО3 тощо), викопного палива (торф, нафта, газ). І хоча вміст Карбону в земній корі складає 0,048 мас.% (17-те місце серед усіх елементів), його частка в живих організмах значно вища, ніж у неживій природі. Наприклад, в організмі людини масою 70 кг міститься 16 кг карбону (що відповідає 22,9 мас.%), а в деревині його вміст досягає 40%. Кількість сполук карбону настільки велика (перевищує 10 млн., тоді як кількість сполук усіх інших елементів складає приблизно 120 тис.), що для їх описання знадобилося виділити у хімії самостійний напрямок – органічну хімію.
У вільному стані в природі вуглець зустрічається у вигляді алотропних модифікацій – алмазу, графіту, карбіну та фуллеренів. Графіт зустрічається в силікатних породах (кварц, лищак). Великі родовища алмазів знаходяться в Африці, Індії, Якутії. Природні фуллерени знайдені в Австралії, Новій Зеландії, США, Росії, а карбін – у метеоритах.
Після кисню силіцій займає друге місце за поширенням на Землі (25,7 мас.%). Силіцій – основа неживої матерії. У природі зустрічається у виглядів оксиду кремнію (IV) – SiO2, силікатів, алюмосилікатів (наприклад, сподумен LіАl(SіО3)2, азбест, який складається з фрагментів [Sі4О11]6-, тальк Мg3[Sі2О5]2(ОН)2, польові шпати КАl[Sі3О8], цеоліти NаCа0,5[Аl2Sі5О14]·10Н)2О тощо). Пісок, кварц, дорогоцінне каміння – гірський кришталь (прозорі кристали кварцу у вигляді шестигранних призм), аметист (гірський кришталь, забарвлений домішками у ліловий колір), димчастий топаз (буруватий гірський кришталь) – все це природні сполуки силіцію.
Германій та станум близькі за розповсюдженістю у земній корі (2,1·10-4 та 1,5·10-4 мас.% відповідно). Мінерали Gе в природі практично відсутні, головним чином він супроводжує сульфідні руди, силікати. Досить багато Германію (до 1%) міститься в деяких сортах кам'яного та бурого вугілля. Станум головним чином зустрічається у природі у вигляді кисневої сполуки SnO2 – олов’яного каменю або каситериту. Великі родовища каситериту знаходяться в Якутії.
Плюмбум (1,3·10-3 мас.%) переважно зустрічається в природі у вигляді мінералу PbS – свинцевого блиску, галеніту. Має радіогенне походження (три з чотирьох його стабільних ізотопів утворилися як кінцеві продукти радіоактивного розпаду природних урану та торію).
5.3 Фізичні властивості та алотропія
Як вже зазначалося раніше, Карбон утворює декілька алотропних модифікацій: графіт, алмаз, карбін, фуллерени. З них найбільш термодинамічно стійким є графіт. Він має шарувату структуру (рисунок 5.1). Кожен шар побудований з шестичленних кілець, в яких три електрони кожного атома карбону утворюють три sp2-гібридні σ-зв'язки в площині шару. Четвертий електрон знаходиться на орбіталі, перпендикулярній шару, та утворює систему делокалізованих π-зв’язків. Це пояснює характерний блиск, високу температуру плавлення та високу електропровідність графіту. Гексагональні шари графіту зв'язані між собою слабкими ван-дер-ваальсовими силами, до того ж, міцність зв'язку в шарі набагато вища, ніж між шарами, тому графіт легко розшаровується, що дозволяє використовувати його як тверде мастило, матеріал для грифелів олівців. Шарувата структура графіту пояснює анізотропію його властивостей – наприклад, вздовж шару електропровідність у 500 разів вища, ніж поперек.
Алмаз утворює безкінечну тривимірну структуру (рисунок 5.1), в якій кожен атом карбону знаходиться в стані sp3-гібридизації та зв'язаний рівноцінними ковалентними σ-зв'язками з чотирма сусідніми атомами, що утворюють тетраедр. Елементарні тетраедри сполучаються в нескінчений ізотропний кубічний кристал. Внаслідок симетричного розподілу електронної густини відштовхування між валентними електронними парами мінімальне, а каркасна атомна структура відрізняється дуже високою енергетичною стійкістю.
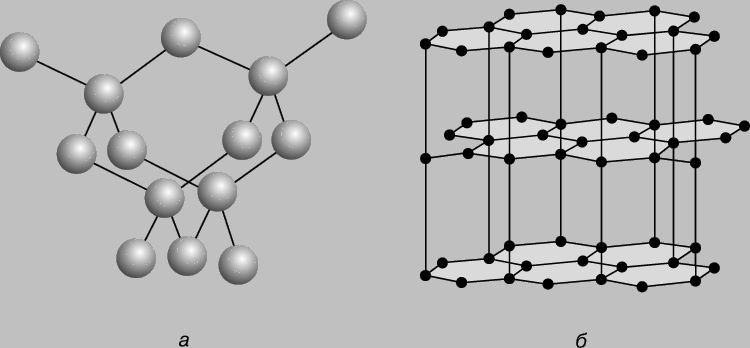
Рисунок 5.1 – Структура алмазу (а) та графіту (б)
Внаслідок різної кристалічної будови, графіт та алмаз дуже відрізняються за властивостями. Густина алмазу значно перевищує густину графіту. За твердістю графіт відноситься до м'яких речовин, тоді як алмаз є еталоном максимальної твердості (10 балів за шкалою Мооса). Алмаз не проводить електричний струм.
За високого тиску (вище 4ГПа) та температури (вище 15000С) графіт перетворюється в алмаз. Цей процес прискорюється за наявності розплавлених металів (Сr, Fе, Nі) та неметалів (червоний фосфор). Алмази, отримані таким чином, часто мають чорний колір завдяки включенням гетероатомів.
|
|
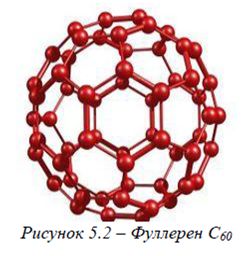
Нові модифікації карбону – фуллерени (рисунок 5.2) знайдені в продуктах конденсації парів графіту. За їх відкриття Х. Крото, Р. Смоллі та Р. Керл в 1996 р. отримали Нобелівську премію з хімії. Молекула фуллерена С60 має сферичну форму. Вона побудована із з'єднаних між собою п’яти- та шестичленних циклів, які містять карбон як у стані sp3-гібридизації, так і в стані sp2-гібридизації. Крім того, виділені фуллерени з більшою чи меншою кількістю атомів карбону в молекулі. |
Існує і четверта модифікація карбону – карбін, яка отримана у шестидесяті роки 20-го сторіччя при дегідруванні ацетилену. Атоми карбону з'єднуються у ланцюги завдяки sp-гібридним зв'язкам. Відомий α-карбін (-СС-СС-) та β-карбін або полікумулен (=С=С=С=С=). Карбін має напівпровідникові властивості За високої температури та тиску він перетворюється в алмаз.
В аморфних формах карбону (вугіллі, сажі, скловуглеці) присутні атоми Карбону в різних гібридних станах. Скловуглець – унікальний тугоплавкий матеріал з високою механічною міцністю, електропровідністю, стійкістю до агресивних середовищ.
Кремній – тверда кристалічна речовина з характерним блиском, напівпровідник. Існує у кристалічному і аморфному стані. Кристалічний кремній має вигляд темно-сірих кристалів, твердих, але крихких. Після полірування вони набувають синювато-сірого блиску. Аморфний кремній – бурий порошок, має алмазоподібну структуру.
Германій – утворює крихкі сріблясто-білі кристали зі структурою алмазу. Теж є напівпровідником.
Олово має дві модифікації. За кімнатної температурі стійке біле олово (β-олово, має тетрагональну структуру), яке при зниженні температури нижче 13,2 оС перетворюється у сіре олово (α-олово, з кубічною алмазною структурою). При цьому, через значну зміну густини металу (об'єм збільшується на 26%), сіре олово розсипається в порошок. Таке явище отримало назву “олов’яна чума”. Дуже швидке перетворення білого олова на сіре відбувається за температури близько -30 оС.
Свинець – голубувато-сірий ковкий низькоплавкий метал, дуже м’який, ріжеться ножем. Існує тільки в одній металічній модифікації зі щільним кубічним пакуванням.
5.4 Способи добування
Штучні алмази вперше отримані в Швеції у 1953 році, а у 1961 році розпочалось промислове видобування алмазів в Україні. В інституті надтвердих матеріалів Академії наук України налагоджений процес одержання штучних алмазів із графіту при температурі 3000 оС та тиску 100000 атм. Лише 20% отриманих або видобутих алмазів ідуть на виготовлення прикрас (діамантів, огранений алмаз), 80% –використовують у технічних цілях.
Графіт добувають із природних родовищ. Штучній графіт отримують при нагріванні кращих сортів кам’яного вугілля в електропечах при температурі 3000 оС без доступу повітря.
Вугілля розрізняється в залежності від способу добування. Найважливіші технічні сорти вугілля – кокс, деревинне вугілля, кісткове вугілля та сажа. Кокс добувають під час сухої перегонки кам’яного вугілля і використовують як компонент шихти у чорній металургії та як відновник у процесі виплавляння кольорових металів. Деревинне вугілля отримують при нагріванні деревини без доступу повітря. При обробці деревинного вугілля, наприклад, перегрітим паром отримують активоване вугілля. Перегрітий пар видаляє смолисті речовини, які заповнюють пори у звичайному деревинному вугіллі. Кісткове вугілля отримують шляхом обвуглювання знежирених кісток. Сажу в промисловості отримують шляхом термічного розкладу метану:
СН4 → С + 2Н2, а також спалювання при недостатньому доступі повітря смоли та інших багатих карбоном речовин.
Отримати кремній можна прожаривши білий пісок з магнієм або коксом у електричній печі:
SiO2 + 2Mg → Si + 2MgO.
Кристали високої чистоти отримують відновленням парів кремній тетрахлориду цинком або воднем:
SіСl4 + 2Zn →Sі + 2ZnCl2.
Германій одержують із золи деяких сортів вугілля.
Для виділення олова і свинцю здійснюють попереднє збагачення руди методом флотації.
Олово одержують відновленням його диоксиду:
SnO2 + 2С → Sn + 2СО.
Для одержання свинцю руду спочатку випалюють:
2PbS + ЗО2 → 2РbО + 2SO2,
потім відновлюють PbO карбон (П) оксидом (або вугіллям):
РbО + CO → Pb + СО2.
Отриманий метал очищають електролітичним рафінуванням.
5.5 Хімічні властивості простих сполук
Вуглець має низьку реакційну здатність. Так, із галогенів він реагує лише із фтором, не реагує з фосфором та азотом. Найбільш інертною формою вуглецю є алмаз. В атмосфері кисню (чи фтору) він згорає лише за температури 7300С з утворенням СО2 (СF4). Алмаз є інертним до дії кислот та лугів. На відміну від алмазу, графіт взаємодіє з киснем та фтором за більш низьких температур. Аморфний вуглець (вугілля) при нагріванні виступає як активний відновник, наприклад:
ZnО + С → Zn + СО↑.
При нагріванні вуглець реагує з металами та воднем, проявляючи окиснювальні властивості: Ва + 2С → ВаС2 – барій карбід;
4Аl + 3C → Al4C3 – алюміній карбід;
2Н2 + С → СН4 – метан.
При пропусканні водяної пари над розпеченим вугіллям утворюється водяний газ (суміш Н2 та СО): Н2О+ С → СО + Н2↑.
Хімічні властивості фуллеренів пов'язані з наявністю локалізованих одинарних та подвійних зв'язків, тому для них характерні реакції відновлення та приєднання. Наприклад, лужні метали відновлюють фуллерени до так званих фуллеридів. Фуллерени взаємодіють з галогенами з утворенням продуктів приєднання, наприклад, С60F20 тощо.
Реакційна здатність простих речовин у ряду Sі – Ge – Sn – Рb збільшується внаслідок зменшення енергії зв'язку між атомами. При нагріванні вони взаємодіють з більшістю неметалів. Германій та олово утворюють сполуки з вищим ступенем окиснення ЕО2, ЕГ4 (Г - галоген) і т.п., тоді як свинець звичайно окиснюється до +2.
Кремній малоактивна сполука. При кімнатній температурі сполучається лише з фтором. При нагріванні реагує з киснем, галоґенами, сіркою, металами:
Si + O2 → SiO2 силіцій діокисид;
Si + 2F2 → SiF4 фторид силіція;
Si + С → SiС силіцій карбід;
2Si + 2СаО → Са2Si + SiO2 кальцій силіцид
Германій та олово за кімнатної температури є стійкими до дії кисню (реагують при нагріванні). Свинець окиснюється киснем:
Sn + О2 → SnО2, тоді як
8Pb + 5O2 → 2РbО + 2Рb3О4
жовтий яскраво-червоний
З воднем олово і свинець не взаємодіють безпосередньо, тому гідриди можна одержати непрямим шляхом. При нагріванні олово та свинець окиснюються сильними окисниками до двох- та чотирьохвалентних сполук:
При нагріванні олова з сіркою одержують сусальне золото SnS2, яке використовують для виготовлення “бронзової фарби”.
Відношення до кислот.
Графіт розчиняється в концентрованих розчинах кислот-окисників:
3С + 4НNO3(конц) → 3СО2↑+ 4NО↑+ 2Н2О
У кисневмісних кислотах-окиснювачах кремній пасивується і розчиняється лише в суміші плавикової та азотної кислот:
3Si + 4HNO3 + 18H2F → 3H2SiO3 + 4NO + 8H2O
Германій розчиняється в концентрованих сірчаній та азотній кислотах:
Ge + 2H2SO4(конц.)→ GeO2 + 2SO2 + 2H2O.
Концентрована нітратна кислота взаємодіє з оловом як неметалом:
Sn + 4HNO3 →H2SnO3 + 4NO2 + 2Н2О,
β – олов’яна кислота
тоді як плюмбум проявляє властивості металу:
Рb + 4HNO3 → Pb(NO3)2 + 2NO2 + 2Н2О
З розведеною нітратною кислотою:
4Sn + 10 HNO3 → 4Sn(NO3)2 + NH4NO3+ 3H2О.
У відповідності до значень стандартних електродних потенціалів олово та свинець розміщені до водню, а германій – після водню. Тому з кислотами-неокисниками реагує лише олово та свинець:
Sn + 2НСl → SnCl2 + Н2.
Рb при звичайних умовах не реагує з Н2SО4 і НСl, оскільки на його поверхні утворюються малорозчинні PbSO4 і РbСl2, а розчиняється в оцтовій кислоті за наявності кисню, в хлорній та розбавленій азотній кислотах.
Відношення до лугів.
З лугами кремній енергійно взаємодіє, з виділенням водню:
Si + 2NaOH + H2O → Na2SiO3 + 2H2
Германій реагує з лугам лише в присутності окисників:
Ge + 2NaOH + 2H2O2 → Na2GeO3 + 3H2O
Олово реагує з концентрованими лугами:
Sn + 2NaOH → Na2SnO2 + H2↑
та з водними розчинами лугів:
Sn + 2NaOH + 2Н2О → Na2[Sn(OH)4] + Н2↑
Свинець у лугах розчиняється повільно, інтенсивніше відбувається розчинення у розбавлених розчинах лугів за підвищеної температури:
Pb + 2КOH + 2Н2О → К2[Pb(OH)4] + Н2↑.
Під час розчинення олова і свинцю в лугах за наявності окисників утворюються сполуки: Na2[Sn(OH)6] та К2[Pb(OH)6].
Узагальнені властивості простих сполук елементів ІV А групи наведені в таблиці 5.1.
Таблиця 5.1 – Хімічні властивості простих сполук елементів ІV А групи
|
Реагент |
Реакція |
Примітка |
|
Кисень (повітря), нагрівання |
Е + О2 → ЕО2 Pb → РbО → Рb3О4 |
Е = С, Sі, Gе, Sn |
|
Вода |
|
|
|
рід. (200С) |
Pb + Н2О → Рb(ОН)2 |
Тільки Рb |
|
пар (нагрівання) |
Е + Н2О → ЕО2 + Н2 С + Н2О → СО + Н2 |
Е = Sі, Sn |
|
Сірка (нагрівання) |
Е + 2S → ЕS2 Pb + S → РbS |
Е = С, Sі, Gе, Sn |
|
Хлор (нагрівання) |
Е + 2Сl2 → ЕСl4 Pb + Сl2 → РbСl2 |
Е = С, Sі, Gе, Sn |
|
Метали (нагрівання) |
Карбіди, силіциди, сплави Sn, Рb |
|
|
Кислоти: |
|
|
|
НСl (гар., конц.) |
Е + 2Н+ → Е2+ + Н2 |
Sn та повільно Рb |
|
H2SO4 (гар., конц.) |
Е + Н2SО4 → Еn+ + SО2 С + Н2SО4 → СО2↑+ 2SО2↑+ 2Н2О |
Е = Sn4+, Рb2+ тільки С |
|
HNO3 (конц.) |
3Е+4НNO3→3ЕО2↑+4NО↑+2Н2О Рb+4HNO3→Pb(NO3)2+2NO2+2Н2О |
С; Gе та Sn – гідратовані оксиди, Sі не реагує; тільки Рb |
|
Луги (розчини) |
Sі + 2ОН- + Н2О → SіО32- + 2Н2 |
С; Gе, не реагують; Sn, Рb (повільно) – Е(ОН)42- |
|
Основи (розплави) |
утворюються SіО42-, GеО42-, Sn(ОН)62- Рb(ОН)42- |
С не реагує |
5.6 Водневі сполуки елементів ІV групи
Як відзначалося раніше, карбон утворює з воднем величезну кількість органічних сполук, властивості яких розглядаються в курсі органічної хімії.
Для порівняння розглянемо водневі сполуки Sі, Ge, Sn та Рb із ступенем окиснення -4, які називаються силанами, германами, стананами та плюмбанами відповідно. За складом, будовою та фізичними властивостями силани та германи ЕnН2n+2 нагадують вуглеводні.
Крім того, для цих елементів відомі гідриди ненасиченого ряду – поліселени (SіН2)n, полігермени (GеН2)n, n=2…10, а для кремнію – циклічні силени SіС5Н10 та SіС6Н12.
Енергії зв'язку Е–Е у ряду Sі – Ge – Sn – Рb знижуються, тому зменшується кількість водневих сполук (n=14 для Sі, n=1 для Рb), знижується їхня стійкість. РbН4 отриманий лише в залишкових кількостях та практично є не охарактеризованим.
Реакційна здатність силану, герману, станану значно вища, ніж метану СН4. Вони активно реагують із хлором у темряві, мають сильні відновні властивості, при нагріванні взаємодіють з водою, при чому гідроліз значно прискорюється при наявності лугів:
SіН4 + 2NаОН + Н2О → Nа2SіО3 + 4Н2.
Силан самозаймається на повітрі: SiH4 + 2O2 → SiO2 + 2H2O.
При заміщенні водню на метал у відповідних гідридах утворюються карбіди, силіциди, германіди, станіди та плюмбіди.
За типом хімічного зв'язку розрізняють ковалентні, йонні та металічні карбіди. При гідролізі йонних карбідів утворюється метан:
Al4C3 + 12Н2О → 4Al(ОН)3 + 3СН4↑
метан
Деякі карбіди (лужних, лужноземельних металів та лантаноїдів) містять йон С22- і формально є похідними ацетилену (їх називають ацетиленідами). Вони малостійкі і при гідролізі утворюють ацетилен:
СаС2 + 2Н2О → Са(ОН)2 + С2Н2↑
ацетилен
Металічні карбіди d-елементів хімічно інертні, мають металеві властивості (характерний блиск, високу електро- та теплопровідність), високу твердість, жароміцність. Металічні карбіди (наприклад, цементит Fе3С) надають твердість та зносостійкість багатьом сплавам.
Кремній більш електропозитивний, ніж карбон, тому силіциди за властивостями більше нагадують бориди (діагональна аналогія). Силіциди лужних та лужноземельних металів характеризуються переважно іонним зв'язком та хімічно більш активні, легко руйнуються водою з утворенням водню. У силіцидах неметалів частіше реалізується ковалентний зв'язок. Серед них особливе місце займає кремній карбід SіС – карборунд, який має структуру алмазу. Карборунд характеризується високою твердістю, температурою плавлення (28000С), хімічною стійкістю.
Подібно кремнію, германій, олово та свинець утворює з деякими металами металіди: германіди МGе, МGе4 (М – лужні метали), станіди NаnSn9, n = 2, 3, 4, плюмбіди Nа2Рb5, NаРb3.
5.7 Оксигенвмісні сполуки елементів ІV А групи
Кисневі сполуки карбону
У кисневих сполуках елементи ІV А групи виявляють ступені окиснення +2, +4. Карбон, крім стійких оксидів СО та СО2, утворює нестійкі С3О2, С5О2. Отриманий також епоксид фуллерену С60О.
Ступінь окиснення +2
СО – оксид вуглецю (ІІ) або чадний газ утворюється при неповному згоранні вуглецю. Це отруйний газ без кольору та запаху.
У промисловості чадний газ отримують за реакціями:
C+ O2 → CO2 , потім CO2 відновлюють: СО2 + С→ 2СО; це повітряний генераторний газ, містить крім СО азот.
C+ H2O → CO + H2; водяний генераторний газ – CO + H2 складають 85% суміші.
СН4 + Н2О → СО + 3Н2;
СН4 + СО2 → 2СО +2Н2.
У лабораторії СО отримують дією концентрованої сірчаної кислоти (водовіднімаючий засіб) на мурашину або щавлеву кислоту при нагріванні:
НСООН → Н2О + СО;
Н2С2О4 → Н2О + СО2 + СО.
Завдяки наявності високоенергетичної електронної пари, яка локалізована на атомі С, з перехідними металами (чи з їхніми безводними галогенідами) СО утворює карбоніли, наприклад:
Nі + 4CO → Nі(CO)4;
Карбону монооксид відноситься до несолетворних оксидів, він малорозчинний у воді, не взаємодіє з розчинами лугів. Однак при підвищених температурах (100 – 3000С) та тиску (до 5 атм.) з розплавленими лугами утворює солі мурашиної кислоти – форміати:
СО + NаОН → НCOОNа.
СО має сильні відновні властивості:
2СО +О2 → 2СО2;
FeO + CO → Fe + CO2;
CO + Cl2 → COCl2 – фосген;
CO + S → COS – карбонілсульфід;
СО + 2Н2 → СН3ОН – метанол.
Ступінь окиснення +4
СО2 – вуглекислий газ або оксид карбону (IV) – безбарвний газ, без запаху, важчий за повітря. При незначному тиску при кімнатній температурі він зріджується. Внаслідок випаровування зрідженого вуглекислого газу, частина його твердне, перетворюючись на так званий „сухий лід”. Завдяки випаровуванню „сухого льоду” можна підтримувати низьку температуру в побутових умовах.
У промисловості його отримують термічним розкладанням вапняку:
СаСО3 → СаО + СО2
В лабораторії СО2 можна отримати в апараті Кіппа за реакцією:
СаСО3 + HCl → CaCl2 + CO2 + H2O
Молекула О=С=О є лінійною, симетричною, неполярною, тому СО2 є малорозчинним у воді.
СО2 хімчно інертний, що обумовлено високою енергією зв'язку О=С=О. Із сильними відновниками проявляє окисні властивості. Вуглецем, при 10000С, відновлюється до СО:
СО2 + С → 2СО;
СО2 + 2Са → 2СаО + С.
Вуглекислий газ – типовий кислотний оксид:
СО2 + ВаО → ВаСО3;
СО2 + Мg(ОН)2 → МgСО3 + Н2О.
Важливу сполуку азоту СО(NH2)2 – карбамід або сечовину, можна отримати при взаємодії вуглекислого газу з аміаком при значному тиску:
СО2 + 2NH3 → СО(NH3)2 + Н2О
Цей метод одержання карбаміду запропонований російським хіміком А.І. Базаровим у 1870 році.
При розчиненні у воді вуглекислого газу утворюється дуже слабка, малостійка вугільна кислота Н2СО3. Лише 0,3% СО2 у розчині знаходиться в формі вугільної кислоти, основна частина – в формі сольватованих молекул СО2.
Ця кислота утворює два типи солей: кислі солі – гідрокарбонати, наприклад:
NaOH + CO2 → NaHCO3,
натрій гідрокарбонат
та середні солі – карбонати, наприклад:
NaHCO3 + NaОH → Na2CO3 + Н2О;
натрій карбонат
ВаCl2 + Na2CO3 → BaCO3 + 2NaCl.
барій карбонат
Карбонати (за винятком солей лужних металів) розкладаються при нагріванні: СаСО3 → СаО + СО2.
Гідрокарбонати лужноземельних та лужних металів при нагріванні перетворюються в карбонати: Са(НСО3)2 → СаСО3 + СО2 + Н2О
Характерною реакцією на карбонат-іон є утворення вуглекислого газу внаслідок дії кислоти:
СаСО3 + 2HCl → СаCl2 + СО2 + Н2О.
Пропускання вуглекислого газу, який утворився, через розчин вапняної води призводить до помутніння, що і є доказом утворення СО2:
Са(ОН)2 + СО2 → СаСО3 + Н2О.
Розчини карбонатів лужних металів, внаслідок гідролізу, мають сильнолужне середовище:
Na2CO3 + Н2О → NaНCO3 + NaOН.
Карбонат натрію або кальцинована сода має широке застосування у багатьох галузях. Одержують її у промисловості аміачно-хлоридним методом:
NH3 + CO2 + H2O → NH4HCO3;
NH4HCO3 + NaCl → NH4Cl + NaHCO3;
2NaHCO3 ![]() Na2CO3 + CO2↑ + H2O.
Na2CO3 + CO2↑ + H2O.
К2СО3 – карбонат калію або поташ (застосовується як мінеральне добриво) одержують пропусканням вуглекислого газу через розчин гідроксиду калію.
У природі спостерігається постійне переміщення карбонатів. Ґрунтові води, що містять СО2, проходячи через пласти вапняку, розчиняють його. Внаслідок таких процесів у печерах утворюються сталактити та сталагміти.
Кисневі сполуки кремнію
Ступінь окиснення +2 мало характерна для кремнію. Відомий монооксид кремнію SіО, пари якого утворюються при нагріванні кремнезему з кремнієм при 13000С та потім конденсуються в чорно-коричневий порошок, який на повітрі окислюється до SiO2. Твердий SiO хімічно стійкій, має сильні відновні властивості, практично не розчиняється у кислотах, крім НF, однак легко розчиняється у лугах:
SiO + 2NaOH → Na2SiO3 + Н2
Ступінь окиснення +4
Найбільш поширеною сполукою кремнію є SiO2 – кремнезем. За звичайної температури та тиску існує три кристалічні модифікації: кварц, тридиміт, кристобаліт, кожна з яких стійка в певному інтервалі температур. Для кожної модифікації відомі низькотемпературні α- та високотемпературні β-форми, які складаються з тетраедрів SіО4.
За високотемпературного (більше 10000С) відновлення SiO2 простими речовинами (металами, воднем, вуглецем) утворюється кремній:
2Mg + SiO2 → Si + 2MgO,
а за надлишку відновника – силіциди:
4Mg + SiO2 → Mg2Si + 2MgO
магній силіцид
При дії кислот силіциди легко розкладаються з утворенням газу силану, який нагадує метан:
Mg2Si + 4HCl → SiH4 + 2MgCl2.
силан
Сполуки кремнію з галоґенами називаються галоґенангідридами кремнієвої кислоти, їх отримують за реакцією:
SiO2 + 2С + 2Cl2 → SiCl4 + 2CO.
Під дією води галоґенангідриди кремнію гідролізують:
SiCl4 + 3H2O → H2SiO3 + 4HCl.
SiO2 вступає в реакцію з лугами, карбонатами калію та натрію, розчиняється лише у фтороводневій (плавиковій) кислоті:
SiO2 + 2NaOH + Н2О→ Na2SiO3 + CO2
SiO2 + Na2CO3 → Na2SiO3 + H2O
SiO2 + 4HF → SiF4 + 2H2O
Кислотний оксид SiO2 – ангідрид кремнієвих кислот. У водних розчинах доведена присутність ортокремнієвої Н4SiO4, пірокремнієвої Н6Si2O7, метакремнієвої Н2SiO3 та дикремнієвої Н2SiO5 кислот.
Солі кремнієвих кислот називаються силікатами. Розчиняються у воді лише силікати калію та натрію. Їх отримують сплавлянням SiO2 з лугами або карбонатами натрію та калію, наприклад:
SiO2 + 2KOH → K2SiO3 + H2O;
SiO2 + Nа2CO3 → Nа2SiO3 + CO2.
Фактично у розчині присутня суміш силікатів.
Концентровані розчини Nа2SiO3 називаються "рідким склом" та використовуються як канцелярський клей.
Сполуки германію, олова та плюмбуму
Ступінь окиснення +2
Всі елементи в ступені окиснення +2 мають неподілену електронну пару, яка зумовлює їхні донорні властивості. Сполуки зі ступенем окиснення +2 мають відновні властивості. Відновлювальна активність різко зменшується в групі зверху вниз від олова до свинцю. В цьому ж напрямку відбувається зростання термічної стійкості та основних властивостей.
Для Германію (як і силіціуму) ступінь окиснення +2 є малохарактерним. Монооксид германію одержують в результаті диспропорціонування простих речовин з діоксидами за високих температур:
GеО2 +Gе → 2GеO
Також GеО можна отримати зневодненням Gе(ОН)2 або відновленням диоксиду фосфорнуватистою кислотою. Як і SіО, GеО схильний до диспропорціонування на Gе та GеО2. Він є сильним відновником, на повітрі повільно окиснюється до GеО2.
Монооксиди олова та плюмбуму можна одержати різними шляхами, наприклад:
2Pb(NO3)2 → 2PbO + 4NO2 + O2
Гідроксиди Е(ОН)2 oдержують непрямим шляхом. Вони, як і ЕО, мають амфотерні властивості:
SnO + 2NaOH ![]() Na2SnO2 + Н2О
Na2SnO2 + Н2О
SnO + 2NaOH + H2O → Na2[Sn(OH)4]
Серед солей найважливішими є галогеніди та сульфіди. Наприклад, SnСl2 широко використовується у хімічній практиці як відновник. Моносульфіди SnS і PbS одержують в результаті реакцій:
SnCl2 + H2S → SnS + 2HC1
Pb(CH3COO)2 + H2S → PbS + 2CH3COOH
При окисненні:
PbS + 4H2O2 → PbSO4 + 4H2O
Цю реакцію використовують під час реставрації старих картин, що містять свинцеві білила – Рb(ОН)2 · 2РbСО3.
Відновні властивості послаблюються в ряду Gе(ІІ) – Sn(ІІ) – Рb(ІІ). Розчини солей олова (ІІ) зберігають над металічним оловом, щоб запобігти окиснення, тоді як сполуки Рb(ІІ) стійкі на повітрі і проявляють відновні властивості лише в присутності сильних окисників.
Ступінь окиснення +4
Германію, стануму, та плюмбуму диоксиди є амфотерними сполуками, при чому для РbО2 переважають основні властивості. В результаті послаблення зв'язку Е–О помітно зменшується стійкість вищих оксидів та гідроксидів, зростають їхні окисні властивості.
GеО2 – біла кристалічна речовина, за будовою та властивостями нагадує SіО2. Має амфотерні властивості, але кислотні властивості переважають. Більш виражені в порівнянні з кремнієм металічні властивості германію проявляються в утворенні солей, наприклад, Gе(SО4)2, що не має аналогії в хімії кремнію.
SnО2 – біла тугоплавка речовина, амфотерна сполука, але вже переважають основні властивості. Не розчиняється у воді та розбавлених кислотах, легко взаємодіє з розплавами лугів з утворенням станатів:
SnО2 + 2КОН ![]() К2SnО3 + Н2О
К2SnО3 + Н2О
При обробці водою він перетворюється в розчинний гексагідроксостанат:
SnО2 + 2КОН + 2Н2О → К2[Sn(ОН)6].
РbО2 – кристалічна речовина темно-бордового кольору. РbО2 – єдиний з диоксидів елементів ІV А групи, внаслідок низької термічної стійкості, не може бути отриманий безпосереднім окисненням плюмбуму киснем.
РbО2 – сильний окисник:
РbО2 + 4НСl (конц.)→ РbСl2 + Сl2 + 2Н2О
З розбавленими кислотами РbО2 не реагує
Реагує з розплавами лугів (як і SnО2):
РbО2 + 2КОН ![]() К2РbО3 + Н2О
К2РbО3 + Н2О
РbО2 + 2КОН + 2Н2О → К2[Рb(ОН)6]
Оксидам ЕО2 (E – Sn, Pb) відповідають гідроксиди, формули яких записують у вигляді: ЕО2 · хН2О.
Для олова та плюмбуму, крім моно- та диоксидів, характерні оксиди зі змішаним ступенем окиснення, наприклад, Рb3О4 – сурик, який можна розглядати як сіль ортоплюмбатної кислоти Рb2РbО4. Діючи на сурик нітратною кислотою одержуємо:
Рb3О4 + 4HNO3 → PbO2+ 2Pb(NO3)2 + 2Н2О.
5.8 Застосування
Основні сфери застосування елементів ІV А групи наведені в таблиці 5.2. Крім зазначених галузей, графіт використовується для виготовлення грифелів олівців, в якості мастила при дуже високих чи низьких температурах. Алмаз, завдяки великій твердості, є незамінним абразивним матеріалом. Використовується як напівпровідник. Оброблені алмази – діаманти, використовують як коштовні камені у ювелірних прикрасах. Діаманти незмінно залишаються найкоштовнішими каменями.
Кремній високої чистоти застосовують як напівпровідника, у фотоелементах, транзисторах. Сполуки кремнію використовують у якості вогнетривких, ізоляційних матеріалів. Кварц використовують у п'єзоелементах, які перетворюють електричний сигнал у механічний та навпаки. На практиці силікати натрію та калію називають розчинним або рідким склом (канцелярський клей). Рідке скло застосовується для виготовлення кислотостійкого цементу і бетону, для просякнення деревини, щоб запобігти займанню від вогню, а також для хімічного укріплення слабких ґрунтів. Цеоліти (природні та синтетичні алюмосилікати) використовують для створення йонообмінних смол (катіонітів).
Таблиця 5.2 – Застосування елементів ІV А групи та їхніх сполук*
|
Сфера засто-сування |
Карбон |
Кремній |
Германій |
Олово |
Плюмбум |
|
|
1 |
2 |
3 |
4 |
5 |
6 |
|
|
Металургія, обробка металів |
С – невід'ємна складова сталі (до 2,14%) та чавуну (більш 2,14%); алмази – для свердління; різання, шліфування особливо твердих матеріалів; С, СО – для відновлення металів з оксидів |
Sі – у якості відновника; легуючого компоненту; сировина для металургійних виробництв (бронзи, силумін); розкислювач (при виплавці чавуну) |
у якості каталізатора |
у сплавах (бронза, латунь бабіт тощо); легуючий компонент при одержанні сплавів титану; цирконію; станіювання сталі |
перхлорат – при флотаційному збагаченні руд; |
|
|
Хімічна промисло-вість |
С – виробництво сірковуглецю; СО – одна з вихідних речовин орга-нічного синтезу; СО2 – виробниц-тво соди тощо |
технічний Sі – сировина для отримання кремній органічних сполук, силанів; SiO2 – для отримання SO2, Р |
у виробництві побутових пластмас |
для теплової стабілізації; у синтезі полімерів |
покриття для хімічної апаратури (стійкі до дії кислот) |
|
|
Легка промисло-вість (текстильна, паперова, шкіряна тощо) |
СS2 – виробництво віскози, вулканізація каучуку |
виробництво штучних силікатних волокон; силікони (Sі-вмісні полімери) – для виготовлення водонепроникних тканин |
|
сполуки Sn2+ –як протрава при фарбуванні тканин (наприклад, Na2[Sn(OH)6]) |
у якості пігментів при фарбуванні тканин, наприклад, Рb3О4 – яскраво-червоний; РbСrО4 – хромовий жовтий тощо |
|
|
Енергетика, атомна енергетика, хімічні джерела енергії |
в якості палива; графіт – уповільнювач нейронів у ядерних реакторах; скловуглець – у атомній енергетиці |
для виробництва сонячних батарей |
|
у хімічних джерелах струму в якості анодного матеріалу, наприклад, марганцево-олов'яний акумулятор |
у свинцевих акумуляторах(катод PbO2, анод – Рb); плюмбуму бісмутат, сульфід, йодид – у літієвих батареях тощо |
|
|
Харчова промисловість |
СО2 – виробництво цукру, пива, газованих напоїв |
SіО2 – харчова добавка Е551 (запобігає злежуванню); силікати – Е500, Е552, Е553, Е557, Е560; тальк – Е553, алюмосилікати – Е554 –Е556, 559 |
|
понад 40% олова – для покриття консервних банок; олов’яна фольга (станіоль) – обгортки для харчових продуктів; хлорид – харчова добавка Е512 |
свинцеві припої – для виготовлення консервних банок |
|
|
Сільське господарство |
поташ, карбамід – добриво; діалкілдітіо-карбамати – в якості фунгіцидів |
силікати Nа та К – для хімічного укріплення слабких ґрунтів; нефелин (алюмо-силікат)– добриво |
|
у якості інсектицидів |
у якості інсектицидів |
|
|
Медицина |
Широко застосовуються похідні вугільної та карбонових кислот та інші органічні речовини, наприклад, активоване вугілля – для виведення токсинів, графіт у вигляді мазей – для лікування захворювань шкіри; алмазні напилення – шліфувальні насадки бормашин |
SіО2 у якості допоміжної речовини (внесений до більшості фармокопей); ентеросорбент; тальк (магній гідросилікат) – у якості адсорбуючої та поглинаючої речовини |
сполуки Gе мають нейротропну, гіпотензивну, фунгіцидну, бактери-цидну, проти-вірусну, анти-радіаційну та проти-пухлинну активність; імуно-модулюючу здатність |
амальгами – в стома-тології |
Рb – для захисту від іонізуючих випромінювань в рентгенівській техніці; хлорид – при виготовленні мазей для обробки пухлин |
|
|
Будівництво та силікатна промисло-вість |
карбону нітрид С3N4 та сіалон (отримують заміщенням у нітриді частини кремнію на алюміній) –– жаростійка легка конструкційна кераміка |
SiO2 – сировина для виробництва скла (СаО∙Na2O∙6SiO2 – віконне скло, К2О∙PbO∙SiO2 – кришталь), азбесту (CaO3MgO4SiO2), кераміки (будівельна кераміка – цегла, черепиця, труби, плитка; побутова кераміка – фаянсові та порцелянові вироби; технічна кераміка – ізолятори, автомобільні свічки запалювання, високотемпературні тиглі тощо), цементу (CaOAl2O3SiO2Fe2O3) та ін. |
виробництво керамічних виробів та емалей; виробництво спеціального оптичного скла |
сполуки олова – вироб-ництво жаро-стійких емалей та глазурі; SnO2 – домішка до скла, емалі, що надає їм білого забарв-лення |
PbO – для отримання деяких сортів скла (кришталь); Pb(OН)2·PbСO3 – свинцеве білило – у технології цементу |
|
* – курсивом у таблиці виділені найбільш поширені сфери застосування елемента та його сполук
Із природних матеріалів, що містять кремній, виготовляють скло, кераміку, цемент.
Скло — це твердий прозорий матеріал. Найпоширенішим є силікатне скло, основний компонент якого — оксид силіцію (ІV) Si02. Сировиною для виробництва звичайного скла є сода Na2CО3, вапняк СаСО3 і пісок SiО2. Усі складові частини очищують, змішують і сплавляють за температури близько 1400 °С. Спрощено відбуваються такі реакції:
Na2CО3 + SiО2 = Na2SiО3 + CО2↑
СаСО3 + SiO2 = CaSiО3 + СО2↑
Фактично до складу скла входять силікати натрію і кальцію, а також надлишок SiО2. Тому склад звичайного віконного скла можна подати такою спрощеною формулою: Na2О•СаО•6SiО2. Змінюючи склад шихти, додаючи різні добавки, одержують скло з наперед заданими властивостями. Так, якщо замість соди Na2CО3 взяти поташ К2СО3, то можна добути високоякісне тугоплавке скло, з якого виготовляють хімічний посуд. А якщо взяти поташ К2СО3, кремнезем SiО2 і оксид плюмбуму(ІІ) РbО, то утвориться кришталь. Особливий вид скла — кварцове скло. Воно являє собою склоподібну форму чистого кремнезему SiО2. Таке скло зовсім не чутливе до різких коливань температури, воно має цінні оптичні властивості (пропускає ультрафіолетові промені). Скло широко використовують майже у всіх галузях промисловості та в побуті. З нього виготовляють труби, тару, лабораторний посуд, деталі оптичних приладів, художні вироби, побутовий посуд. На основі скла виготовляють скловолокно, яке застосовують для пошиття спецодягу, а також склопластики, зокрема склотекстоліт. Цей склопластик — чудовий будівельний матеріал (міцний, не гниє, легко обробляється). Склотекстоліт використовують як конструкційний матеріал у машинобудуванні, а в електроніці — як ізолятор. На основі скла створюють мікрокристалічні матеріали — ситали. Вони дуже міцні, хімічно й термічно стійкі, а тому використовуються для виготовлення апаратури для хімічних виробництв, деталей машин і механізмів, труб, електроізоляторів тощо. Сучасна промисловість виробляє спеціальне скло, стійке проти дії радіоактивного випромінювання.
Вироби з глини називають керамікою, а керамічне виробництво — гончарним. Найпоширеніша кераміка та, що складається з різних оксидів, у тому числі — оксиду силіцію(IV) SiО2. Із керамічних виробів важливе значення мають порцеляна і фаянс.
Порцеляна — один із видів тонкої кераміки — білий матеріал, складається в основному з SiО2, Al2О3 і К2О. Як сировину для добування порцеляни використовують білу глину — каолін, кварцовий пісок і польовий шпат (К2О•Аl2О3•6SiО2). Порцеляна має невелику пористість, через що вона водо- і газонепроникна, доволі високу механічну міцність і термостійкість, електроізоляційні властивості. З неї виготовляють санітарно-технічні вироби, електроізолятори, предмети побуту і художні вироби.
Фаянс — керамічний матеріал, схожий на порцеляну, покритий тонкою склоподібною плівкою — поливою. Містить ті самі компоненти, що й порцеляна, але в інших співвідношеннях. Із фаянсу виготовляють личкувальну плитку, посуд, художні вироби.
Велика група спеціальних керамічних виробів використовується у будівництві. З кераміки виготовляють цеглу, панелі для стін, плитку для підлоги, черепицю, труби, а також глиняний посуд, горщики для квітів.
Цемент являє собою сірий порошок, який складається із силікатів та алюмінатів кальцію, що під час змішування з водою швидко висихає і твердне, перетворюючись на каменеподібну масу. Для добування цементу як сировину використовують вапняк, глину та інші речовини. Сировина завантажується у піч, перемішується і спікається за температури у межах 1400 — 1600 °С. Одержану масу, основними компонентами якої є СаО, SiO2 і Аl2О3, охолоджують і перемелюють на порошок. Добувають цемент різних сортів: морозовитривалий, такий, що швидко твердне, та ін. Цемент — важливий будівельний матеріал. Із суміші цементу, піску й води готують будівельні розчини. Цемент, змішаний з водою і наповнювачами (піском, щебенем, гравієм, шлаком), утворює суміш, з тужавінням якої утворюється бетон. Якщо бетоном залити сталевий каркас, дістанемо залізобетон. Із нього роблять балки, панелі, труби, мости, перекриття, шпали.
Германій – напівпровідник, з нього виготовляють діоди, тріоди, транзистори для радіотехніки. Монокристалічний германій застосовується в дозиметричних приладах, приладах для вимірювання напруженості магнітного поля. Завдяки прозорості в інфрачервоній області спектру металевий германій та його диоксид використовують в оптиці.
Олово застосовується в електронній промисловості, у виробництві комп'ютерів, надпровідникових матеріалів. SnО2 використовується для виготовлення хімічних напівпровідникових сенсорів (для визначення О2, СО, NО2 та ін.). Дисульфід олова SnS2, так зване “сусальне золото”, використовується для позолоти деревини.
Свинець йде на виготовлення покриття для електричних кабелів. Його застосовують для захисту від йонізуючих випромінювань в ядерній техніці; у друкарському сплаві (Рb+Sn+Sb), Pb(C2H5)4 – плюмбум(ІІ) тетраетил раніше широко застосовувався як антидетонатор моторного палива (етилований бензин).
5.9 Біологічна роль та токсикологія
Карбон – основа всіх органічних речовин. Карбон – основа життя. Будь-який живий організм складається значною мірою з карбону. Джерелом карбону для живих істот є вуглекислий газ з атмосфери або води. СО2 відіграє значну роль у біологічних процесах. Він бере участь у фотосинтезі (при якому відбувається утворення полісахаридів з вуглекислого газу та води під впливом сонячного світла:
6nСО2 + 5nН2 → (С6Н10О5)n + 12nO2
Біологічний цикл карбону закінчується або окисненням і поверненням в атмосферу, або захороненням у вигляді нафти або вугілля. СО2 є одним з парникових газів (викликає парниковий ефект); також бере участь у геохімічних процесах (розчинення в океані та утворення карбонатів).
Високий вміст вуглецю в атмосферних аерозолях призводить до підвищення захворюваності населення, особливо верхніх дихальних шляхів та легенів. Професійні захворювання – в основному антракоз та пиловий бронхіт. Оксид карбону (ІІ) або чадний газ СО, утворюється при неповному згоранні палива, взаємодіє з гемоглобіном крові, з утворенням комплексної сполуки, яка не здатна переносити кисень до тканин, а також сприяє відкладенню ліпідів (жирових бляшок) на стінках коронарних судин, що спричиняє розвиток атеросклерозу. Оксид карбону (ІV) або вуглекислий газ нетоксичний, при невисоких концентраціях збуджує дихальний центр, при дуже високих – пригнічує його, має наркотичну дію, подразнює шкіру та слизові оболонки.
Сполуки кремнію є нетоксичними, але небезпечним є вдихання як високодисперсних частинок силікатів, так і кремній діоксиду – це призводить до виникнення небезпечної хвороби силікозу (руйнування легеневої тканини).
Сполуки германію є малотоксичними. Більш токсичними є двовалентні сполуки. Металічне олово є нетоксичним. Довготривала дія пилу олова призводить до пневмоконіозу (так званий станоз). Гостре отруєння сполуками олова характеризується головними болями, болями у животі, розладами зору, схудненням, у деяких випадках спостерігаються психічні розлади. Небезпеку складає збільшення вмісту олова в консервованих продуктах та напоях, що може бути спричинене корозією та вимиванням металу з тари. Корозія підсилюється за наявності нітратів у продуктах харчування, тривалому зберіганні, підвищених температурах тощо.
Сполуки плюмбуму є надзвичайно токсичними. Вони призводять до пригнічення дії ферментів окислювально-відновних процесів, викликають злоякісні пухлини; розклад клітин головного мозку, мають мутагенну дію та негативно впливають на репродуктивну функцію людини.
Контрольні питання
- Розгляньте будову атомів та можливі валентні стани елементів ІV групи. Які ступені окиснення проявляють елементи в сполуках?
- Охарактеризуйте зміни радіуса атомів, енергії йонізації, електронегативності в ряду С – Рb. Проілюструйте на прикладі оксидів елементів ІV групи перехід від неметалічних до металічних властивостей.
- Як і чому в цьому ряду змінюється стійкість сполук з вищим ступенем окиснення?
- Які прості речовини утворюють елементи ІV А групи? Розгляньте їхні алотропні модифікації. Чим пояснюється властивість атомів Карбону сполучатися у довгі ланцюги?
- Охарактеризуйте хімічні властивості простих сполук елементів ІV групи. Як їх отримують у промисловості?
- Опишіть властивості водневих сполук елементів ІV А групи.
- Чому SіО2, на відміну від СО є твердою речовиною? Проілюструйте за допомогою рівнянь реакцій хімічні властивості оксидів карбону та кремнію.
- Як змінюються кислото-основні властивості гідроксидів елементів ІV групи? Наведіть відповідні рівняння реакцій.
- Напишіть рівняння реакцій, за допомогою яких можна здійснити перетворення:
СО2 → СОСl2 → СО2 → С → Аl4С3→ СН4;
Sі → Nа2SіО3→ Н4SіO4 → SіО2→ SіСl4 → К2SіO3;
Рb → Рb(ОН)2 → РbО2 → Рb3О4→ РbСl2 → Н2[Рb Сl6].
- Як у промисловості використовуються сполуки кремнію?