Тема 6 р-Елементи ІІІ А групи
|
План 6.1 Загальна характеристика елементів ІІІ А групи. 6.2 Знаходження у природі. 6.3 Фізичні властивості. 6.4 Способи добування. 6.5 Хімічні властивості. 6.6 Сполуки елементів ІІІ А групи. 6.7 Застосування. 6.8 Біологічна роль та токсикологія. |
6.1 Загальна характеристика елементів ІІІ А групи
Елементи ІІІ А групи: Бор 5В, Алюміній 13Аl, Галій 31Gа, Індій 49Іn та Талій 82Тl – мають мало стабільних ізотопів, що характерно для атомів з непарними порядковими номерами. Електронна конфігурація основного стану ns2nр1 характеризується наявністю єдиного неспареного електрона. У збудженому стані вони мають три неспарені електрони, які, знаходячись у стані sр2-гібридизації, беруть участь в утворенні трьох ковалентних зв'язків. При цьому в атомів елементів цієї підгрупи залишається одна незайнята орбіталь, і кількість валентних електронів виявляється меншою, ніж кількість доступних за енергією орбіталей. Тому багато ковалентних сполук елементів ІІІ А групи є кислотами Льюїса – акцепторами електронної пари, з якою вони не тільки підвищують своє координаційне число, але і змінюють свою геометрію – вона з плоскої стає тетраедричною (стан sр3-гібридизації).
Властивості бору дуже відрізняються від інших елементів підгрупи. Бор – єдиний неметал, хімічно інертний, утворює ковалентні зв'язки (В–F, В-N, В–С тощо), кратність яких часто збільшується за рахунок рπ-рπ–зв'язування. Хімія бору більше нагадує хімію кремнію (діагональна аналогія).
У атомів алюмінію та його аналогів з'являються вакантні d-орбіталі, зростає радіус атома, тому координаційне число збільшується до шести (та вище).
Галій, Індій і Талій розташовані в Періодичній системі відразу за металами d-блоку, тому часто їх називають постперехідними елементами. Заповнення d-оболонки супроводжується поступовим стисненням атомів, а в 3d-ряду воно виявляється настільки сильним, що нівелює зростання радіуса при появі четвертого енергетичного рівня. У результаті d-стиснення іонні радіуси Алюмінію та Галію близькі, і атомний радіус Галію навіть менший, ніж Алюмінію.
Немонотонна зміна енергії йонізації (з локальним максимумом для Галію) вниз по групі пояснюється її залежністю як від ефективного заряду ядра, так і від радіуса атома. При переході від Аl до Gа зростання ефективного заряду ядра виявляється більш значним, ніж зміна радіуса атома, тому енергія йонізації збільшується. Зменшення енергії іонізації від Gа до Іn обумовлено зростанням радіуса та ефективного заряду ядра. Зростання енергії йонізації при переході від Іn до Тl є результатом d- та f-стиснення, яке призводить до підсилення взаємодії електронів з ядром – "ефект інертної 6s2-пари", що проявляється також у постперехідних елементів шостого періоду (Рb, Ві, Ро) та призводить до зниження стабільності їхніх сполук у вищому ступені окиснення. Так, для Талію, Плюмбуму, Бісмуту та Полонію найбільш стійкими є сполуки зі ступенем окиснення +1, +2, +3, +4 відповідно.
Для сполук елементів ІІІ А групи найбільш характерний ступінь окиснення +3. У ряду В – Аl – Gа – Іn – Тl стійкість таких сполук зменшується, а стійкість сполук зі ступенем окиснення +1, навпаки, збільшується. Енергія зв'язку Е–Г у галогенідах та льюїсова кислотність останніх при переході від більш легких до більш важких елементів зменшується. Амфотерні властивості оксидів змінюються в бік більшої основності, гідроліз аквакатіонів послаблюється.
Хімія Індію та особливо Галію дуже подібна до хімії Алюмінію. Сполуки цих елементів у нижчому ступені окиснення диспропорціонують:
3 ІnСl = ІnСl3 + 2 Іn.
Для Талію, навпаки, ступінь окиснення +1 є найбільш стійким внаслідок інертності електронної 6s2-пари.
6.2 Знаходження у природі
Бор порівняно мало розповсюджений у земній корі (9·10-4 мас.%), де він зустрічається у вигляді сполук з оксигеном: боратів та боросилікатів. Від назви одного з найпоширеніших боратів – бури Nа2В4О7·10Н2О (лат. borax) – і походить назва елементу.
За поширеністю в природі Алюміній займає третє місце після Оксигену і Силіцію (8,3 мас.%). Алюміній – найбільш розповсюджений метал, входить до складу багатьох мінералів (більше 250), найважливішими з яких є нефелін Nа3К[AlSiO4]4, каолін Al2O3·2SiO2·2H2O, боксит Al2O3·H2O, корунд Al2O3. Коштовні камені – рубін, сапфір – це кристали корунду, забарвлені домішками оксиду хрому (рубін) та оксидами титану і феруму (сапфір). Також Алюміній входить до складу польових шпатів, лищаку, глин тощо.
Галій (4,6·10-4 мас.%), Індій (2·10-6 мас.%) та Талій 8·10-7 мас.%), відносяться до рідкісних елементів. Внаслідок близькості іонних радіусів галій супроводжує Алюміній у бокситах, а Талій – Калій у алюмосилікатах.
6.3 Фізичні властивості
|
|
Бор – тугоплавкий діамагнітний порошок чорного (кристалічний) або бурого (аморфний) кольору, погано проводить тепло та електричний струм. Алюміній, галій, індій і талій – сріблясті метали з характерним блиском, високою тепло- та електропровідністю. При зберіганні на повітрі талій швидко тьмяніє, внаслідок утворення оксидної плівки. Кристалічний бор побудований з ікосаедрів – двадцятигранників, які утворюються з дванадцяти атомів бору. Бор утворює декілька модифікацій, які відрізняються способами просторового розміщення та з'єднання ікосаедрів – рисунок 6.1. У кристалі бору такі структурні одиниці утворюють систему, подібну щільній упаковці куль, в якій ікосаедри пов'язані між собою ковалентними зв'язками. Велика енергія зв'язків В-В (286 кДж/моль) між ікосаедрами зумовлює високі значення твердості, температури та енергії фазових переходів, а також хімічну інертність кристалічного бору. Кристалічний бор та багато його сполук (бориди, борани) відносяться до електронодефіцитних, тому що двох електронів, що вони містять, недостатньо для утворення двоцентрових двоелектронних зв'язків. Навіть для найщільнішої α-ромбоедричної модифікації об'єм, який займає бор, складає всього 37% – у структурі бора є великі пустоти, де можуть додатково розміщуватися атоми як самого бору, так і інших елементів. |
Зменшення енергії зв'язку Е–Е із зростанням розміру атома призводить до зміни молекулярної ікосаедричної структури ковалентного бору на кубічне дуже щільне пакування атомів у металічному алюмінії. Цим пояснюється різке зниження енергій атомізації та ентальпії фазових переходів (плавлення та кипіння) від бору до алюмінію. Алюміній – легкий, парамагнітний метал сріблясто-білого кольору, легко піддається механічній обробці. Густина алюмінію складає 2,7 г/см3. Має високу тепло- та електропровідність, стійкий проти корозії завдяки утворенню на поверхні оксидної плівки.
Пухка структура металічного галію побудована із димерів Gа2, які зв'язані слабкими ван-дер-ваальсовими силами, і дуже схожа на структуру йоду. Цим пояснюється низька температура плавлення галію та унікальна широка область рідкого стану (30–22040С). При плавленні його густина зростає (аналогічна аномалія характерна для води). Для руйнування ущільненої структури галію необхідна додаткова енергія, що зумовлює високу температуру кипіння.
Індій та талій кристалізуються в щільній металічній структурі (кубічній та гексагональній відповідно) з високими координаційними числами (12).
Внаслідок зростання розміру атомів, перекриття р-орбіталей, міцність металевих зв'язків і відповідно ентальпії атомізації, плавлення, температури кипіння простих речовин у ряду від Аl до Тl зменшуються.
6.4 Способи добування
Аморфний бор, сильно забруднений боридами металів, отримують металотермічним відновленням оксиду чи зневодненої бури:
В2О3 + 3Мg → 2В + 3МgО.
Більш чистий продукт утворюється при відновленні летких сполук бору воднем на нагрітій до 11500С танталовій проволоці:
2ВВr3 + 3Н2 → 2В + 6НВr,
або при їх термічному розкладанні (5000С):
2ВІ3 → 2В + 3І2.
Хоча як елемент Алюміній є найбільш розповсюдженим у земній корі металом, але у вільному вигляді із руди його виділили близько 200 років тому, і тривалий час він був великою рідкістю і коштував дорожче золота.
Зараз за об'ємами виробництва алюміній займає одне з перших місць серед металів (світове виробництво сягає 20 млн. т у рік). Із бокситів алюміній виділяють електролізом. Спочатку боксит розчиняють під тиском у гарячому розчині NаОН, при цьому утворюється розчинний гідроксоалюмінат, який фільтруванням відокремлюють від гідроксиду заліза та інших нерозчинних домішок. Далі у розчин пропускають СО2 та вносять ініціатор отримання кристалічного Аl(ОН)3, який потім зневоднюють. Отриманий Al2O3 розчиняють у розплавленому кріоліті Na3[AlF6] (для того, щоб знизити температуру плавлення: для бокситу Тпл.=20720С, для суміші з кріолітом – 8000С). Далі проводять електроліз розплаву (катодом є корпус електролізера, викладений графітовими плитками, анодом – графітовий електрод, на ньому виділяється кисень).![]()
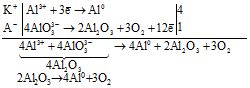
Під дією кисню графітовий анод згорає, при цьому утворюється значна кількість шкідливих речовин. На виробництво 1 т металу витрачається 550 кг аноду та велика кількість електроенергії.
Галій, індій, талій виділяють електролітично зі збагачених розчинів їхніх солей, які отримують як побічні продукти при переробці алюмінієвих, цинкових та свинцевих руд.
6.5 Хімічні властивості
Кристалічний бор хімічно інертний. З киснем він реагує лише за 7500С з утворенням В2О3. Не взаємодіє з гарячими концентрованими НF, НСl, NаОН. Аморфний бор хімічно більш активний і повільно окиснюється гарячими концентрованими НNО3 та Н2SО4, хромовою сумішшю, концентрованими розчинами Н2О2, наприклад:
В + 3 НNО3 → Н3ВО3 + 3NО2.
Бор реагує з розплавленими Nа2О2, КNО3, Nа2СО3, а за присутності окисника при нагріванні – і з лугами:
4В + 4 NаОН +3О2 → 4NаВО2 + 2Н2О.
Суміші аморфного бору з КМnО4 та РbО2 при розтиранні загораються, а суміші з НІО3 – вибухають. За високих температур бор реагує із більшістю простих речовин, за виключенням Н2, Gе, Те, інертних газів та меркурію.
Алюміній, галій, індій взаємодіють з неметалами (О2, N2, S, галогенами тощо), з утворенням відповідних оксидів Е2О3, нітридів ЕN, сульфідів Е2S3, галогенідів ЕГ3. За надлишку металу можна отримати нижчі сульфіди (GаS, ІnS) та галогеніди (ІnВr тощо). Талій за цих умов утворює сполуки зі ступенем окиснення +1.
Реакція алюмінію з киснем протікає під час нагрівання, коли тріскається захисна оксидна плівка на поверхні металу. Порошкоподібний алюміній при нагріванні активно згорає на повітрі:
![]()
Завдяки високій спорідненості до кисню, реакція окиснення алюмінію супроводжується великою кількістю теплоти та використовується для відновлення багатьох металів з їхніх оксидів, наприклад:
2Аl + Fе2О3 → Al2О3 + 2Fе.
Цей процес називається алюмотермією та використовується для отримання сплавів феруму, марганцю, хрому, ванадію та ін.
З багатьма металами алюміній утворює інтерметаліди, наприклад, СuАl2, Al2СuМg тощо.
Алюміній, галій, індій та талій розташовані лівіше водню в ряду напруг, тому термодинамічно можливе їх окиснення водою та кислотами-неокисниками.
Взаємодія з водою:
Алюміній та галій реагують з водою, якщо з поверхні видалити захисну оксидну плівку:
![]()
Взаємодія з розбавленими розчинами кислот:
Алюміній легко розчиняється в розбавлених кислотах з утворенням солі і виділенням водню (якщо з його поверхні видалити оксидну плівку):
2Al + 6HCl → 2AlCl3 + 3H2
Проте дуже розбавлені розчини азотної та сульфатної кислот на алюміній практично не діють, відбувається пасивація, а в помірно концентрованих розчинах цих кислот алюміній розчиняється:
10Al + 36HNO3(помірно розбавлена) → 10Al(NO3)3 + 3N2↑ + 18H2О
2Al + 6H2SO4 (помірно розбавлена) → Al2(SO4)3 + 3SO2↑ + 6H2О
Взаємодія з концентрованими кислотами:
У концентрованих холодних HNO3 і H2SO4 алюміній пасивується:
2Аl + 6HNO3(к) → Al2O3 + 6NO2 + 3H2О
2 Аl + 3H2SO4(к) → Al2O3 + 3SO2 + 3H2О
Індій та талій також розчиняються в кислотах, але талій при взаємодії з кислотами-неокисниками утворює солі Тl(І). Реакція талію з галогенвмісними кислотами гальмується внаслідок утворення низько розчинних галогенідів. Похідні Тl(ІІІ) утворюються при дії на Тl "княжої води" чи інших сильних окисників.
Взаємодія з лугами:
Основні властивості сполук зростають у ряду Аl – Gа – Іn – Тl, а кислотні зменшуються. Алюміній та галій реагують із лугами:
Аl + 6KOH + 6H2O → 2K3[Аl(OH)6]+3H2↑
Індій та талій у лугах не розчиняються.
6.6 Сполуки елементів ІІІ А групи
Водневі сполуки.
Гідриди бору. Гідриди бору (борани) – одні з найбільш незвичайних неорганічних сполук із складною стехіометрією, великою різноманітністю хімічних реакцій. Борани –·отруйні, нестійкі молекулярні сполуки з дуже неприємним запахом. Хімічно активні, легко окиснюються на повітрі та розкладаються водою.
Моноборан ВН3 нестійкий. Для нього характерні реакції приєднання молекул з неподіленими електронними парами, наприклад, приєднання аміаку. Особливе місце серед боранів займає диборан В2Н6, з якого синтезують всі інші борани. Його, в свою чергу, отримують відновленням сполук бору натрій гідридом чи літій алюмогідридом. Він також взаємодіє з кислотами Льюїса – донорами електронних пар:
В2Н6 + 2:СО → 2Н3В2СО – гемолітичне розщеплення,
в етерах: В2Н6 + 2LіН → 2LіВН4 – гетеролітичний розклад,
літій тетрагідроборат
Тетрагідроборати – типові відновники, мають важливе промислове значення.
На повітрі диборан самозаймається з утворенням оксиду, а при нагріванні без доступу повітря утворює суміш вищих нестійких боранів.
Гідриди алюмінію, галію, індію та талію
Міцність ковалентних зв'язків Е–Н елементів ІІІ А групи зменшується. Властивості гідридів цих елементів значно відрізняються від властивостей гідридів бору. За звичайних умов гідриди Аl, Gа, Іn, Тl – тверді нелеткі речовини, нерозчинні у полярних розчинниках.
Алюмінію гідрид (АlН6)n – нестійка сполука, яка розкладається за 1500С, активно реагує з водою з виділенням водню. Гідриди Gа, Іn, Тl легко розкладаються вже за кімнатної температури.
Важливе значення мають комплексні гідриди МЕН4, де М – лужний метал. З них найбільш важливим є літій алюмогідрид LіАlН4 – нестійка сполука, легко розкладається за присутності вологи:
LіАlН4 + 4Н2О → LіОН + Аl(ОН)3 + 4Н2.
Має дуже сильні відновні властивості, його використовують при синтезі гідридів Sі, S, Р, С, Gе, Sn тощо, в органічному синтезі, а також для сушіння газів.
Галогеніди елементів ІІІ А групи
Галогеніди бору. Відомими є чотири вищих галогеніди бору: ВF3, ВСl3, ВВr3, ВІ3. У цьому ряду стійкість сполук зменшується, а л'юїсова кислотність зростає. Від фториду до йодиду підсилюються міжмолекулярна взаємодія, тому зростають температури плавлення та кипіння: ВF3, ВСl3– гази, ВВr3 – рідина, ВІ3 – летка тверда речовина. Тригалогеніди бору – акцептори електронів і легко взаємодіють з молекулами – донорами електронів (наприклад, NН3). Кислотність сполук ВГ3 виявляється в їхній схильності до гідролізу. Вони миттєво розкладаються водою:
ВГ3 + 3Н2О → Н3ВО3 + 3 НГ (Г= Сl, Вr, І).
Фторид повільно взаємодіє з водою:
4ВF3 + 3Н2О → Н3ВО3 + 3 НВF4.
Тетрафтороборна кислота, що утворюється в результаті цієї реакції значно сильніша, ніж НF.
Галогеніди алюмінію, галію, індію та талію
Для цих елементів відомі галогеніди складу ЕГ3, ЕГ2, ЕГ. З них найбільше значення мають тригалогеніди. Всі вони малорозчинні у воді, за винятком ТlF3, який повністю гідролізується з утворенням Тl(ОН)3. При переході від Аl до Тl стійкість сполук знижується. Для талію стійкими є сполуки зі ступенем окиснення +1, наприклад ТlСl. Тригалогеніди ЕГ3 проявляють властивості кислот Льюїса та утворюють різноманітні комплексні сполуки, наприклад: Аl(NН3)3Сl3, ІnСl3(Н2О)3 тощо.
Оксигенвмісні сполуки
Для всіх елементів ІІІ групи характерне утворення оксидів та їхніх похідних з вищим ступенем окиснення +3. Для талію стійкими є оксиди та гідроксиди зі ступенем окиснення +1.
Кисневі сполуки бору
До найважливіших кисневих сполук бору відноситься бору оксид В2О3, борні кислоти та їхні солі – борати.
Бору оксид В2О3 – отримують високотемпературним окисненням бору:
4 В + 3 О2 → 2В2О3,
або зневодненням розплавленої Н3ВО3:
2Н3ВО3 → В2О3+ 3Н2О.
За підвищених температур В2О3 відновлюється до бору лужними металами, магнієм, алюмінієм тощо.
Ортоборна (борна) кислота В(ОН)3 (Н3ВО3) – кінцевий продукт гідролізу розчинних сполук бору, наприклад, бури. Борна кислота – тверда речовина, розчиняється у воді, є одноосновною кислотою. Але її кислотні властивості зумовлені не відщепленням йону водню, а приєднанням гідроксильної групи молекули води, яка відіграє роль основи Льюїса:
В(ОН)3 + Н–ОН = [ В(ОН)4]- + Н+.
Кислотні властивості Н3ВО3 проявляються в тому, що у присутності концентрованої Н2SО4 (як водовіднімаючого засобу) зі спиртами вона утворює етери.
За часткової дегідратації Н3ВО3 вище 1000С з неї утворюються метаборні кислоти (НВО2)n.
Борати – солі борних кислот. Завдяки легкості перебудування зв'язків В–О–В та різним комбінаціям бору з координаційними числами 3 та 4 існують численні варіанти зв'язування поліборатних аніонів (ВО33-, В3О63-, В(ОН)4-, (ВО2)nn-, В2О6(ОН)4-, В4О5(ОН)42-). З цієї точки зору борати подібні до силікатів та фосфатів. Склад водних розчинів боратів залежить від рН, концентрації, температури.
Оксиди та гідроксиди алюмінію, галію, індію і талію
Алюміній оксид Al2О3 існує у декількох кристалічних модифікаціях. Корунд α– Al2О3 – білий тугоплавкий порошок, за твердістю наближається до алмазу, хімічно інертний, що пояснюється щільністю його структури. γ- Al2О3 – хімічно активний, розчиняється у лугах та кислотах.
Корунд Al2О3 має амфотерний характер, нерозчинний у воді, кислотах та лугах. Перевести Al2О3 у розчин можна лише сплавлянням із карбонатами, гідроксидами, гідрогенсульфатами:
Аl2O3 + 2NaOH ![]() 2NaАlO2 + H2O.
2NaАlO2 + H2O.
Галію оксид Gа2О3 за структурою та властивостями нагадує Al2О3, індію оксид Іn2О3 – жовта кристалічна речовина.
Талію оксид Тl2О3 виділяється у вигляді чорно-коричневого осаду при окисненні солей талію(І) у лужному середовищі:
ТlNO3 + 6KOH + 2 Cl2→ Тl2O3 + 3KNO3 + 4 КСl + 3Н2О
Гідроксид талію(ІІІ) невідомий.
Відповідні гідроксиди Алюмінію, Галію та Індію одержують непрямим шляхом, наприклад:
Аl2(SO4)3 + 6KOH → 2Аl(OH)3 + 3K2SO4
Al(OH)3 – амфотерний гідроксид:
Al(OH)3 + 3HCl → AlCl3 + 3H2O
Al(OH)3 + NaOH → Na[Al(OH)4].
У ряду Аl–Gа–Іn–Тl підсилюються основні властивості оксидів та гідроксидів. Якщо гідроксиди Алюмінію та Галію порівняно легко розчиняються у лугах, то гідроксоіндати утворюються лише за рН більше 13, а Тl2О3 розчинний лише у кислотах.
Термічна стійкість оксидів та гідроксидів знижується в групі зверху вниз, а окисна здатність – зростає. Тl2О3 розкладається вже за 1000С.
Солі трьохвалентних катіонів у розчинах дуже гідролізовані. Зверху вниз у групі схильність солей до гідролізу поступово зменшується. Склад катіонних форм Алюмінію, Галію та Індію в розчині доволі складний (утворюються різні аквагідроксокомплекси).
Солі, утворені слабкими кислотами (сульфіди, карбонати й інші), гідролізуються незворотно. Наприклад:
Al2S3 + 6H2O → 2Al(OH)3 + 3H2S↑
Солі талію(ІІІ) – сильні окисники.
Кисневі сполуки зі ступенем окиснення +1 детально досліджені лише для талію. Тl2О, як і оксиди лужних металів, реагує з водою з утворенням гідроксидів. Гідроксид талію(І) – сильна основа, добре розчинна у воді, спирті, розчиняє скло, поглинає вуглекислий газ. За незначного нагрівання дегідратує.
6.7 Застосування
Найпоширеніші сфери застосування представлені в таблиці 6.1.
Алюміній – другий (після заліза) метал за масштабами використання у сучасній техніці, як в чистому вигляді, так і у сплавах. Особливе значення має дюралюміній, силумін, авіаль. Силумін – сплав алюмінію (85-90%) з кремнієм (10-15%). За міцністю силуміни не поступаються сталі, але набагато легші і мають винятково високі ливарні властивості, широко застосовуються в Таблиця машинобудуванні. Дюралюмін – це складний сплав: ≈ 4% міді, 1% магнію, 1% кремнію, 1% мангану та 93% алюмінію. Дюралюміни мають високу механічну міцність, за твердістю вони наближаються до сталі, але в 3 рази легші за неї. Це основний матеріал літакобудування. Велика кількість алюмінію йде на виготовлення дроту, фольги, еластичної упаковки.
Порошкоподібний алюміній використовують як сріблясту фарбу. Алюміній використовують для виготовлення дзеркал. Al2O3 має велике значення для виготовлення штучних рубінів і сапфірів, із яких роблять лазери і підшипники для точних механізмів. Сполуки алюмінію використовують у якості пігментів (наприклад, охра, умбра). Алюміній сульфат використовують для очистки води у якості коагулянту.
Таблиця 6.1 – Застосування елементів ІІІ А групи та їхніх сполук*
|
Сфера застосування |
Бор |
Алюміній |
Індій |
Талій |
|
|
1 |
2 |
3 |
5 |
|
|
|
Металургія, обробка металів |
добавка до сталей та сплавів кольорових металів для підвищення жароміцності та корозійної тривкості; оксид, натрій тетраборат – флюс при пайці; карбід, нітрид тетраборат – абразив; борани, борати – у зварюванні металів |
Аl та його сплави – найважливіші конструкційні матеріали; в алюмотермії (відновлення металів із їх оксидів); нітрид – в якості абразиву |
для виробництва антикорозійних покриттів; компонент легкоплавких припоїв та сплавів, (дозволяє сплавляти метал із склом) |
для легування германію, кремнію, сполук кадмію для надання їм акцепторних властивостей |
|
|
Хімічна промисловість |
оксид – в якості зневоднюючого агенту; К та Nа пентаборати, метаборати Cа, Рb, Ва – виробництво скло-волокна, пластмас, відбілювачів, миючих засобів; фторид – каталізатор у органічному синтезі |
активований оксид – як каталізатор та осушувач; хлорид – каталізатор; |
у якості каталізаторів при окисненні вуглеводнів, полімеризації, оксидуванні; для виробництва фарбників |
||
|
Легка промисловість (текстильна, паперова, шкіряна тощо) |
натрій тетраборат – у шкіряній, текстильній (відбілювач), гумовій промисловості; К та Nа пентаборати, метаборати Cа, Рb, Ва – у текстильній промисловості |
алюмокалієві галуни (подвійні солі сульфату алюмінію з сульфатами одновалентних металів) KAl(SO4)2·12H2O застосовують для „білого” дублення шкіри, як протраву при фарбуванні тканин; хлорид, нітрат – у фарбуванні вовни; сульфат – у виробництві паперу |
|
||
|
Енергетика, атомна енергетика, джерела енергії, в т.ч. хімічні |
борна кислота – в ядерній енергетиці (поглинач нейронів); в уранових та сонячних батареях; борани – ракетне паливо; |
у якості ракетного палива |
система індій –меркурій оксид – для дуже стабільних та енергоємних акумуляторів; у складі спеціального скла для поглинання теплових нейронів у атомних реакторах |
в атомній техніці для сцинтиляційних лічильників; солі – як антидетонатори палива у двигунах внутрішнього згорання |
|
|
Електроніка, електро-техніка |
в якості напівпровідника (наприклад, надпровідник MgВ2) |
Аl – для виготовлення проводів; у мікроелектроніці – провідники; LаАlО3·СаТіО3·– сегнетоелектрик |
для виготовлення діодів, транзи-сторів, лазерів, електро-провідних покриттів; рідкокристалічних дисплеїв |
у якості напівпровідника |
|
|
Харчова промисловість |
борна кислота – харчова добавка Е284 |
Аl – один з най поширеніших пакувальних матеріалів харчових продуктів (для виготовлення консервних банок, фольги, еластичних упаковок, пробок); Аl-вмісні глини – для очищення харчових жирів; Аl – харчова добавка Е173 |
|
|
|
|
Сільське господарство |
у якості добрив – бура, борна кислота, |
|
|
у якості родентицидів – засобів боротьби з гризунами |
|
|
Медицина |
борна кислота – дезінфікуючий засіб; 10В – для лікування раку |
гідроксид – при печії, гастритах та виразках; у косметології – у складі косметичних глин, препаратів для дермабразії |
ортофосфат – добавка до зубних цементів; радіоактивні ізотопи – радіо-фармацевтичні препарати, застосовують для діагностики раку кісток |
нуклід 201Тl – для кардіологічних досліджень |
|
|
Будівництво та силікатна промисловість |
оксид – в скловарінні (для отримання забарвленого скла – в ньому розчиняються оксиди багатьох металів); борна кислота та натрій тетраборат – у виробництві скла та кераміки; К та Nа пентаборати, метаборати Cа, Рb, Ва – виробництво глазурі, емалі |
Аl-вмісні глини – сировина для виробництва цементу; цегли; оксид – виробництво вогнетривкої і хімічно стійкої кераміки; Аl – у будівництві у якості газоутворюючого агенту; боксити |
|
у виробництві спеціального скла |
|
* – курсивом у таблиці виділені найбільш поширені сфери застосування елемента та його сполук
Індієві покриття мають високу відбиваючу здатність та застосовуються для виготовлення дзеркал та рефлекторів. Талій застосовується для отримання фотоелементів з великою чутливістю, виготовлення фотодіодів; у приладах інфрачервоної техніки тощо; амальгами талію – в якості теплоносія. В оптичній промисловості він використовується для виготовлення лінз, оптичних приладів, у складі різних сплавів – у машинобудуванні. Талій йодид додають у металогалогенові лампи. Використання талію обмежене внаслідок його токсичності.
Сполуки Галію, які мають напівпровідникові властивості, використовуються у високотемпературних випрямлячах, в інфрачервоній техніці, у виготовленні оптичного скла, у лампах ультрафіолетового випромінювання, при виготовленні високотемпературних термометрів та манометрів, у ядерних енергетичних реакторах. Сполуки Галію використовуються для виготовлення люмінесцентних матеріалів, мікросхем для електронних приладів, у медицині тощо. Галій – чудовий мастильний матеріал.
6.8 Біологічна роль та токсикологія
Бор – важливий мікроелемент, необхідний для рослин. Біологічна роль бору для людини не з'ясована. Бор, оксид бору та ортоборна кислота відносяться до сильнодіючих токсичних речовин із політропною дією. Мають виражену гепатотоксичну та гонадотропну, ембріотоксичну дію. Тривале надходження ортоборної кислоти призводить до зниження апетиту, нудоти, появі висипань. Дуже отруйні борани, вони викликають токсичний набряк легенів, уражають нервову систему, нирки та печінку.
Токсичність розчинних сполук алюмінію проявляється впливом на обмін речовин, особливо мінеральний, на функцію нервової системи, розмноження та ріст клітин. Довготривале вдихання пилу алюмінію призводить до фіброзування легеневої тканини. Сполуки алюмінію безпосередньо впливають на ядерний хроматін, змінюють активність ряду ферментів. Надлишок солей алюмінію знижує затримку в організмі кальцію, зменшує адсорбцію фосфору, що призводить до зниження вмісту АТФ та порушення процесів фосфорилювання, одночасно збільшується в 10-20 разів вміст алюмінію у кістках, печінці, мозку, паращитовидній залозі. Порушується рухова активність, з'являються судоми, знижується пам'ять. Сполуки алюмінію мають також мутагенну дію.
Біологічна роль галію, індію та талію не з'ясована.
Галій – малотоксичний. При гострому отруєнні сполуками Галію спостерігаються короткочасне збудження, потім загальмованість, порушення координації рухів, ритму дихання. Сполуки Галію вражають нирки.
Працівники, які добувають індій, скаржаться на болі у суглобах, кістках, руйнування зубів, нервові та шлункові розлади, болі у ділянці серця та загальну слабкість.
Талій та його сполуки відносяться до високотоксичних речовин, що вражають центральну та периферичну нервову системи, шлунково-кишковий тракт та нирки; призводять до випадіння волосся.
Контрольні питання
- Охарактеризуйте будову атомів елементів ІІІ А групи. Які електронні конфігурації вони мають в основному та збудженому станах?
- Проаналізуйте характер зміни атомних радіусів, енергій іонізації, спорідненості до електрону та електронегативності атомів у ряду В – Тl. Чим зумовлена немонотонність зміни атомних характеристик?
- Які ступені окиснення характерні для сполук вказаних елементів? Як і чому змінюється стійкість сполук з вищим ступенем окиснення при переході від бору до талію? Яким чином досягається для бору координаційне число 4?
- Як можна пояснити різницю фізичних та хімічних властивостей бору та алюмінію? Порівняйте властивості простих речовин. Проілюструйте їх відповідними рівняннями реакції.
- Як у промисловості добувають алюміній та бор?
- Проаналізуйте властивості оксидів та гідроксидів бору. Чим зумовлена здатність бору утворювати численні оксигенвмісні аніони?
- Охарактеризуйте кислотно-основні властивості оксидів, гідроксидів Алюмінію, Галію, Індію та Талію. Чи властива амфотерність сполукам Талію?
- На чому засновано застосування алюміній сульфату для очистки води? Назвіть інші сфери застосування алюмінію.
- Проаналізуйте властивості водневих сполук елементів ІІІ А групи.
- Напишіть рівняння реакцій, за допомогою яких можна здійснити перетворення:
Аl → Nа2АlО3 →Аl2О3→ Аl(ОН)3→ АlСl3 → Nа3[Al(ОН)6].
ВСl3 → Н3ВО3→В2О3→ В → NаВО2.
