5 КЛАСИФІКАЦІЯ ТА НОМЕНКЛАТУРА НЕОРГАНІЧНИХ СПОЛУК
План
5.1 Назва хімічних елементів та простих речовин.
5.2. Основні класи хімічних неорганічних сполук та їх номенклатура.
5.1 Назва хімічних елементів та простих речовин
Відповідно Державному стандарту України ДСТУ 2439–94 "Елементи хімічні та речовини прості. Терміни та визначення основних понять. Умовні позначення" назви хімічних елементів – це суто наукові терміни, призначені для професійної мови.
Назви більшості елементiв походять від латинських назв. Наприклад: Borum – Бор, Natrium – Натрiй, Kalium – Калій, Magnium – Маґній, Chlorum – Хлор, Phosphorum – Фосфор, Iodum – Йод.
Елементи, що у вигляді простих речовин були відомі давно (залiзо, срібло, золото, мiдь, пізніше ртуть, азот, вуглець тощо), у кожній мові отримували штучні назви, які не походять від латинських. У той же час вимова символів елементів-металів у західнослов'янських мовах, зокрема, в українській, традиційно відповідала їх латинській назві: Cu – купрум (Cuprum), Ag – арґентум (Argentum), Fe – ферум (Ferrum), Pb – плюмбум (Plumbum), Au – аурум (Aurum) тощо. Тому УНКоХіТерН cхвалила уніфікувати цю практику терміноутворення, поширивши її на назви самих елементів. Замість невдалих термінів, таких як миш'як, кремній, сурма, вісмут, марганець, вживають міжнародні, латинські за походженням назви Арсен (As), Силіцій (Si), Стибій (Sb), Бісмут (Bi), Манґан (Mn).
Паралельно можна використовувати і традиційні українські назви для таких елементів як Водень, Азот, Кисень, Сірка, Нікель тощо.
Назви простих речовин пишуть з малої літери. Називаючи простi речовини, можна надавати перевагу традицiйним назвам елементiв, що їх утворили, наприклад: водень, кисень, залiзо, мiдь, манґан, цинк, вуглець, азот, ртуть тощо.
Якщо число структурних одиниць невизначене, то використовують префiкси полi- та цикло-. Приклад: S8 – цикло-октасульфур, цикло-октасірка; Pn – цикло-полiфосфор.
Для твердих полiморфних модифiкацiй можна використовувати їх позначення грецькими лiтерами, а також використовувати назви за одною з ознак: кольором, кристалiчним станом або кристалiчною структурою.
Наприклад:
α-Fe – альфа-залiзо;
α-Sn – α-станум, α-олово, сірий станум;
β-Sn – β-станум, β-олово, білий станум;
γ-Sn – γ-станум, γ-олово, ромбічний (ромб) станум, крихкий-станум;
S8 – кристалiчна сiрка.
Згідно з ДСТУ 2439-94 можна вживати також традицiйнi для української мови назви, наприклад, алмаз, графiт, озон.
Форми існування хімічного елемента
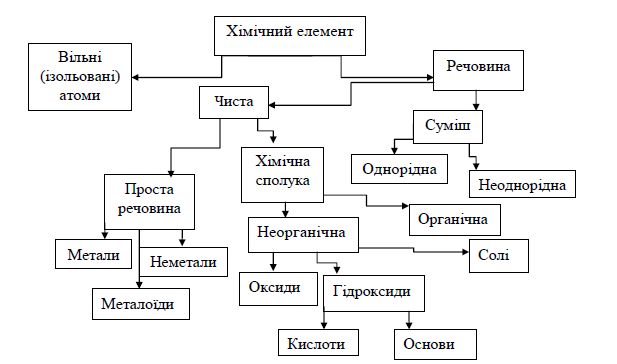
5.2. Основні класи хімічних неорганічних сполук та їх номенклатура
Оксиди – бінарні сполуки елементів з Оксигеном, в яких він проявляє ступінь окиснення -2. За хімічними властивостями оксиди поділяють на:
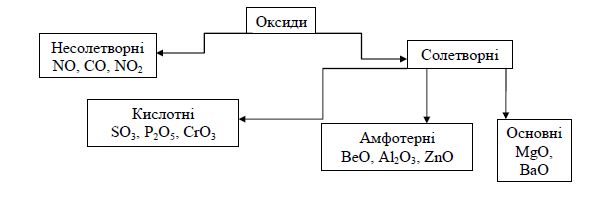
Несолетворні оксиди – реакційно здатні сполуки, які не утворюють солей.
Солетворні оксиди – оксиди, які утворюють солі.
Основні оксиди – це оксиди металічних елементів, їм відповідають основи, де металічний елемент виявляє той самий ступінь окиснення, що й в оксиді. Основні оксиди взаємодіють з розчинами кислот з утворенням солей і води.
Кислотні оксиди – це оксиди неметалічних елементів та оксиди деяких металічних елементів, в яких металічні елементи виявляють високі ступені окиснення (+5, + 6, +7). Кислотним оксидам відповідають оксигеновмісні кислоти, де елемент виявляє той самий ступінь окиснення, що й в оксиді.
Амфотерні окисди – виявляють кислотні або основні властивості.
Номенклатура оксидів
Назви оксидiв можна будувати наступними способами:
- за допомогою латинських та грецьких числових множників (множних префіксів) (моно-(ген-), ди-(ді-), три-, тетра-, пента-, гекса-, гепта-, окта-, нона-, дека-, ундека-(гендека-), додека- і т.д., закiнчення завжди зберiгається);
- за допомогою числа Штока (вказується ступiнь окиснення атома елемента, якмй утворює оксид);
- за допомогою числа Еванса–Бассета (вказується заряд йoна).
Утворення назви оксидів за допомогою чсилових множників.
Називають числовий множник атома електропозитивного елемента – катiона, потім дають систематичну назву атома електропозитивного елемента – катiона в називному вiдмiнку, далі називають числовий множник атома Оксиґену – анiона і насамкінець додається назва анiона – оксид.

Числовий префiкс моно-, звичайно, опускається, за винятком тих випадкiв, коли назва стає неоднозначною.
Наприклад: CO – каpбон монооксид, вуглець монооксид;
NO – нітpоґен монооксид, азотмонооксид
PbO – плюмбум монооксид;
SnO – станум монооксид.
Утворення назви оксидів за допомогою числа Штока.
Називається:
- систематична назва атома електропозитивного елемента – катіона;
- ступiнь окиснення атома електропозитивного елемента – число Штока (вказується в дужках римською цифрою при написаннi, без знака “плюс” чи ”мінус” і без пробілу після назви елемента);
- додається назва анiона – оксид.
Наприклад: Cr2O3 – хром(III) oксид;
Cl2O5 – хлор(V) oксид;
Mn2O7 – манґан(VII) оксид;
Sb2O3 – стибiй(III) оксид;
Bi2O3 – бiсмут(III) oксид.
Якщо атом елемента проявляє сталий ступiнь окиснення, або елемент утворює лише один оксид, або єдиний оксид у звичайній валентності, то в назвi оксиду можна не вказувати число Штока (ступiнь окиснення) і назву його складати лише з назви елемента та слова "оксид".
Наприклад: Li2O – літiй оксид; Na2O – натрiй оксид;
BeO – берилiй оксид; MgO – маґнiй оксид.
Утворення назви оксидів за допомогою числа Еванса-Бассета.
У назві оксидів вказується заряд йoна електропозитивного елемента – число Еванса–Бассета.
Наприклад: Cr2O3 – хром(3+) оксид;
FeO – ферум(2+) оксид;
Cu2O – купрум(1+) oксид.
В назвах оксидів втілюється важливий принцип: послідовність частин назви сполуки збігається з традиційним порядком написання її хімічної формули (спочатку стоїть атом менш електронегативного елемента чи катіони, а потім – більш електронегативного елемента чи аніони).
Хімічну (систематичну) назву оксиду складають з двох слів: перше є назвою елемента в називному відмінку, а друге слово – оксид.
Подвійні, потрійні та інші оксиди називають аналогічно простим оксидам, перелічуючи назви катіонів у алфавітному порядку, наприклад:
Fe3O4 = FeIIFeIII2O4 – ферум(II) диферум(III) тетраоксид; триферум(II, 2III) тетраоксид;
Al2BeO4 – діалюміній берилій оксид;
K6MgO4 – гексакалій маґній тетраоксид.
Гiдроксиди – це хімічні сполуки, до складу яких входять атоми деякого елемента Е (за винятком елементiв Флуору та Оксиґену) i одновалентнi гiдроксогрупи ОH–. Загальну формулу гiдроксидiв можна представити у виглядi Е(OH)n, де n = 1–8, тобто n дорiвнює ступеню окиснення атома елемента, який формально визначається номером групи перiодичної таблицi.
Всi гiдроксиди подiляють на двi протилежнi за хімічними властивостями групи: основнi гiдроксиди – основи та кислотнi гiдроксиди – кислоти.
Знаючи, якi властивостi має гiдроксид, вiдповiдно i записують його формулу, ставлячи на перше мiсце у формулi гiдроксиду атом металу (M), коли це основний чи амфотерний гiдроксид, або атом Гiдроґену, якщо це кислотний гiдроксид – кислота.
Гідроксиди, які у водних розчинах дисоціюють з утворенням аніонів гідроксилу OH- і ніяких інших негативно заряджених йонів не утворюють, називаються основами.

Кислотність основ визначається числом гідроксогруп -OH- (гідроксид-аніонів OH-): Натрій гідроксид NaOH– однокислотна основа; Кальцій гідроксид Ca(OH)2 – двокислотна основа.
Номенклатура основ
Назви основних гiдроксидiв, як i оксидiв, можна будувати, використовуючи числові множники або число Штока чи заряд йона.
Наприклад: Fe(OH)2 – феpум дигідpоксид;
феpум(II) гідpоксид;
феpум(2+) гідpоксид.
Якщо метал утворює тільки один основний гiдроксид, то назви таких гiдроксидiв утворюються з назви катioна i слова "гiдроксид".
Приклад: LiOH – лiтiй гiдроксид; Ca(OH)2 – кальцій дигідроксид;
KOH – калiй гiдроксид; Sr(OH)2 – стронцій дигідроксид;
CsOH – цезій гідроксид; Ba(OH)2 – барій дигідроксид.
Якщо у складі сполуки, крім гідроксид-іонів є ще й оксид-іони, то в назві перелічують обидва аніони з відповідними числовими префіксами.
Наприклад: CrO(OH) – хром(Ш) гідроксид оксид;
Fe3O2(OH)5 – триферум пентагідроксид діоксид.
Кислоти – складні речовини, які у водних розчинах дисоціюють з утворенням катіонів Гідрогену H+ і ніяких інших позитивно заряджених йонів не утворюють. Кислоти класифікуються на:

Основність кислот визначається числом атомів Гідроґену, здатних заміщуватися атомами металу з утворенням солі. Розрізняють (рисунок 5.1):
- одноосновні кислоти – HCl, CH3COOH, H3PO2 або H(H2PO2);
- двохосновні кислоти – H2SO4, H2S, H3PO4;
- трьохосновні кислоти – H3PO4.
Атоми Гідрогену, які у кисневмісних кислот з’єднані безпосередньо з центральним атомом, а не через атом Оксигену, на атоми металів під час реакції не заміщуються.
Номенклатура кислот
Кислоти мають назви двох типів – тривіальні (традиційні) і хімічні (систематичні, раціональні). Перші вживаються у промисловості, сільському господарстві, торгівельній мережі, в побуті (наприклад, H2SO4 – сірчана кислота, HNO3 – азотна кислота, H3PO4 – ортофосфорна кислота, HCl – соляна кислота), другі – здебільшого в науковій і навчальній літературі. Проте чіткого розподілу сфер їх вживання немає.
Назва кислот за систематичною номенклатурою. Систематичнi назви складаються з двох слiв. Перше слово вiдображає наявнiсть атомiв Гiдроґену. Кислотнi атоми Гiдроґену називають "гiдроґен або водень". Якщо необхiдно, то застосовують числовi множники: моно-, ди-(ді-), три- , тетра- , пента i т.д. Друге слово – це назва анiона.

а – одноосновні кислоти; б – двохосновні кислоти; в – трьохосновна кислота H3PO4
Рисунок 5.1 – Стуктурні формули одно-, двох- та трьохосновних кислот
Назви одноелементних анiонiв складаються з коренiв латинських назв елементiв (iнодi скорочених) із суфiксом -ид (-ід) та групової назви "iон", що пишеться через дефiс. Наприклад: H+ –гiдрид-iон;
F– –флуорид-iон.
Назва складних Оксиґенвмісних аніонів будується наступним чином:
- називається грецькою індекс біля атому Оксигену (ди-, три-, тера- і т.д.);
- Оксиген називається оксо;
- до кореня латинської назви центрального атома додається суфiкс -ат;
- число Штока або число Еванса–Бассета (називається або пишеться в дужках, iнодi замiсть них використовують числовi множники перед атомом Гiдроґену).
Наприклад,

Також, цій сполуці можна дати назви гідроген тетраоксоманґанат(VI); гiдроґен тетраоксоманґанат(2–); дигiдроґен тетраоксоманґанат; .
Оскiльки гiдроґен-катiон вказує на належнiсть сполуки до кислот, то систематичну назву кислот можна будувати, використовуючи назву анiона замiсть прикметника, додаючи до нього iменник "кислота".
Наприклад: H2SO4 – сульфатна(VI) кислота;
H6TeO6 – гексаоксотелуратна(VI) кислота;
HNO3 – нiтратна(V) кислота;
H3PO4 – фосфатна(V) кислота.
Якщо кислотний гiдроксид (кислота) мiстить центральний атом елемента в найвищому ступенi окиснення, що доpівнює номеpу гpупи в періодичній таблиці, то число Штока i число атомiв Оксиґену можна не вказувати.
Наприклад: H2SO4 – сульфатна кислота;
H2SeO4 – селенатна кислота;
HNO3 – нiтратна кислота;
H2CrO4 – хроматна кислота;
H3PO4 – фосфатна кислота.
Для найпоширенiших у вживанні кислот, що мiстять центральний атом у нижчому, нiж максимальний, ступенi окиснення дозволяється залишити тривіальні назви із суфіксом -ит (-іт).
Наприклад: НNO2 – нiтритна кислота; НClO – гiпохлоритна кислота;
НClO2 – хлоритна кислота; НIO – гiпоіодитна кислота;
Н2SO3 – сульфітна кислота; НBrO – гiпобромiтна кислота.
Амфотерні гідроксиди.
За своїм складом амфотернi гiдроксиди не вiдрiзняються від основних гiдроксидiв. Тому номенклатура амфотерних гiдроксидiв аналогiчна номенклатурi основних гiдроксидiв, тобто систематичні назви амфотерних гідроксидів, як і основних, складають аналогічно назвам оксидів: з назви елементів (у разі необхідності зазначають його ступінь окиснення) і слова гідроксид (це – назва аніона OH–).
Наприклад: Cr(OH)3 – хром(III) гідроксид; хром тригідроксид;
Al(OH)3 – алюміній(III) гідроксид; алюміній тригідроксид.
Солі – складні речовини, що у водних розчинах дисоціюють на катіони металів (або амонію NH4+) та аніони кислотних залишків.

У середнiй солi залишком основи є катiон металу, а кислотний залишок не мiстить атомiв Гiдроґену.
При дисоцiацiї середнi солi утворюють лише катiони металу чи металоподiбних груп атомiв та анioни – кислотнi залишки. Наприклад:
Na2SO4 → 2Na+ + SO42–; (NH4)2SO4 → 2NH4+ + SO42–
Номенклатура середніх солей
Назви солей легко утворюються з назв катіонів і аніонів, застосовуючи числовi множники, число Штока або число Еванса–Бассета.
Наприклад: Hg2CrO4 – димеpкуpій хpомат(VI); димеpкуpій(I) хpомат(VI); димеркурій(2+) хромат(VI);
Al2(SO4)3 – діалюмiнiй трисульфат(VI); алюмiнiй(III) сульфат(VI); алюмiнiй(3+) сульфат(VI).
Але солi можна називати i неповнiстю. Такi назви дозволяються у тих випадках, коли катiон має сталий ступінь окиснення.
Наприклад: Na3PO4 – натрiй фосфат(V); Ca(NO3)2 – кальцiй нiтрат(V), кальцій динітрат; K2CO3 – калiй карбонат; K2SiO3 – калiй силікат.
Кислі солі – це продукти неповного замiщення атомiв Гiдроґену, якi визначають основнiсть кислотних гiдроксидiв, на метал або металоподiбнi групи атомів. Кислі солі – це солi, якi у водному pозчині при дисоціації утворюють катiони металу i гiдроґену(1+) та анiони кислотного залишку. Кислі солі утворюють лише багатоосновнi кислоти.
Наприклад: H3PO4 → NaH2PO4; H3PO4 → K2HPO4
H2SO4 → KHSO4; H2SO4 → (NH4)HSO4
Номенклатура кислих солей
Кислі солi багатоосновних кислот називаються так, як i середнi, але з додаванням до назви анiона слова "гiдроґен", якщо треба, то з числовими множниками. Наприклад: NaHSO4 – натрiй гiдроґенсульфат(VI);
Ba(HSO3)2 – барiй гiдроґенсульфат(IV);
(NH4)2HPO4 – діамоній гiдроґенфосфат(V).
Основнi солi розглядають як продукти неповного замiщення гідроксид-iонiв основних або амфотерних гiдроксидiв на залишки кислотних гiдроксидiв (кислот). В основних солях атом металу pазом зі зв'язаною з ним гідpоксогpупою утвоpює складний катіон, який вказується в їх фоpмулах.
Наприклад: (CuOH)2CO3, (MgOH)2CO3 замість Cu2(OH)2CO3 чи Mg2(OH)2CO3, або (AlOH)SO4, [Al(OH)2]2SO4 замість Al2(OH)4SO4.
Основнi солi утворюють лише багатокислотнi гiдроксиди. Основні солі мiстять катiони металу i анiони кислотного залишку та гiдроксо- або оксо-групи. Тому основнi солi є гiдроксидо- та оксидосолi. Наприклад: Al(OH)2NO3, Cr(OH)SO4 – гідроксидосолі; SbONO3, BiONO3 – оксидосолі.
Номенклатура основних солей
Основнi солi (гiдроксидо- та оксидосолі) можна називати як подвiйнi солi, вважаючи ОН– та О2– за гетероанiони. Аніони перелічуються в алфавітному порядку. Приклад: Fe(OH)SO4 – феpум(III) гiдроксид сульфат(VI);
Al(OH)SO4 – алюмiнiй гiдроксид сульфат(VI);
Bi(NO3)O – бiсмут(III) нiтрат(V) оксид;
Sb(NO3)O – стибiй(III) нiтрат(V) оксид;
SbOBr – стибiй(III) бромiд оксид;
(CuOH)2CO3, Cu2CO3(OH)2 – дикупрум(II) дигiдроксид карбонат;
CaCl(OH) – кальцій гідроксид хлорид.
Подвiйними солями називаються такi солi, якi утворенi кiлькома рiзними катiонами i одним i тим же анiоном (кислотним залишком). Наприклад: KAl(SO4)2, (NH4)Fe(SO4)2, KNa2PO4 тощо.
Отже, подвiйнi солi – це продукти замiщення атомiв Гiдроґену в молекулах кислот на атоми двох чи кiлькох металiв або металоподібних груп атомiв. Утворення подвiйних солей характерне для багатоосновних кислот та деяких металiв (приклад: Al, Cr, Fe, V тощо ).
Подвiйнi солi у водних розчинах дисоцiюють з утворенням двох видiв катiонiв i одного анiона, тобто тих йoнiв, якi є у кристалiчнiй структурi солi, i є сильними електролiтами. Приклад: NH4Fe(SO4)2 → NH4+ + Fe3+ + 2SO42–
KAl(SO4)2 → K+ + Al3+ + 2SO42–
KNa2PO4 → K+ + 2Na+ + PO43–
Номенклатура подвійних солей.
У назві подвiйних солей катiони перераховуються в алфавітному порядку (порядок назви солi може вiдрiзнятися вiд порядку запису формули).
Наприклад: KAl(SO4)2 – алюмiнiй калiй дисульфат(VI);
NH4Fe(SO4)2 – амонiй феpум(III) дисульфат(VI);
K2NaPO4 – дикалiй натрiй фосфат(V);
LiNaKPO4 – калiй лiтiй натрiй фосфат(V);
NaNH4KPO4 – амонiй калій натрiй фосфат(V);
KCr(SO4)2 – калiй хром(III) дисульфат(VI).
Змішані солі – солі, до складу яких входить один катiон металу або одна металоподiбна група атомiв, але два рiзних анiони, називаються змiшаними.
Наприклад: Al(NO3)SO4, Cr(NO3)SO4.
Такi солi при дисоцiацiї у водних розчинах утворюють один вид катiонiв i два види анiонiв. Наприклад:
Al(NO3)SO4 → Al3+ + NO3– + SO42–
Fe(NO3)SO4 → Fe3+ + NO3– + SO42–
Cr(NO3)SO4 → Cr3+ + NO3– + SO42–
AlClSO4 → Al3+ + Cl– + SO42–
Змiшанi солi розчиняються у водi i є сильними електролiтами. Такi солi утворюють лише багатокислотнi основнi або амфотернi гiдроксиди.
Формули змiшаних солей записуються i читаються в алфавітному порядку. Приклад:
Al(NO3)SO4 – алюмiнiй нiтрат(V) сульфат(VI);
Bi(NO3)SO4 – бiсмут(III) нiтрат(V) сульфат(VI);
Cr(NO3)SO4 – хром(III) нітрат(V) сульфат(VI);
Fe(ClO4)SO4 – феpум(III) сульфат(VI) хлорат(VII).
Назва оксиду, гідроксиду, солі вживається як цілісне словосполучення; відміняється лише друге слово (назва аніона): взяли порцію речовини калій хлориду (а не порцію речовини калію хлориду); змішали з барій оксидом (а не з барію оксидом); йони в калій гідроксиді (а не в калію гідроксиді).
Контрольні питання
- Який документ регламентує назви хімічних елементів та їх сполук?
- Назвіть основні форми існування хімічного елементу.
- Основні класи неорганічних сполук та їх визначення.
- Дайте назву оксидам Fe2O3, PbO, NO2 за допомогою числових множників, числа Штока та числа Еванса-Бассета.
- Дайте визначення поняттям кислотність основ та основність кислот.
- Дайте назву кислотам H2CrO4, H2SO3, H2S, використовуючи числові множники, числа Штока та Еванса-бассета. Для яких кислот широко вживаються традиційні назви?
- Як будуються назви основ?
- Солі та їх класифікація.
- Номенклатура кислих, середніх та основних солей. Поясніть на прикладі SbOBr, (CuOH)2CO3, Na3PO2, Mg(HCO3)2.
- Подвійні та змішані солі: визначення та номенклатура (проілюструйте на прикладі).