8 ТЕОРІЯ ОКИСНЮВАЛЬНО-ВІДНОВНІХ ПРОЦЕСІВ
План
8.1 Ступінь окиснення елементів.
8.2 Основні поняття: окисник, відновник, окиснення, відновлення. Активні окисники і відновники.
8.3 Типи окисно-відновних реакцій.
8.4 Методики складання рівнянь окисно-відновних реакцій. Еквіваленти речовин.
8.5 Гальванічні елементи. Електрохімічний ряд напруг металів. Стандартні потенціали окисників і відновників.
8.6 Суть процесу електролізу. Закони М.Фарадея.
8.7 Електроліз розплавів та водних розчинів електролітів.
Практичне значення електролізу.
8.1 Ступінь окиснення елементів
Ступінь окиснення – це умовний заряд атома, якого він набуває, якщо віддає або приєднує електрони, розрахований виходячи з припущення, що сполука складається iз йонів і в цілому є електронейтральною.
Для знаходження ступеня окислення користуються наступними правилами :
1. Ступінь окиснення елементів в простих речовинах дорівнює нулю.
2. Ступінь окиснення Гідрогену дорівнює +1, за винятком гідридів – -1, наприклад : NaH.
3. Ступінь окиснення Оксигену дорівнює -2, за винятком пероксидів – Н2О2 (ст. ок. = -1); надпероксидів – KO2 (ст. ок. = -1/2); озонідів – KO3 (ст. ок. = -І/3); дифториду Оксигену – OF2 (ст. ок. = +2).
4. Ступінь окиснення лужних металів завжди дорівнює +1, лужноземельних +2.
Існують елементи для яких характерний тільки один ступінь окиснення. Але в більшості випадків елементи мають декілька ступенів окиснення. Так наприклад, ступінь окиснення Мангану в сполуках дорівнює: ![]() ,
, ![]() ,
, ![]()
![]() .
.
У багатьох випадках значення ступеня окиснення елемента не співпадає з числом утворених зв'язків. Наприклад:
![]()
![]()
![]()
![]() ,
, ![]() ,
, ![]() ,
, ![]() ,
, ![]()
Визначити ступінь окиснення можна за номером групи періодичної системи хімічних елементів, в якій знаходиться елемент.
Вищий ступінь окиснення, відповідає номеру групи. Наприклад: ![]() ,
, ![]() ,
, ![]()
![]() та ін.
та ін.
Винятком є F, O, Не, Nе, Аг, Fе, Со, Ni, вищий ступінь окиснення яких нижчий, ніж відповідний номер групи. Елементи Сu, Аg, Аu мають вищий ступінь окиснення +3, хоча вони належать до першої групи. Наприклад: ![]() ,
, ![]() ,
, ![]() .
.
Нижчий ступінь окиснення елемента визначається за різницею номера групи, в якій знаходиться елемент і восьми. Наприклад, Нітроген має мінімальний ступінь окиснення –3 (5 – 8 = -3).
Нижчий ступінь окиснення визначає відновні властивості елемента, вищий – окиснювальні, а проміжний характеризує двоїсту природу елемента.
Ступінь окиснення одного з елементів можна визначити за ступенем окиснення інших елементів, виходячи з того, що молекула в цілому є електронейтральною: ![]()
![]()
![]()
8.2 Основні поняття: окисник, відновник, окиснення, відновлення. Активні окисники і відновники
Зміна ступеня окиснення елементу пов’язана зі зміною електронної структури частинок: віддачею або приєднанням електронів.
Процес віддачи електронів супроводжується підвищенням ступеня окиснення і називається окисненням.
Процес приєднання електронів супроводжується зниженням ступеня окиснення і називається відновленням.
Реакції, які супроводжуються зміною ступенів окиснення елементів називаються окисно-відновними (редокс-реакціями). Під час цих реакцій відбуваються два процеси: окиснення і відновлення.
Частинки, які приєднують електрони – окисники (акцептори електронів); частинки, які віддають електрони – відновники (донори електронів). Таким чином, у цьому випадку має місце окисно-відновна рівновага:
Ох1+ Red2![]() Ox2 + Red1
Ox2 + Red1
Для реакції: CuSO4 + Fe![]() FeSO4 + Cu
FeSO4 + Cu
Cu2+ + 2![]()
![]() Cu° – процес відновлення
Cu° – процес відновлення
окисник
Fe° – 2![]()
![]() Fe2+ – процес окиснення
Fe2+ – процес окиснення
відновник
або сумарне рівняння Cu2+ + Fe°![]() Fe2+ + Cu°
Fe2+ + Cu°
Великий вклад у розвиток теорії окисно-відновних процесів внесли Л.В. Писаржевський, Я.Л. Михайленко, М.О. Шилов, Г.В. та ін.
Всі речовини за їх здатністю до окиснення чи відновлення поділяються на три групи:
І – безумовні окисники – речовини, які можуть тільки відновлюватися (приймати електрони). До них належать прості речовини, утворені елементами, що характеризуються великими значеннями електронегативності, наприклад: F2, O2, Cl2. Складні речовини є безумовними окисниками тільки тоді, коли до їх складу входить елемент з вищим ступенем окиснення (![]() ,
, ![]() ). Складні йони (аніони), що містять елементи з вищим або високим ступенем окиснення: MnO42–, Cr2O72–, SO42– та ін., в залежності від рН середовища можуть відновлюватись за наступними схемами рівнянь:
). Складні йони (аніони), що містять елементи з вищим або високим ступенем окиснення: MnO42–, Cr2O72–, SO42– та ін., в залежності від рН середовища можуть відновлюватись за наступними схемами рівнянь:
MnO4– + 8H+ +5![]()
![]() Mn2+ + 4Н2О (рН<7)
Mn2+ + 4Н2О (рН<7)
MnO42– + 2H2O +3![]()
![]() MnO2 + 4OH– (рН≅7)
MnO2 + 4OH– (рН≅7)
MnO42–+ 1![]()
![]() MnO42– (рН>7)
MnO42– (рН>7)
Cr2O72–+ 14H+ + 6![]()
![]() 2Cr3+ + 7H2O (рН<7)
2Cr3+ + 7H2O (рН<7)
Cr2O72–+ 7H2O + 6![]()
![]() 2Cr(OH)3 + 8OH– (рН≅7)
2Cr(OH)3 + 8OH– (рН≅7)
Залежно від концентрації кислоти-окисника і сили відновника, процес відновлення SO42– може відбуватися за схемою:
SО42–→ SO2 → S → H2S
![]()
концентрація Н2 SO4 знижується
Наприклад, SO42–+ 4H+ + 2![]()
![]() SO2 + 2H2O
SO2 + 2H2O
SO42–+ 8H+ + 6![]()
![]() S + 4H2O
S + 4H2O
ІІ – безумовні відновники – речовини, здатні віддавати електрони. Це можуть бути прості речовини – метали (найбільш активні лужні та лужно-земельні), та неметали – водень і вуглець; складні сполуки, що містять елементи з мінімальним ступенем окиснення (NH3, H2S, KJ, CO, NH3, As2S3); прості йони (катіони) з нижчим ступенем окиснення елементів: Fe2+, Cu+, Sn2+, Cr![]() ,Ті2+; прості аніони з нижчим ступенем окиснення елементів: J
,Ті2+; прості аніони з нижчим ступенем окиснення елементів: J![]() > Br
> Br![]() > Cl
> Cl![]() , S
, S![]() , N3
, N3![]() (нітридний Нітроген).
(нітридний Нітроген).
Деякі схеми окиснення відновників:
H2S – 2![]()
![]() S + 2Н+
S + 2Н+
H2S + 4H2O – 8![]()
![]() SO
SO![]() +10H+
+10H+
Sn2+-2![]()
![]() Sn+4
Sn+4
Cr3+ + 8OH![]() – З
– З![]()
![]() CrO
CrO![]() + 4H2O
+ 4H2O
ІІІ – сполуки, які можуть проявляти властивості як окисників, так і відновників залежно від умов.
Наприклад:
![]() – окисник, може тільки приймати електрони;
– окисник, може тільки приймати електрони;
![]() – відновник;
– відновник;
![]() – двоїста природа, може бути і окисником, і відновником:
– двоїста природа, може бути і окисником, і відновником:
2![]() + O2
+ O2 ![]() 2
2![]()
![]() + 2
+ 2![]()
![]() 3S° + 3H2О
3S° + 3H2О
8.3 Типи окисно-відновних реакцій
Розрізняють такі типи окисно-відновних реакцій:
а) міжмолекулярні реакції, які відбуваються між різними молекулами (найбільш широка група реакцій):
2![]() + C12°
+ C12°![]() 2
2![]()
б) внутрішньомолекулярні реакції, які відбуваються зі зміною ступеня окиснення різних атомів однієї й тієї ж молекули (переважно це реакції термічного розкладу речовин):
2![]()
![]() 2Hg0 + O20
2Hg0 + O20
![]()
![]()
![]() + N20 + 4H2O
+ N20 + 4H2O
Внутрішньомолекулярні реакції окиснення-відновлення, в ході яких відбувається вирівнювання ступеня окиснення одного й того ж елемента, є процесами контрдиспропорціонування (комутації):
![]()
в) реакції самоокиснення-самовідновлення (диспропорціонування) – перебігають з одночасним збільшенням і зменшенням ступеня окиснення одного й того ж елементу:
![]() +
+ ![]() + H2O →
+ H2O → ![]() +
+ ![]()
8.4 Методики складання рівнянь окисно-відновних реакцій. Еквіваленти речовин
Для розрахунку коефіцієнтів ОВР використовують два методи: метод електронного балансу та йонно-електронний. Обидва методи базуються на одних і тих же положеннях: в ОВР загальне число електронів, що віддає відновник, дорівнює загальному числу електронів, які приєднує окисник. Причому, трактування окисно-відновного процесу як простого переходу електронів – це лише зручний спосіб для написання рівняння реакції і підбору коефіцієнтів. Наприклад:
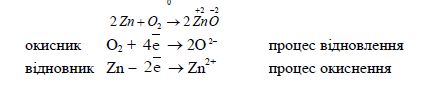
Чисто формальним є те, що Цинк втрачає два електрони, а Оксиген їх приєднує, тому що йонів О![]() взагалі бути не може у вільному вигляді, особливо поряд з катіонам. В дійсності зв'язок між Цинком і Оксигеном в молекулі ZnO – полярний, де
взагалі бути не може у вільному вигляді, особливо поряд з катіонам. В дійсності зв'язок між Цинком і Оксигеном в молекулі ZnO – полярний, де ![]() , що приблизно вдвічі менше за ступінь окиснення +2.
, що приблизно вдвічі менше за ступінь окиснення +2.
Метод електронного балансу ґрунтується на підрахунку числа приєднаних або втрачених електронів, проводиться виходячи із значень ступенів окиснення елементів до і після реакції.
Наприклад для реакції:
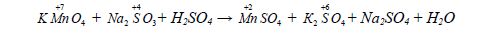
Ступінь окиснення змінюють тільки Манган і Сульфур.
Переходу Mn![]() → Mn
→ Mn![]() формально відповідає приєднання п'яти електронів, а переходу S
формально відповідає приєднання п'яти електронів, а переходу S![]() → S+6 – втрата двох електронів. Отже, KMnO4 – окисник, a Na2SO3 – відновник. Баланс "електронного обміну" такий:
→ S+6 – втрата двох електронів. Отже, KMnO4 – окисник, a Na2SO3 – відновник. Баланс "електронного обміну" такий:
2 | Mn![]() + 5
+ 5![]() → Mn
→ Mn![]()
5 | S![]() – 2
– 2![]() → S+6
→ S+6
![]()
2Mn![]() + 5S
+ 5S![]() → 2Mn
→ 2Mn![]() + 5S+6
+ 5S+6
Знайдені коефіцієнти (множники) переносять в рівняння реакції:
2KMnO4 + 5Na2SO3 + 3H2SO4 = 2MnSO4 + K2SO4 + 5Na2SO4 + 3H2O
Інші коефіцієнти знаходять за підрахунком балансу інших елементів: за SO![]() визначають число молекул сульфатної кислоти (три), а за балансом атомів Гідрогену визначають число молекул води (три).
визначають число молекул сульфатної кислоти (три), а за балансом атомів Гідрогену визначають число молекул води (три).
Розглянуті операції здійснюють без багаторазового переписування рівняння реакції,
Для спрощення можна також використати наступний спосіб підбору коефіцієнтів:
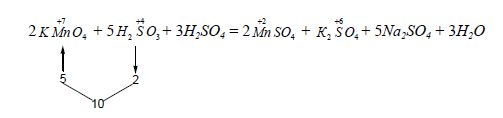
Йонно-електронний метод ґрунтується на складанні окремих рівнянь реакцій відновлення і окиснення (напівреакцій), які потім сумують в загальне рівняння. Дотримуються наступних правил:
1. Сильні електроліти записуються у вигляді йонів.
2. Неелектроліти, слабкі електроліти, гази і осади – у вигляді молекул.
3. Йони, які не змінюються в ході реакції, в йонну схему не включаються.
4. Напівреакція повинна бути урівняна за кількістю всіх атомів елементів, що приймають в ній участь. Для цього враховують наступне:
а) у кислому середовищі урівнювання Оксигену здійснюють шляхом додавання води в ту частину напівреакції, де Оксигену не вистачає, в кількості, що дорівнює його нестачі, а до протилежної частини додають Н![]() -йони , в кількості в два рази більшій, ніж добавленої води (2Н+→Н2О, або Н2О→2Н+). Наприклад:
-йони , в кількості в два рази більшій, ніж добавленої води (2Н+→Н2О, або Н2О→2Н+). Наприклад:
SO![]() + H2O – 2
+ H2O – 2![]() → SO
→ SO![]() + 2H
+ 2H![]()
SO![]() + 6H
+ 6H![]() + 4
+ 4![]() → S + 3H2O;
→ S + 3H2O;
б) у лужному середовищі урівнювання Оксигену здійснюють за допомогою гідроксидних груп ОН![]() і води. Якщо Оксигену не вистачає – додають ОН
і води. Якщо Оксигену не вистачає – додають ОН![]() -групи в кількості у два рази більшій, ніж не вистачає Оксигену, а в протилежній частині отримують воду (Н2О→2ОН
-групи в кількості у два рази більшій, ніж не вистачає Оксигену, а в протилежній частині отримують воду (Н2О→2ОН![]() , або 2ОН
, або 2ОН![]() →Н2О). Наприклад:
→Н2О). Наприклад:
MnO![]() + 2H2O + 3
+ 2H2O + 3![]() → MnO2 + 4OH
→ MnO2 + 4OH![]()
SO![]() + 2OH
+ 2OH![]() – 2
– 2![]() → SO
→ SO![]() + H2O
+ H2O
в) у нейтральному середовищі – у ліву частину напівреакції як на надлишок, так і на нестачу Оксигену додають тільки воду (Н2О → 2ОН![]() , або Н2О → 2Н+). Наприклад:
, або Н2О → 2Н+). Наприклад:
MnO![]() + 2H2O + 3
+ 2H2O + 3![]() → MnO2 + 4OH
→ MnO2 + 4OH![]()
Мn![]() + 2H2O – 2
+ 2H2O – 2![]() → MnO2 + 4H
→ MnO2 + 4H![]()
Реакції окиснення-відновлення, що відбуваються в кислому середовищі розглянемо на такому прикладі:
Молекулярна схема:
KMnO4 + Na2SO3 + H2SO4 = MnSO4 + K2SO4 + Na2SO4 + H2O
Йонна схема реакції:
MnO![]() +SO
+SO![]() + Н
+ Н![]() → Mn2+ + SO
→ Mn2+ + SO![]() + Н2О
+ Н2О
Напівреакції:
SO![]() – відновлена форма
– відновлена форма![]() SO
SO![]() – окисна форма
– окисна форма
MnO![]() – окисна форма
– окисна форма![]() Mn2+ – відновлена форма
Mn2+ – відновлена форма
Процес окиснення:
SO![]() → SO
→ SO![]()
1) урівнюють кількість атомів Сульфуру в лівій і правій частинах напівреакції (у даному випадку не потрібно);
2) урівнюють кількість атомів Оксигену (див. вище):
SO![]() + H2O → SO
+ H2O → SO![]() + 2H
+ 2H![]()
3) урівнюють заряд: для балансу зарядів в лівій частині рівняння необхідно відняти два електрони:
SO![]() + H2O – 2
+ H2O – 2![]() → SO
→ SO![]() + 2H
+ 2H![]()
Процес відновлення:
MnO![]() → Mn2+
→ Mn2+
1) урівнюють кількість атомів Мангану (у даному випадку не потрібно);
2) урівнюють кількість атомів Оксигену:
MnO![]() +8Н
+8Н![]() → Mn2+ + 4Н2О;
→ Mn2+ + 4Н2О;
3) урівнюють заряд: для балансу зарядів в лівій частині рівняння необхідно додати п'ять електронів:
MnO![]() +8Н
+8Н![]() + 5
+ 5![]() → Mn2+ + 4Н2О;
→ Mn2+ + 4Н2О;
4) складають обидві напівреакції, перемноживши їх на додаткові множники для балансу електронів:
2 | MnO![]() +8Н
+8Н![]() + 5
+ 5![]() → Mn2+ + 4Н2О
→ Mn2+ + 4Н2О
5 | SO![]() + H2O – 2
+ H2O – 2![]() → SO
→ SO![]() + 2H
+ 2H![]()
![]()
2MnO![]() +16Н
+16Н![]() +5SO
+5SO![]() + 5H2O
+ 5H2O ![]() 2Mn2+ + 8Н2О + 5SO
2Mn2+ + 8Н2О + 5SO![]() + 10H
+ 10H![]() .
.
Вірність розрахунку коефіцієнтів перевіряють за числом зарядів, яке повинно бути рівним у лівій і правій частинах рівняння (в даному випадку +6=+6);
5) скорочують однакові йони і молекули (у даному випадку Н+ і Н2О) у лівій і правій частинах рівняння і записують рівняння у молекулярному вигляді таким чином:
2KMnO4 + 5Na2SO3 + 3H2SO4 ![]() 2MnSO4 + 5Na2SO4 + K2SO4 + 3H2O
2MnSO4 + 5Na2SO4 + K2SO4 + 3H2O
На практиці користуються спрощеною схемою (без багаторазового переписування рівнянь напівреакцій).
Реакції окиснення-відновлення, які відбуваються в лужному середовищі розглянемо на такому прикладі:
Молекулярна схема:
MnSO4 + KСlO3+KOH → К2MnО4 + КСl + K2SO4 + Н2О
Йонна схема реакції:
Mn![]() + ClO
+ ClO![]() + OН
+ OН![]() → MnO
→ MnO![]() + Cl
+ Cl![]() + H2O
+ H2O
Процеси окиснення і відновлення складають окремо аналогічно попередньому прикладу, урівнюють кількість атомів Оксигену в лужному середовищі (див. вище). Сумують обидві напівреакції, перемножуючи їх на додаткові множники для балансу електронів і скорочуючи однакові йони та молекули в сумарному рівнянні:
3 | Mn![]() + 8OН
+ 8OН![]() – 4
– 4![]() → MnO
→ MnO![]() + 4H2O
+ 4H2O
2 | ClO![]() + 3H2O +6
+ 3H2O +6![]() → Cl
→ Cl![]() + 6OН
+ 6OН![]()
![]()
3Mn![]() + 2ClO
+ 2ClO![]() + 24OН
+ 24OН![]() + 6H2O → 3MnO
+ 6H2O → 3MnO![]() + 2Cl
+ 2Cl![]() + 12H2O + 12OН
+ 12H2O + 12OН![]()
Після скорочення:
3Mn![]() + 2ClO
+ 2ClO![]() + 12OН
+ 12OН![]() → 3MnO
→ 3MnO![]() + 2Cl
+ 2Cl![]() + 6H2O
+ 6H2O
Записують реакцію в молекулярному вигляді :
3MnSO4 +2 KСlO3+12KOH → 3К2MnО4 + 2КСl + 3K2SO4 + 6Н2О
Реакції окиснення-відновлення, які відбуваються в нейтральному середовищі розглянемо на прикладі:
Молекулярна схема:
KMnO4 + Na2SO3 + H2O → MnO2 + Na2SO4 + КОН
Йонна схема:
MnO![]() +SO
+SO![]() +Н2О → MnO2 + SO
+Н2О → MnO2 + SO![]() +ОН
+ОН![]()
Процеси окислення і відновлення складають аналогічно наведеним вище прикладам. При цьому враховують, що на кожний зайвий атом Оксигену приписують молекулу води, а вправу частину переносять два ОН![]() -йони. На кожний атом Оксигену, якого бракує – молекулу води, а в праву частину – два ОН
-йони. На кожний атом Оксигену, якого бракує – молекулу води, а в праву частину – два ОН![]() -йони.
-йони.
Сумують обидві напівреакції, перемножуючи їх на додаткові множники для балансу електронів і скорочуючи однакові йони та молекули в сумарному рівнянні:
2 | MnO![]() + 2H2O + 3
+ 2H2O + 3![]() → MnO2 + 4OH
→ MnO2 + 4OH![]()
3 | SO![]() + H2O – 2
+ H2O – 2![]() → SO
→ SO![]() + 2H
+ 2H![]()
![]()
2MnO![]() + 3SO
+ 3SO![]() + 7H2O → 2MnO2 + 3SO
+ 7H2O → 2MnO2 + 3SO![]() + 6H
+ 6H![]() + 8OH
+ 8OH![]()
Після скорочення:
2MnO![]() + 3SO
+ 3SO![]() H2O → 2MnO2 + 3SO
H2O → 2MnO2 + 3SO![]() + 2OH
+ 2OH![]()
Записують реакцію в молекулярному вигляді :
2KMnO4 + 3Na2SO3 + H2O → 2 ΜnΟ2 + 3Na2SO4 + 2КОН
Еквівалентні маси окисника і відновника обчислюють за формулою: me=М/n, де М – молекулярна маса; n – число прийнятих (відданих) електронів одним атомом, йоном або молекулою.
Для реакції:
2KMnO4 + 5Na2SO3 + 3H2SO4 ![]() 2MnSO4 + 5Na2SO4 + K2SO4 + 3H2O
2MnSO4 + 5Na2SO4 + K2SO4 + 3H2O
![]() =
= ![]() ;
; ![]() =
= ![]() .
.
8.5 Гальванічні елементи. Електрохімічний ряд напруг металів. Стандартні потенціали окисників і відновників
Окиснювально-відновні реакції кількісно характеризуються: константою хімічної рівноваги, зміною енергії Гіббса ![]() ,швидкістю, еквівалентами речовин, які беруть участь в реакції, а також величинами їх електродних (
,швидкістю, еквівалентами речовин, які беруть участь в реакції, а також величинами їх електродних (![]() ), або окислювально-відновних потенціалів (редокс-потенціалів) і електрорушійної сили (
), або окислювально-відновних потенціалів (редокс-потенціалів) і електрорушійної сили (![]() , В).
, В).
Якщо сила окисників і відновників, наприклад, неметалів, металів та їх солей в твердому вигляді визначається за величинами енергій спорідненості електрона до атому (окисник) і енергії йонізації (відновник), то для характеристики сили окисників і відновників у водних розчинах користуються величинами стандартних електродних потенціалів (для металічних пар, наприклад: ![]() = -0,76 В,
= -0,76 В, ![]() = +0,34 В та ін.), або стандартною величиною редокс-потенціала (окислювально-відновного потенціалу для інших окиснювально-відновних систем, наприклад,
= +0,34 В та ін.), або стандартною величиною редокс-потенціала (окислювально-відновного потенціалу для інших окиснювально-відновних систем, наприклад, ![]() = +0,77 В;
= +0,77 В; ![]() = +0,96 В;
= +0,96 В; ![]() = +1,61 В та ін.).
= +1,61 В та ін.).
Електродний потенціал – це різниця потенціалів, яка виникає на межі розділу фаз «метал-розчин» при занурені електроду (металічної пластини, дроту) в розчин електроліту, за рахунок утворення подвійного електричного шару.
На межі метал-розчин встановлюється рівновага:
Mе + mH2O → Mе![]() + n
+ n![]()
Для активних металів позитивні йони металів в гідратованому вигляді переходять в розчин, а пластинка заряджається негативно за рахунок надлишку електронів, спрощено:
Zn → Zn![]() + 2
+ 2![]()
Для неактивних металів (Cu, Ag, Hg та ін.): Cu![]() + 2
+ 2![]() → Cu0 йони металу (Cu
→ Cu0 йони металу (Cu![]() ) будуть розряджатися на мідній пластинці, забираючи з електроду електрони. Внаслідок цього Cu-електрод буде заряджатися позитивно. Негативно і позитивно заряджені електроди будуть притягувати з розчину протийони. Таким чином, утворюється подвійний електричний шар, який характеризує певну різницю потенціалів на межі "метал-розчин". Якщо з’єднати обидва електроди через гальванометр, то він зафіксує в системі електричний струм. Так утворюється гальванічний елемент:
) будуть розряджатися на мідній пластинці, забираючи з електроду електрони. Внаслідок цього Cu-електрод буде заряджатися позитивно. Негативно і позитивно заряджені електроди будуть притягувати з розчину протийони. Таким чином, утворюється подвійний електричний шар, який характеризує певну різницю потенціалів на межі "метал-розчин". Якщо з’єднати обидва електроди через гальванометр, то він зафіксує в системі електричний струм. Так утворюється гальванічний елемент:
Zn / Zn![]() //Cu
//Cu![]() / Cu0
/ Cu0
Цю різницю потенціалів безпосередньо виміряти неможливо. Тому її визначають непрямим шляхом відносно стандартних електродів, потенціал яких відомий (наприклад, водневого, каломельного, хлорсрібного та ін.). Водневий електрод (рисунок 8.1) – це платиновий дротик, на який нанесені дрібнодисперсні частинки Рt, занурений у водний розчин H2SO4 ([H+]=1моль/л), через який пропускають водень (cтандартні умови: Т=298К, Р=101кПа). Платинова пластинка активний поглинач водню, тому Pt-електрод поводить себе як водневий. Потенціал водневого електроду за стандартних умов ![]() = -0,059рН, тому якщо [H+] у водному розчині H2SO4 складає 1моль/л, то рН = 0 і
= -0,059рН, тому якщо [H+] у водному розчині H2SO4 складає 1моль/л, то рН = 0 і ![]() = 0; при рН = 7
= 0; при рН = 7 ![]() = -0,059·7 = -0,41 В.
= -0,059·7 = -0,41 В.
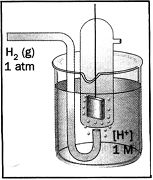
Рисунок 8.1 – Водневий електрод
Для вимірювання електродних потенціалів металів складають гальванічний елемент (ГЕ) із металічного електроду, наприклад, цинкового і водневого. В результаті чого відбуваються такі процеси:
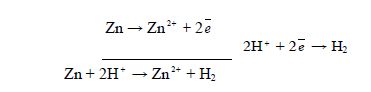
Вимірюють електрорушійну силу (Е.р.с.) цього ГЕ за допомогою гальванометра. У даному випадку Е.р.с = 0,76 В = ![]() :
:
![]()
Тому можна записати:
![]() =
=![]() –
–![]() =0,76 В, де
=0,76 В, де ![]() = 0 В;
= 0 В; ![]() = -0,76 В.
= -0,76 В.
Таким чином були встановлені стандартні електродні потенціали (СЕП), для інших металів, за якими складено електрохімічний ряд напруг (таблиця 8.2) :
Li K Ca Na Mg Αl Mn Zn Fe Ni Sn Pb H Cu Ag Au
СЕП враховують особливості взаємодії йонів металу із молекулами розчинника. Наприклад, йон Літію характеризується високим значенням енергії гідратації, в порівнянні з іншими металами, чим і пояснюється його місце в ряді напруг: ![]() = -3,05 В, тоді як для
= -3,05 В, тоді як для ![]() =-2,71 В.
=-2,71 В.
Цей ряд, який раніше називали витискувальним рядом М.М. Бекетова, характеризує активність металів як відновників (максимальна активність у літію та інших лужних металів, мінімальна – в кінці ряду – у Аргентуму, Ауруму), а також активність йонів металів як окисників (максимальна активність у Au![]() :
: ![]() =1,692 В, велика у Pt
=1,692 В, велика у Pt![]() :
: ![]() =1,188 B, Ag
=1,188 B, Ag![]() :
: ![]() = 0,8 В).
= 0,8 В).
Таким чином, ряд напруг характеризує хімічні властивості металів:
1. Чим більше негативне значення ![]() ,тим більша відновлювальна здатність металів і менша окиснювальна здатність їх йонів.
,тим більша відновлювальна здатність металів і менша окиснювальна здатність їх йонів.
2. Чим лівіше знаходиться метал в ряді напруг, тим він більш хімічно активний, і навпаки, чим правіше – тим менш активний.
3. Кожний метал ряду відновлює катіони всіх наступних за ним металів із розчинів їх солей:
![]() + Fe →
+ Fe → ![]() + Hg
+ Hg
4. Метали, що знаходяться лівіше Гідрогену, відновлюють його із розбавлених кислот (крім HNO3), а Мg і метали, що знаходяться лівіше від нього витісняють Гідроген із води (за звичайних умов). Метали, які розмішені правіше Гідрогену, не витісняють його із кислот.
Отже, за алгебраїчним значенням стандартного електродного (редокс- потенціалу) можна встановити напрямок окисно-відновної реакції. Для цього потрібно порівняти значення стандартних ![]() , знайти окиснювач (той, якому відповідає більший
, знайти окиснювач (той, якому відповідає більший ![]() ) і відновник (з меншим значенням
) і відновник (з меншим значенням ![]() ), величина
), величина ![]() повинна мати позитивне значення (
повинна мати позитивне значення (![]() >0).
>0).
Наприклад, реакція Cu0 + Zn![]() → Cu
→ Cu![]() + Zn буде відбуватися в зворотному напрямку, тому що
+ Zn буде відбуватися в зворотному напрямку, тому що ![]() = -0,76 В а
= -0,76 В а ![]() =+0,34 В. Тобто Cu
=+0,34 В. Тобто Cu![]() – окисник, а Zn – відновник. Дійсно
– окисник, а Zn – відновник. Дійсно ![]() > 0:
> 0: ![]() = 0,34 – (-0,76) = +1,1 В.
= 0,34 – (-0,76) = +1,1 В.
Якщо умови реакції відрізняються від стандартних, Е знаходять за рівнянням Нернста
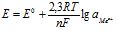 , (8.1)
, (8.1)
де ![]() – стандартний електродний потенціал, В; R – універсальна газова стала; Т – абсолютна температура, К; n – число електронів, які віддає відновник або приймає окисник; F – число Фарадея.
– стандартний електродний потенціал, В; R – універсальна газова стала; Т – абсолютна температура, К; n – число електронів, які віддає відновник або приймає окисник; F – число Фарадея.
Врахувавши, що ![]() :
:
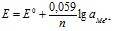 або
або 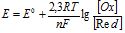 (8.2)
(8.2)
Е.Р.С. (![]() ) зв’язана з енергію Гіббса:
) зв’язана з енергію Гіббса: ![]() але:
але: ![]() , де К – константа хімічної рівноваги, тому
, де К – константа хімічної рівноваги, тому
![]() (8.3)
(8.3)
оскільки ![]() , то
, то
![]() (8.4)
(8.4)
За величиною К можна також встановити напрямок ОВР
K > 104 – реакція відбувається необоротно;
K = 103…10-3 – оборотні реакції;
K > – можуть відбуватися за умови надлишку реактиву;
К < – реакції не відбуваються.
Таким чином напрямок ОВР можна встановити за величиною ![]() ,
, ![]() , К (lgK): реакція відбувається в заданому напрямку якщо:
, К (lgK): реакція відбувається в заданому напрямку якщо:
1) ![]() < 0
< 0
2) ![]() > 0
> 0
3) К > 1; lgK > 0.
Величина ![]() залежить від значення pH розчину (концентрації
залежить від значення pH розчину (концентрації
Н![]() -йонів). Наприклад, для реакції
-йонів). Наприклад, для реакції
MnO4- + 8H++![]() = Mn2+ + 4H2O
= Mn2+ + 4H2O
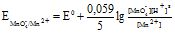
Враховуючи величину pH визначають К: ![]() , в даному випадку Z = 8 (8H
, в даному випадку Z = 8 (8H![]() ).
).
Для реакції Red = Ox + – n![]() + zH
+ zH![]() (йони Гідрогену в правій частинні рівняння):
(йони Гідрогену в правій частинні рівняння): ![]() .
.
Величина Е залежить також від Т за рівнянням Нернста-Петерса:
![]() . (8.5).
. (8.5).
Таблиця 8.2 – Стандартні потенціали
|
Електрод |
Електрична реакція |
Ео, В |
|
Стандартні електродні потенціали металів |
||
|
Li+ / Li |
Li+ + e = Li |
- 3,045 |
|
K+ / K |
K+ + e = K |
- 2,925 |
|
Ba2+ / Ba |
Ba2+ + 2e = Ba |
- 2,906 |
|
Ca2+ / Ca |
Ca2+ + 2e = Ca |
- 2,866 |
|
Mg2+ / Mg |
Mg2+ + 2e = Mg |
- 2,363 |
|
Al3+ / Al |
Al3+ + 3e = Al |
- 1,662 |
|
Ti2+ / Ti |
Ti2+ + 2e = Ti |
- 1,628 |
|
Mn2+ / Mn |
Mn2+ + 2e = Mn |
- 1,180 |
|
Cr2+ / Cr |
Cr2+ + 2e = Cr |
- 0,913 |
|
Zn2+ / Zn |
Zn2+ + 2e = Zn |
- 0,763 |
|
Cr3+ / Cr |
Cr3+ + 3e = Cr |
- 0,744 |
|
S0 / S |
S0 + 2e = S2- |
- 0,510 |
|
Fe 2+ / Fe |
Fe2+ + 2e = Fe |
- 0,440 |
|
Sn2+ / Sn |
Sn2+ + 2e = Sn |
- 0,136 |
|
Pb2+ / Pb |
Pb2+ + 2e = Pb |
- 0,126 |
|
Fe3+ / Fe |
Fe3+ + 3e = Fe |
- 0,036 |
|
H+ / H2 |
H+ + e = ½ H2 |
0,000 |
|
Cu2+ / Cu |
Cu2+ + 2e = Cu |
+ 0,337 |
|
Ag+ / Ag |
Ag+ + e = Ag |
+ 0,799 |
|
Hg2+ / Hg |
Hg2+ + 2e = Hg |
+ 0,854 |
|
Br2 / Br- |
½ Br2 + e = Br- |
+ 1,065 |
|
Cl2 / Cl- |
½ Cl2 + e = Cl- |
+ 1,359 |
|
Стандартні окисно-відновні потенціали |
||
|
Cr3+ / Cr2+ |
Cr3+ + e = Cr2+ |
- 0,408 |
|
Sn4+ / Sn2+ |
Sn4+ + 2e = Sn2+ |
+ 0,150 |
|
SO42- / H2S |
SO42- + 10H+ + 8e = H2Saq + 4H2O |
+ 0,303 |
|
Fe3+ / Fe2+ |
Fe3+ + e = Fe2+ |
+ 0,771 |
|
NO3- / NO2- |
NO3- + 2H+ + 2e = NO2- + H2O |
+ 0,940 |
|
Cr2O72- / Cr3+ |
Cr2O72- + 14H+ + 6e = 2Cr3+ + 7H2O |
+ 1,330 |
|
PbO2 / Pb2+ |
PbO2 + 4H+ + 2e = Pb2+ + 2H2O |
+ 1,455 |
|
MnO4- / Mn2+ |
MnO4- + 8H+ + 5e = Mn2+ + 4H2O |
+ 1,510 |
|
PbO2 / PbSO4 |
PbO2 + 4H+ +SO42- + 2e = PbSO4 + H2O |
+ 1,640 |
|
H2O2 / H2O |
H2O2 + 2H+ + 2e = 2H2O |
+ 1,776 |
|
S2O82- / SO42- |
S2O82- + 2e = 2SO22- |
+ 2,010 |
Гальванічні елементи (ГЕ) – хімічні джерела електричної енергії. ГЕ є незворотним джерелом одноразової дії. Гальванічний елемент працює доти, доки не витратиться один з електродів. В ГЕ завжди розчиняється найбільш активний метал. Згідно схемі ГЕ, наприклад, Cu–Zn (рисунок 8.2) в ньому відбуваються такі процеси: К(+) Cu2+ +2![]() → Cu2+ 2
→ Cu2+ 2
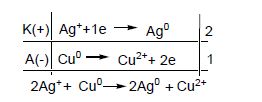
Електрони прямують з мідного електроду до срібного. Електрод на якому перебігає процес окиснення (Zn0 → Zn2+, процес окиснення) буде анодом, електрод на якому відбувається процес відновлення (Cu2+ → Cu0, процес відновлення) – катодом. В гальванічному елементі анод заряджений від’ємно, катод – позитивно.
Е0=ΔЕ0ок.–ΔЕ0відн.=ΔЕ0кат.–ΔЕ0анод=![]() –
–![]() = 0,34 – (-0,76) = 1,1B.
= 0,34 – (-0,76) = 1,1B.
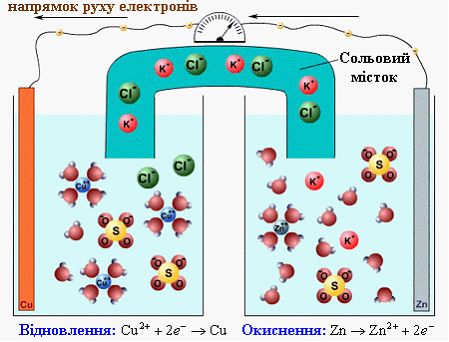
Рисунок 8.2 – Принципова схема гальванічного елементу
Перший ГЕ був запропонований італійським вченим Александро Вольта. Це цинкові і мідні пластини, між якими знаходиться сукно, зволожене сульфатною кислотою: Zn/H+/Cu . Тоді
- на цинковій пластині: Zn → Zn2++ 2
 ;
; - на мідній (інертний електрод в даному випадку): 2H++ 2
 → 2H2.
→ 2H2.
Сумарний процес: Zn + 2H+→ Zn2++ H2, ΔЕ0 = 0,76 В.
В техніці широко використовують сухі гальванічні елементи.
Наприклад:
ГЕ Лекланше (рисунок 8.3):
А(-) Zn/NH4Cl // MnO2/C K(+)
2Zn + 4NH4++ MnO2 → [Zn(NH3)4]2+ + Zn![]() + MnOOH + 3H+
+ MnOOH + 3H+
ΔЕ0 =1,5 В.
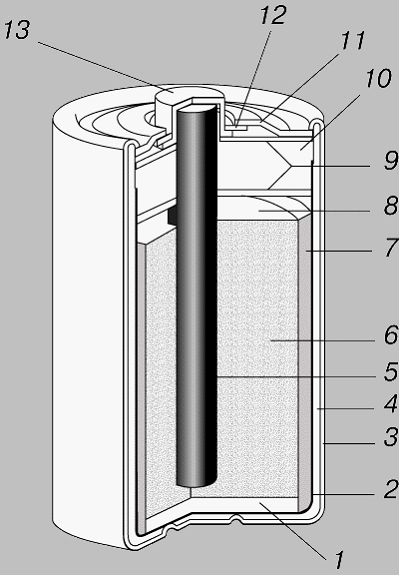
1 – ізолююча прокладка; 2 – безшовний цинковий стакан (від’ємний електрод); 3 – ізольована металева оболонка; 4 – пористий розділяючий стакан; 5 – графітовий стережень (позитивний електрод); 6 – деполяризуюча суміш; 7 – пастоподібний електроліт; 8 – простір для розширення; 9 – запресовані прокладки; 10 – полімерний герметик; 11 – металічна кришка; 12 – ізолююча прокладка; 13 – металевий ковпачок
Рисунок 8.3 – Гальванічні елементи Лекланше
ГЕ Грене:
3Zn + Cr2O72– + 14H+→ 3Zn2++ 2Cr3++ 7H2O.
ГЕ окиснортутний (рисунок 8.4):
HgO + Zn + 2KOH → Hg + K2ZnO2 +H2O
ГЕ срібно-магнієвий (може працювати за низьких температур):
2AgCl + Mg → 2Ag + MgCl2.
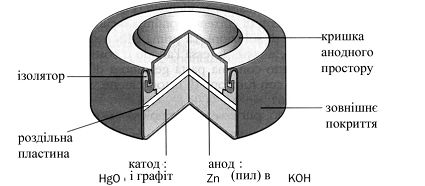
Рисунок 8.4 – Окиснортутний гальванічний елемент

Рисунок 8.5 – Кадмій-нікелеві акумулятори
Акумулятори – це оборотні джерела електричної енергії (багаторазової дії). Вони бувають:
– кислотними (свинцеві) ΔЕ0 =2,1 В: Pb + PbO2 +2H2SO4 ![]() 2PbSO4 + 2H2O;
2PbSO4 + 2H2O;
– кадмій-нікелеві (Юнгера) (рис. 8.5), електроліт – КОН:
2Ni(OH)3 + Cd ![]() 2Ni(OH)2 + Cd(OH)2;
2Ni(OH)2 + Cd(OH)2;
– срібно-цинкові: Ag2O + 2Zn +2H2O ![]() 2Ag + 2Zn(OH)2 та інші (нікель-цинкові, літій полімерні, літій-йонні).
2Ag + 2Zn(OH)2 та інші (нікель-цинкові, літій полімерні, літій-йонні).
8.6 Суть процесу електролізу. Закони М.Фарадея
Електролізом називається окисно-відновний процес, який відбувається на електродах під час пропускання постійного електричного струму через розплав або розчин електроліту.
Хімічні реакції на електродах здійснюються за рахунок електричної енергії. На катоді відбувається процес приєднання електронів (відновлення). На анноді – процес окиснення (рисунок 8.6).
На відміну від гальванічного елемента при електролізі катод – негативно заряджений електрод, а анод – позитивно.
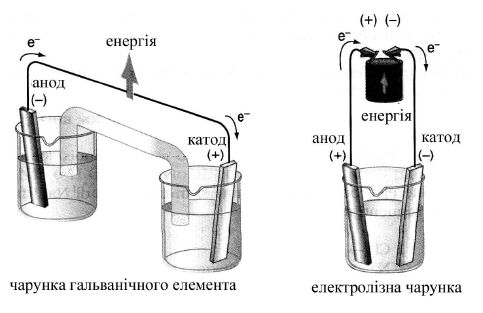
Рисунок 8.6 – Принципова відмінність між електролізом та гальванічним елементом
Окиснювально-відновна дія електричного струму сильніша дії хімічних окисників та відновників.
На характер і хід електродних процесів при електролізі впливають: склад електроліту, природа розчинника, матеріал електродів, режим електролізу (напруга, густина струму, температура та ін.).
Між кількістю речовини, що виділяється під час електролізу, і кількістю електричного струму, що проходить через електроліт, існує зв'язок, який відображається в двох законах М. Фарадея:
І закон: Кількість речовини, що виділяється на електродах під час електролізу, пропорційні кількості електрики, яка пройшла крізь електроліт.
ІІ закон: Однакова кількість електрики виділяє на електродах під час електролізу еквівалентну кількість різних речовин (рис. 8.7).
У такому формулюванні другий закон Фарадея є наслідком закону еквівалентів для електрохімічних реакцій. Математично закони виражають рівнянням:
ν = Є Q= Є Iτ (8.6)
де ν – кількість речовини (моль); Є – коефіцієнт пропорційності, названий електрохімічним еквівалентом; Q – кількість електрики, Кл; I – сила струму, A; τ – час електролізу, с.
Перейдемо від кількості речовин до їх мас, якщо Iτ = 1 Кл, то ν = Є. Оскільки ν = m/M, m = ЄМ. Електрохімічний еквівалент пов'язаний з хімічним відношенням: Є= Е/F. F, число Фарадея, є добутком числа Авагадро на заряд електрону: F=6,021023 1,6010-19 = 96 485 ≅ 96 500 Кл/моль або 26,8 А·год/моль. Е=me/M (див. розділ 1.1), тоді при Iτ = 1 Кл, маємо m=me/F або в інших випадках:
![]() , або
, або ![]() , (8.7)
, (8.7)
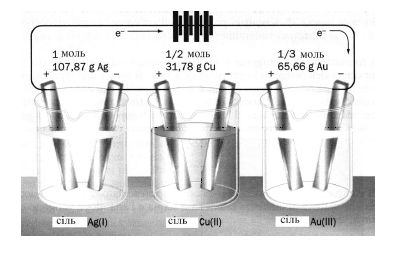
Рисунок 8.7 – Електрохімічний еквівалент речовин
На практиці під час проведення електролізу дійсні затрати струму Іпр, внаслідок побічних процесів (взаємодія утворених речовин з електродом або електролітом та ін.), звичайно перевищують теоретичне значення Ітеор, розраховане за законом Фарадея. Відношення маси речовини, одержаної практично (тпр) до теоретично розрахованої (ттеор), називається виходом за струмом (η):
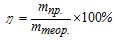 , або
, або 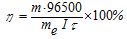 (8.10)
(8.10)
8.7 Електроліз розплавів та водних розчинів електролітів. Практичне значення електролізу
Розглянемо електроліз водного розчину натрій хлориду за наявності вугільних електродів.
В цьому розчині знаходяться Na+ і Cl– у вигляді гідратованих йонів, а також вільні молекули води. Якщо система, в якій проводять електроліз, містить різні окисники, то на катоді буде відновлюватися найбільш активний із них (в даному випадку H2O), або окиснена форма тієї електрохімічної системи (в даному випадку Na+), якій відповідає найбільше значення електродного потенціалу (за алгебраїчною величиною).
Порівняємо потенціали двох окиснених форм :
Na + 1![]() → Na+
→ Na+ ![]() = -2,71В
= -2,71В
2H2O + 2![]() → H2 + 2OH–
→ H2 + 2OH– ![]() = -0,81В
= -0,81В
-0,81В > -2,71В, значить на катоді будуть розряджатися молекули води, а не йони натрію: 2H2O + 2![]() → H2 + 2OH–
→ H2 + 2OH–
Аналогічно, за наявності в системі декількох відновників, на аноді буде окиснюватися найбільш активний з них, або відновлена форма тієї електрохімічної системи, яка характеризується найменшим значенням електродного потенціалу. Наприклад:
2Cl– → Cl2 + 2![]()
![]() = +1,36В
= +1,36В
2H2O → O2 + 4H++ 4![]()
![]() = +1,23В
= +1,23В
Отже, під час електролізу водних розчинів хлоридів можливий перебіг двох процесів на інертному аноді, так як вони мають близькі значення Е0. Однак, в даному випадку відбувається перший процес: 2Cl– → Cl2 + 2![]() , не дивлячись на те, що
, не дивлячись на те, що ![]() >
>![]() , так як це зумовлено гальмівною дією матеріалу анода на другий процес. Таким чином, під час електролізу водного розчину натрій хлориду на катоді виділяється водень, а на аноді – хлор, а в катодному просторі накопичується NaOH. Склавши рівняння двох електродних процесів, одержують загальне рівняння процесу електролізу водного розчину NaCl:
, так як це зумовлено гальмівною дією матеріалу анода на другий процес. Таким чином, під час електролізу водного розчину натрій хлориду на катоді виділяється водень, а на аноді – хлор, а в катодному просторі накопичується NaOH. Склавши рівняння двох електродних процесів, одержують загальне рівняння процесу електролізу водного розчину NaCl:
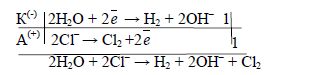
або в молекулярній формі:
2NaCl + 2H2O ![]() H2 + Cl2 + 2NaOH
H2 + Cl2 + 2NaOH
При складанні рівнянь електродних процесів, що перебігають під час електролізу на катоді або аноді можна користуватись наступними правилами:
Розряд катіонів на катоді:
- катіони металів від Li+ до Mg2+ включно у водному розчині не відновлюються (відновлюються молекули води за рівнянням
2Н2О + 2![]() → Н2 + 2ОН–);
→ Н2 + 2ОН–);
- катіони металів від Al3+ до Pb2+ відновлюються на катоді одночасно з молекулами води (питання дискусійне), тобто наряду з відновленням катіонів металу протікає відновлення молекул води;
- катіони металів від Cu2+ до Au3+ практично повністю відновлюються на катоді.
Якщо в розчині буде суміш катіонів Ag+, Cu2+, Fe2+ то, порівнявши їхні електродні потенціали:
Ag+ + ![]() → Ag
→ Ag ![]() = 0,8В
= 0,8В
Cu2+ + 2![]() → Cu
→ Cu ![]() = 0,34В
= 0,34В
Fe2+ + 2![]() → Fe
→ Fe ![]() = -0,44В
= -0,44В
робимо висновок про те, що першими будуть відновлюватися йони Ag+, потім Cu2+, а останнім Fe2+.
Характер реакцій, які відбуваються на аноді, залежить як від наявності молекул води, так і від природи анода. Розрізняють розчинні і нерозчинні аноди.
Розряд аніонів на аноді:
Нерозчинні аноди виготовлюють із вугілля, графіту, платини, при цьому електрони надсилаються в зовнішній ланцюг в результаті окиснення аніонів і молекул води, при цьому у водному розчині:
- аніони кисневмісних кислот SO
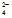 , NO
, NO , CO
, CO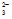 , PO
, PO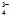 та ін. не окисyнюються, а окиснюються молекули води в нейтральному середовищі за рівнянням 2H2O → O2 + 4H+ + 4
та ін. не окисyнюються, а окиснюються молекули води в нейтральному середовищі за рівнянням 2H2O → O2 + 4H+ + 4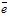 , в лужному середовищі за рівнянням:
, в лужному середовищі за рівнянням:
4ОН - → 2Н2О + O2 + 4![]() ;
;
- аніони безкисневих кислот Cl–, S2- тощо (при достатній концентрації) легко окислюються на аноді. Наприклад, 2Cl– → Cl2 + 2
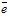 .
.
У випадку розчинного анода електрони в зовнішній ланцюг посилає сам анод (виготовляють із Cu, Ag, Zn, Co, Ni, Fe та ін.). Розчинні аноди використовуються у випадку очищення металів (рафінування міді), або нанесенні гальванічного покриття, наприклад для посріблення виробів (рисунок 8.8).
Приклад 1. Які процеси будуть відбуватися на електродах під час електролізу водного розчину CuCl2 з інертними вугільними електродами?
У водному розчині CuCl2 дисоціює на йони: CuCl2 → Cu2+ + 2Cl-
Стандартний електродний потенціал мідного електроду +0,34В, тому, йони Купруму будуть легко відновлюватись з водних розчинів. Йони Cl-, як і більшість безкисневих кислот, у водних розчинах окиснюються:
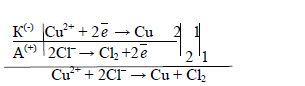
або у молекулярному вигляді: CuCl2 ![]() Cu + Cl2.
Cu + Cl2.
Приклад 2. Які процеси будуть відбуватися на електродах під час електролізу водного розчину CuSO4 з мідним анодом?
У водному розчині CuSO4 дисоціює на йони: CuSO4 → Cu2+ + SO![]() .
.
На катоді буде відбуватися відновлення катіонів Cu2+. А анодний процес, у випадку із мідним електродом, буде пов’язаний із окисненням матеріалу електрода (на цьому ґрунтується метод рафінування міді), кількість солі в розчині залишається незмінною. Електродні процеси можна зобразити так:
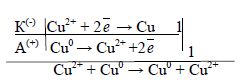
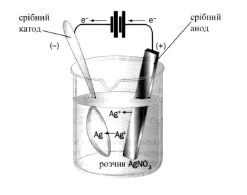
Рисунок 8.8 – Схема електролізу з розчинним анодом
Приклад 3. Які процеси будуть відбуватися на електродах під час електролізу водного розчину сульфату цинку з інертними електродами?
У водному розчині ZnSO4 дисоціює на йони: ZnSO4 → Zn2+ + SO![]() .
.
Під час електролізу поблизу катода будуть знаходитись катіони Zn2+ і вода. Стандартний електродний потенціал цинкового електроду дорівнює -0,76В, а ![]() = -0,81В. Значення електродних потенціалів цинку та води дуже близькі, тому на катоді будуть відбуватися паралельно два процеси: відновлення катіонів Zn2+ і води. Йони SO
= -0,81В. Значення електродних потенціалів цинку та води дуже близькі, тому на катоді будуть відбуватися паралельно два процеси: відновлення катіонів Zn2+ і води. Йони SO![]() будуть накопичуватись біля анода, але окиснюватись не будуть, окислюється на аноді вода, в результаті чого виділяється кисень:
будуть накопичуватись біля анода, але окиснюватись не будуть, окислюється на аноді вода, в результаті чого виділяється кисень:
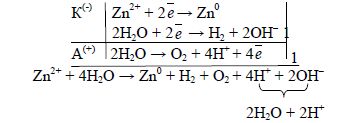
після скорочень: Zn2+ + 2Н2O → Zn0 + Н2 + О2 + 2Н+
або у молекулярному вигляді: ZnSO4 + 2H2O ![]() Zn0 + Н2 + O2 + H2SO4
Zn0 + Н2 + O2 + H2SO4
Приклад 4. Які процеси будуть відбуватися на електродах під час електролізу розплаву NаСl з інертним анодом?
В розплаві NаСl дисоціює на йони:
NаСl → 2Na+ + 2Cl-
В розплаві відсутні молекули води, тому відновлюються на катоді йони Натрію (лужні метали отримують електролізом розплавів їх солей). На аноді буде відбуватися процес окиснення хлорид-іонів:
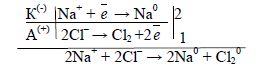
Якщо ж використати розчинний анод, наприклад, мідний, то в розплаві може відбуватися анодне розчинення металу.
За допомогою електролізу одержують багато цінних продуктів: активні метали (електролізом розплавів), їдкий натр, хлор, кисень, водень та ін.
Контрольні питання
- Дайте визначення поняттям "окисник", "відновник", "процес окиснення", "процес відновлення".
- Наведіть приклади типових окисників, відновників. Коли сполука може проявляти одночасно окисні і відновні властивості?
- Які рівняння називають окисно-відновними? Наведіть приклади основних типів окисно-відновних рівнянь?
- Які методи застосовують для урівнювання окисно-відновних рівнянь? Що ці методи мають спільного, а в чому їх відмінність?
- Дайте визначення поняття "електродний потенціал". Як буде заряджатися (позитивно чи негативно) пластина активного металу, занурена у розчин власної солі, пластина неактивного металу у розчині власної солі? Поясніть.
- Що називається ГЕ?Поясніть принцип роботи гальванічного елементу.
- В чому відмінність між гальванічним елементом та акумулятором? Які акумулятори набули сьогодні широкого вжитку
- Визначення електролізу. Закони М.Фарадея. Де застосовується електроліз?
- Складіть рівняння процесів, які протікають під час електролізу розчинів:
ZnSO4, KNO3, FeCl2 (електроди інертні), Cu(NO3)2 (анод мідний). - Чому алюміній витісняє мідь з розчину CuCl2, але не витісняє її з розчину CuSO4?