9 КОМПЛЕКСНІ СПОЛУКИ
План
9.1 Координаційна теорія Альфреда Вернера. Класифікація комплексів і лігандів.
9.2 Номенклатура комплексних сполук і їх основні типии.
9.3 Рівновага в розчинах комплексних сполук.
9.4 Сучасні теорії комплексних сполук і їх практичне значення.
9.1 Координаційна теорія Альфреда Вернера. Класифікація комплексів і лігандів
Існують сполуки, склад яких записується не зовсім звичайними формулами, наприклад, K4[Fe(CN)6], [Ag(NH3)2]Cl. Для них характерний ряд своєрідних властивостей, тому ці сполуки виділяють в окремий клас і називають координаційними (комплексними) сполуками. Засновником уявлень про комплексні сполуки (КС) вважається Альфред Вернер (1893 р., Швейцарія). Великий вклад в розвиток теорії КС внесли роботи Л.С. Чугаєва, І.І. Черняєва, О.О. Грінберга, В.В. Лебединського та ін. Суть координаційної теорії зводиться до таких висновків:
- більшість елементів проявляють два види валентності: головну, яка збігається зі ступенем окиснення, та побічну – донорно-акцепторну;
- при насиченні елементом головної та побічної валентності, утворюється координаційна сфера або комплекс – стійка група атомів, в основі якої знаходиться центральний атом (ЦА) або йон:
у Ферума насичується головна валентність:
FeSO4 + 2КCN → Fe(CN)2 + К2SO4
у Ферума насичується побічна валентність:
4KCN + Fe (CN)2 → K4[Fe(CN)6]
Найчастіше ЦА – це атоми-акцептори електронів: наприклад, катіони з s2р6d1-10 оболонками, рідше атоми-донори електронів.
- навколо ЦА-акцептора можуть координуватися донори електронів – аніони, нейтральні молекули, наприклад, Н2О, NH3, CO, якщо ЦА-донор електронів (наприклад, активний неметал з негативним ступенем окиснення), навколо нього координуються йони гідроксонію та деяких металів. Частинки, які координуються навколо ЦА, називаються лігандами, а число місць, яке займає ліганд, називається дентатністю. Більшість лігандів у координаційній сполуці займають одне місце і називаються монодентатними. Але бувають випадки, коли ліганди мають кілька функціональних груп і завдяки цьому можуть з’єднуватись з центральним атомом через два або більше атомів. Такі ліганди займають навколо комплексоутворювача одне, два, три або більше місць і називаються бі-, три- та полідентатними (наприклад, бідентатні СО32–, C2O42–, Н2N-NH2)
- число, яке показує, скільки монодентатних лігандів може приєднатися до ЦА, називається координаційним числом. Воно може мати значення: від 2 до 9 і навіть більше (залежить від ступеня окиснення елемента та співвідношення між радіусами ЦА і лігандів);
- комплексоутворювач і ліганди складають внутрішню сферу, а йони, які безпосередньо не зв'язані з комплексоутворювачем, складають зовнішню сферу, наприклад:
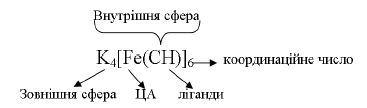
Таким чином, координаційними або комплексними називаються такі сполуки, що містять у своєму складі одну або більше координаційних сфер (комплексів). Вони здатні до існування як в кристалічному, так і в розчиненому стані.
Заряд координаційної сфери (комплексу) визначається алгебраїчною сумою ступенів окиснення ЦА та всіх лігандів.
Класифікація комплексних сполук
За характером заряду комплексного йону розрізняють:
- катіонні комплекси ([Cu(NH3)4]2+, [А1(Н2О)6]3+). Найчастіше утворюються за рахунок координації навколо позитивних йонів нейтральних молекул (NH3, H2O та ін.), наприклад: [Zn(NH3)4]Cl2, [A1(H2O)6]C13.
- аніоні комплекси ([Fe(CN)6]4–, [Al(OH)4]
 ) – це комплекси, в яких у ролі комплексоутворювача виступають позитивні йони, а лігандами є аніони, наприклад: K4[Fe(CN)6], К3[Fe(CN)6], Na[Al(OH)4].
) – це комплекси, в яких у ролі комплексоутворювача виступають позитивні йони, а лігандами є аніони, наприклад: K4[Fe(CN)6], К3[Fe(CN)6], Na[Al(OH)4]. - нейтральні комплекси ([Fe(CO)5], [Ni(CO)4]) утворюються в результаті координації навколо нейтрального комплексоутворювача нейтральних лігандів, а також під час одночасної координації навколо позитивного йона-комплексоутворювача негативно заряджених та нейтральних лігандів. Нейтральні комплекси, таким чином, є комплексними сполуками без зовнішньої сфери.
Основними типами комплексних сполук є:
аміакати – сполуки, що містять амін-комплекси: [Сu(NH3)4]SO4 – тетраамінкупрум(ІІ) сульфат;
гідрати – містять аква-комплекси: [Cr(H2O)6]Cl3 – гексааквахром(ІІІ) трихлорид;
гідроксокомплекси – лігандами є гідроксид-йони: К2[Zn(ОН)4] – дикалій тетрагідроксоцинкат;
ацидокомплекси – лігандами є аніони (залишки кислот): К2[PlСl4] – дикалій тетрахлороплатинат(ІІ) та ін.
Комплексоутворювачем може бути будь-який елемент періодичної системи. Неметалічні елементи майже завжди дають аніонні комплекси, у яких лігандами є атоми найбільш електронегативних елементів, наприклад: K[PF6], K3[PO4], K[PS4].
У типових елементів-металів здатність до утворення комплексних сполук виражена слабко, оскільки їхні йони характеризуються відносно великими розмірами і малим зарядом. Існуючі нечисленні комплексні сполуки такого типу є похідними малостійких катіонних комплексів, наприклад, [Sr(H2O)6]Cl2; [Ca(NH3)8]Cl2.
Амфотерні елементи можуть утворювати як катіонні та аніонні, так і нейтральні комплекси, наприклад: [Al(Н2О)6]Cl3, [А1(OH)3(Н2O)3], Са3[А1(OН)6]2.
Класифікація лігандів:
- монодентатні: (F
 , Cl
, Cl , Br
, Br , I
, I , CN
, CN , NH3, Н2О, СО та ін.);
, NH3, Н2О, СО та ін.); - бідентатні ліганди (CO32-, SO42-, C2O42-, H2NCH2CH2NH2 та ін.);
- три- (полі-)дентатні ліганди. Комплекси з полідентантними лігандами називаються хелатними (або клішнеподібними, від грец, chelate – клешня).
Головною особливістю хелатних комплексів (комплексонів) є те, що ліганди в них приєднуються до комплексоутворювача за рахунок головної і побічної валентності. До таких лігандів відносяться сполуки, в яких є декілька функціональних груп, наприклад, -СOOН, в яких Гідроген заміщується на йон металу і -NН2-група, що містить неподілену електронну пару. Прикладом можуть бути продукти взаємодії йонів металів з α-амінокислотами.
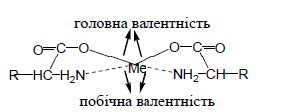
Рисунок 9.1 – Хелатний комплекс
Для комплексних сполук характерна “ізомерія”. Розрізняють:
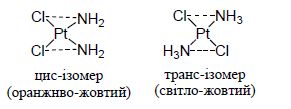
– геометричну (цис-транс) ізомерію, характерну для комплексів з різними лігандами :
– координаційну ізомерію – характеризується різною координацією двох видів лігандів відносно двох різних комплексоутворювачів:
[Co(NH3)6]3+ [Cr(CN)6]3- і [Cr(NH3)6]3+ [Co(CN)6]3-;
– йонізаційну ізомерію – характеризується неоднаковим розподілом аніонів між внутрішньою і зовнішньою сферами:
[CoBr(NH3)5]2+SO4 і [CoSO4(NH3)5]+Br
9.2 Номенклатура комплексних сполук і їх основні типи
Назви лігандів. Якщо лігандами є аніони, то до кореня латинської назви додають голосну "о", наприклад: F![]() –фторо, Сl
–фторо, Сl![]() –хлоро, Br
–хлоро, Br![]() –бромо, ОН
–бромо, ОН![]() –гідроксо, CN
–гідроксо, CN![]() –ціано, SO42-–сульфато, NO
–ціано, SO42-–сульфато, NO![]() –нітро, NO
–нітро, NO![]() – нітрато та ін. Назви нейтральних лігандів залишають без змін: С6Н6 – бензен, (NH2)2CO – карбамід, H2NCH2CH2NH2 –етилендіамін. Виключення: H2O – аква, NH3 – амін, NO – нітрози, CO – карбоніл.
– нітрато та ін. Назви нейтральних лігандів залишають без змін: С6Н6 – бензен, (NH2)2CO – карбамід, H2NCH2CH2NH2 –етилендіамін. Виключення: H2O – аква, NH3 – амін, NO – нітрози, CO – карбоніл.
Назви KС складаються за наступним принципом:
- в сполуках з комплексними катіонами спочатку називають комплекс а потім зовнішню сферу. Назва комплексу починається із назви координаційного числа (ди, три, тетра, пента, гекса та ін), потім називають ліганд, потім комплексоутворювач у називному відмінку із зазначенням його валентності (за системою Штока). Наприклад:
[Ag(NH3)2]Cl – діамінаргентум(І) хлорид;
[Al(H2O)5OH]SO4 – моногідроксопентаакваалюмінй(III) сульфат;
[Pt(H2O)(NH3)2ОН]NO3 – гідрокcодіамінмоноакваплатина(ІІ) нітрат.
- у сполуках з комплексними аніонами спочатку називають зовнішню сферу, потім комплексний йон також починаючи з назви координаційного числа (ди, три, тетра, пента, гекса та ін), далі називають ліганд та комплексоутворювач, додаючи до кореня його латинської назви закінчення "ат" і вказуючи валентність. Наприклад:
К4[Fe(CN6] – тетракалій гексаціаноферат (ІІ);
K3[Fe(СN)6] – трикалій гексаціаноферат(ІІІ);
Na3[AIF6] – тринатрій гексафтороалюмінат(ІІІ)
Na2[Pl(CN)4Cl2] – динатрій діхлоротетраціаноплатинат (ІV).
- комплекси без зовнішньої сфери називаються одним словом:
[Ni(СO)4] –тетракарбонілнікол;
[Рt(NH3)2Cl2] – дихлородіамінплатина (ІІ).
9.3 Рівновага в розчинах комплексних сполук
Йони зовнішньої сфери з'єднані з внутрішньою сферою (комплексом) йоним зв'язком, тому в водних розчинах комплексні солі дисоціюють практично повністю як сильні електроліти, наприклад:
[Ag(NH3)2]Cl → [Ag(NH3)2]+ + Cl–
Цей процес називається первинною дисоціацією (вона відбувається миттєво і до кінця).
Внутрішня сфера KС також здатна розпадатися на комплекоутворювач і ліганди, наприклад: [Аg (NH3)2]+ ![]() Ag+ + 2NН3
Ag+ + 2NН3
Цей процес називають вторинною дисоціацією, який аналогічний дисоціації слабких електролітів. Він підкоряється закону дії маси, може відбуватися ступінчасто і характеризуєгься константою рівноваги:
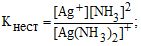
рКнест = -lgКнест (9.1)
Ця константа є мірою стійкості комплексу: чим менше стійкий комплекс, тим більша концентрація Аg+ і NН3 (для даного випадку), тим більше числове значення константи (К), яку називають константою нестійкості. Величина, обернена до константи нестійкості, називається константою стійкості:
Кст.= 1/Кнест. (інколи позначається грец. літ. β) або Кст. = К–1нест., lgβ = pKнест.
Вона є мірою комплексоутворення. Для наведеного вище прикладу:
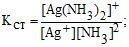
тобто більшій величині Кст відповідає більша концентрація комплексу за рівноваги. Оскільки в розчинах йони сольватовані (гідратовані), то під час йонізації комплексу в розчині відбувається заміна лігандів на молекули розчинника і навпаки, наприклад:
[Co(NH3)6]2+ + 6H2О![]() [Co(H2О)6]2+ + 6NH3
[Co(H2О)6]2+ + 6NH3
Напрямок визначається за величинами рКнест.
До дисоціації комплексного йона можна застосувати правило зміщення рівноваги Ле-Шателье. Наприклад, для дисоціації йона
[Ag(NH3)2]+![]() Ag+ + 2NН3
Ag+ + 2NН3
збільшення концентрації молекул аміаку зміщує рівновагу вліво.
Наведемо приклади констант нестійкості для однотипних сполук:
а) ![]() Кнест = 1,3∙10-3
Кнест = 1,3∙10-3
б) ![]() Кнест = 6,8∙10-8
Кнест = 6,8∙10-8
в) ![]() Кнест = 1∙10-21
Кнест = 1∙10-21
На підставі цих даних можна зробити висновок, що найбільш стійким комплексом є в) а найменш – а).
Більшість добре розчинних КС можна зруйнувати дією інших електролітів або розчинників, якщо в результаті реакції утворюються малорозчинні сполуки, більш стійкі ніж вихідні комплекси. Напрямок реакції визначають за величиною константи рівноваги. Наприклад:
[Аg (NH3)2]+ + I– ![]() АgI ↓+ 2 NH3+
АgI ↓+ 2 NH3+
Кнест = 6.8∙10-8 ДР = 8,3∙10-17
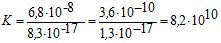
[Zn(NH3)4]2+ + 4CN- ![]() [Zn (CN)4]2- + 4NH3
[Zn (CN)4]2- + 4NH3
Кнест = 3,6∙10-10 Кнест = 1,3∙10-17
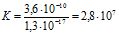
Великі значення констант рівноваги свідчать про те, що реакції практично відбуваються до кінця, тобто, є необоротними.
9.4 Сучасні теорії комплексних сполук і їх практичне значення
Для пояснення утворення і властивостей КС використовують метод валентних зв'язків (МВЗ), теорію кристалічного пoля (ТКЦ) і метод молекулярних орбіталей (MMО). За МВЗ – утворення комплексів здійсняється за рахунок донорно-акцепторної взаємодії неподілених електронних пар лігандів і вільних орбіталей комплексоутворювача. Причина комплексоутворення – валентна ненасиченість ЦА, тому КС, як правило, міцніші, ніж прості сполуки, із яких вони утворилися.
Комплексноутворююча здатність катіонів визначається йонним потенціалом φ (рівним відношенню заряду катіона Ζ до його радіусу r: ![]() ) і електронною конфігурацією.
) і електронною конфігурацією.
Від величини φ залежить в основному стійкість комплексу. Наприклад катіони s-елементів (К+,Nа+,Са2+ та ін.) мають великий радіус і малий заряд, тому характеризуються низькою комлексоутворюючою здатністю.
Катіони d-елементів, які мають невеликий радіус і високий заряд (Сr3+, Сo3+, Рt4+ та ін.) є дуже сильними комплексоутворювачами. Йони р-елементів за комплексоутворюючою здатністю займають проміжне положення між катіонами s- і d-елементів.
Катіони d-елементів можуть одночасно мати і вільні орбіталі, і неподілені електронні пари, і тому одночасно з σ-зв'язком утворюється і π-зв'язок за донорно-акцепторним механізмом. Якщо аналогічні можливості характерні і для ліганду, то заповнена електронами орбіталь комлексоутворювача перекривається з вакантною орбіталлю ліганда і тоді утворюється так званий "π-дативний" зв'язок.
Так як комплексоутворювач надає для утворення зв'язків нерівноцінні орбіталі, то відбувається їх гібридизація, а тип гібридизації визначає геометрію комплексу (рисунок 9.1).
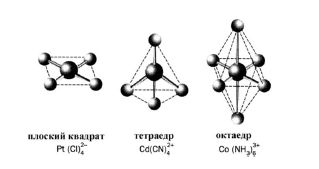
Рисунок 9.1 – Геометрія молекул комплексних йонів
Be2+ має вільні 2s і 2 р-орбіталі, виступає як акцептор 4 електронних пар, які надають йому фторид-йони. 3а рахунок sр3-гiбридизації валентних орбіталей берилію йон [BeF4]2- має тетраедричну будову.
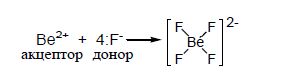

Якщо координаційне число дорівнює 4, крім sр3-гібридизації (тетраедрична координація лігандів), може реалізуватися також dsp2-гібридизація, якій відповідає плоско-квадратична координація:
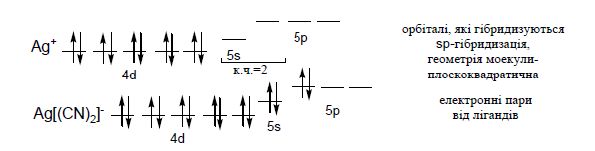
Комплексноутворююча здатність катіонів визначається: йонним потенціалом φ (рівним відношенню заряду катіона Ζ до його радіусу r ![]() ) і електронною конфігурацією.
) і електронною конфігурацією.
Від величини φ залежить в основному стійкість комплексу. Наприклад катіони s-елементів (К+,Nа+,Са2+ та ін.) мають великий радіус і малий заряд, тому характеризуються низькою комлексоутворюючою здатністю.
Катіони d-елементів, які мають невеликий радіус і високий заряд (Сr3+, Сo3+, Рt4+ та ін.) є дуже сильними комплексоутворювачами. Йони р-елементів за комплексоутворюючою здатністю займають проміжне положення між катіонами s- і d-елементів.
Катіони d-елементів можуть одночасно мати і вільні орбіталі, і неподілені електронні пари. Якщо аналогічні можливості характерні і для ліганду, то одночасно з σ - зв'язком (ліганд – донор, комлексоутворювач – акцептор) утворюється і π-зв'язок (ліганд – акцептор, комлексоутворювач – донор, називають такий зв'язок "дативним").
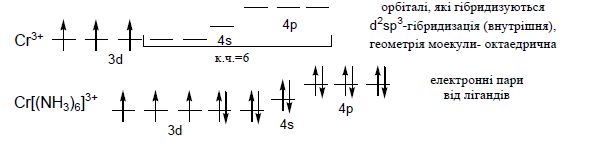
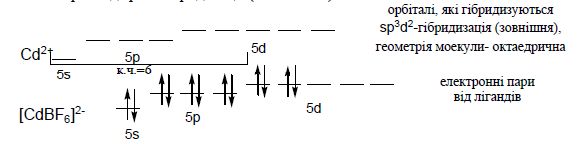
Для катіонів d-елементів характерні октаедричні комплекси з гібридизацією: d2sp3 і sр3d2, в залежності від того, які d-орбіталі комплексоутворювача доступні для лігандів. Гібридизація d2sp3 називається внутрішньою (комплекси – внутрішньоорбітальними); гібридизація sр3d2 - називається зовнішнью (комплекси –зовнішньоорбітальними).
Приклад d2sp3-гібридизації (внутрішньої):
Приклад sр3d2-гібридизації (зовнішньої):
Метод ВЗ є наближеним, мало придатним для розрахунку енергії зв'язку і інших характеристик комплексних сполук.
Теорія кристалічного поля ґрунтується на припущенні, що між комплексоутворювачем і лігандами існує тільки електростатична взаємодія, при цьому враховується просторовий розподіл електронної густини
d-орбіталей комплексоутворювача.
Якщо атом (йон) помістити в центр сфери з рівнорозподіленим негативним зарядом (гіпотетичний випадок), то на всі п'ять електронні хмари d-орбіталей буде діяти однакова сила відштовхування, що призведе до збільшення енергії всіх d-електронів, але вона, як і раніше, буде однакова (виродження не знімається).
Якщо йон потрапляє в утворене лігандами менш симетричне, ніж сферичне поле, то енергія d-електронів буде зростати тим більше, чим ближче до ліганду розміщена відповідна електронна хмара.
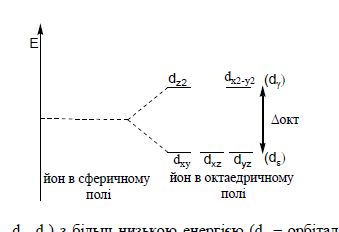
Наприклад, в октаедричному полі d-орбіталї розділяються на дві групи з різними енергіями:
три орбіталі (dxy, dx, dy) з більш низькою енергією (dε – орбіталі); дві орбіталі (dz2 і dz2=y2) з більш високою енергією (dγ-орбіталі). Різниця між енергіями dε–dγ-підрівней називається енергією розщеплення орбіталей (позначається грецькою літерою Δ, в даному випадку – Δокт).
Для тетраедричного оточення розщеплення буде мати обернений вигляд, тобто, dγ-орбіталі мають низьку, а dε-opбіталі – більш високу енергію (Δтет = 4/9·Δокт) d-рівня. За здатністю спричиняти розщеплення орбіталей ліганди розміщуються в такому порядку:
СО > CN![]() > NO
> NO![]() > NH3 > H2O > OH
> NH3 > H2O > OH![]() > F
> F![]() > Сl
> Сl![]() > Вr
> Вr![]() > I
> I![]() ,
,
який називається спекторохімічним рядом.
Ліганди, які розміщені в кінці цього ряду, спричиняють невелике розщеплення енергії d-підрівня (ліганди слабкого поля). Ліганди, розміщенні на початку ряду (ліганди сильного поля) призводять до значного розщеплення d-підрівня. Тому, в першому випадку електрони розміщуються за правилом Гунда спочатку на dε-орбіталях (три електрона), потім на
dγ-орбіталях (два електрона) і тільки після цього починається попарне заповнення електронами dε-, а потім dγ-орбіталей.
У другому випадку заповняються dε-орбіталі – спочатку поодинокими, а потім спареними електронами, після чого заповнюються dγ-орбіталі (ліганди сильного поля).
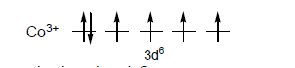
Приклад. Пояснити, чому йон [CoF6]3– парамагнітний, а йон [Co(CN)6]3– – дімагніний?
Електронна формула Сo3+ 3d64s0. Шість d-електронів розподілені на орбіталях так:
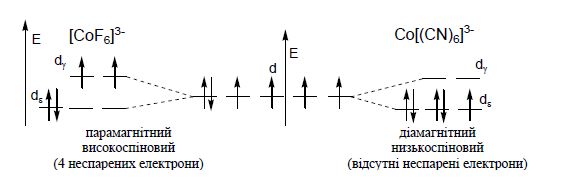
В октаедричному полі лігандів відбудеться розщеплення d-підрівня неоднаково, тому що F–-йон -ліганд слабкого поля і СN–-йон-ліганд сильного поля. Тому, схема розподілу електронів на dε - і dγ-орбіталях буде такою:
Якщо число непарних електронів дорівнює одиниці, то в такому випадку теж буде низькоспіновий комплекс.
Наявність на dγ-орбіталях валентних місць (незаповнені орбіталі) може спричиняти перехід електрона з dε → dγ (при поглинанні комплексним йоном світла), що буде визначати колір комплексного йона (сполуки).
Теорія молекулярних орбіталей надає великого значення σ- і π-зв'язуванню, яке впливає на величину параметра розщеплення (Δ): чим більше σ-зв'язування центрального атома з лігандами, тим більше Δ. π-взаємодія може бути донорно-акцепторною (з утворенням π*-розпушуючих МО), коли частина електронної густини від ліганда переноситься до центрального атому, і дативною (з утворенням π-зв'язуючої МО), коли частина електронної густини від комплексоутворювача переноситься до ліганда. Ліганди π-акцептори характеризуються більшим Δ ніж π-донори. Тому при дативному π-зв'язуванні Δ більше в порівнянні з π-донорно-акцепторною взаємодією. За характером σ- і π-зв'язування ліганди поділяються на такі групи:
– σ-донори (NH3 ,NR3, NCS![]() );
);
– σ-донори, слабкі π-донори (F![]() , OH
, OH![]() , H2O, ROH, R2O);
, H2O, ROH, R2O);
– σ, π-донори, слабкі π-акцептори (CI![]() , Br
, Br![]() , I
, I![]() , SH
, SH![]() , SCN
, SCN![]() );
);
– σ-донори, π-акцептори (CN![]() , CO, NO, PR3, NO
, CO, NO, PR3, NO![]() );
);
– π-донори, π-акцептори (C6H6, C2H4).
Тому, електрохімічний ряд лігандів (спекторохімічний ряд) починається з СО, CN![]() (це комплекси з максимальною стійкістю за рахунок σ- і π-акцептороного зв'язування).
(це комплекси з максимальною стійкістю за рахунок σ- і π-акцептороного зв'язування).
Нааприклад, під час утворення комплексу [Ni(СO)4], з одного боку, 4s і 4р атомні орбіталі Ніколу перекриваються з симетричними до них σ-молекулярними орбіталями СО. При цьому виникають по чотири зв’язувальних і розслаблювальних σ-молекулярних орбіталей. З іншого боку, π-молекулярні орбіталі СО перекриваються з dε- і dγ-атомними орбіталями атома Ніколу, за π-дативним механізмом, утворюючи π-молекулярні зв’язуючі орбіталі, що сприяє зміцненню координаційного зв’язку.
Метод молекулярних орбіталей ґрунтовніше пояснює природу комплексів, зокрема карбонільних, наприклад, [Ni(СO)4]. Проте він має недоліки, які пов’язані із складністю обчислень і недостатньою наочністю.
Значення КС. За порівняно короткий час хімія КС виросла в галузь, яка швидко розвивається, перетворюючись на зв’язуючу ланку між неорганічною, органічно, аналітичною, фізичною і біологічною хімією. Більше як 30% всіх реакцій якісного аналізу, базується на комплексоутворенні. Ці реакції використовуються і в кількісному аналізі, а також в техніці: добування цінних металів (металів платинової групи); одержання чистих і надчистих матеріалів (очистка урану). Комплексоутворення покладене в основу фарбування тканин.
Більшість природних мінералів (коштовні і напівкоштовні) є комплексними сполуками (смарагд, топаз, гранат, бірюза та ін.).
Контрольні питання
- В чому особливості будови комплексних сполук?
- Яка з наведених комплексних сполук містить комплексний катіон, аніон: K2[PtBr4], [Pt(NH3)2Cl2], [Pt(NH3)3Cl]Cl, [Pt(NH3)4]Cl2?
- Які з наведених комплексних сполук відносяться до ацидокомплексів, аміакатів: [Ni(CO)4], K2[Cu(CN)4], [Cu(NH3)4]Cl2, [Cu(NH3)2]OH?
- Яка з наведених комплексних сполук є неелектролітом: (NH4)2[PtCl6], (NH4)2[PtCl4], [Pt(NH3)2Cl2], K2[Pt(SNC)4]? Дайте назву комплексним сполукам.
- За яким принципом утворюються назви сполук з комплексним катіоном, аніоном, нейтральних комплексів?
- Первинна та вторинна дисоціація комплексних сполук.
- Що характеризує константа нестійкості, константа стійкості? Як умови руйнування комплексних сполук?
- Поясніть утворення комплексних сполук за методом валентних зв’язків.
- Поясніть утворення комплексних сполук за теоріею кристалічного поля.
- Області застосування комплексних сполук.