1 ОСНОВНІ ПОНЯТТЯ ТА СТЕХІОМЕТРИЧНІ ЗАКОНИ ХІМІЇ
План
1.1 Основні поняття хімії.
1.2 Основні закони хімії.
1.1 Основні поняття хімії
Хімія – це наука про склад, властивості і будову речовин та їх взаємні перетворення, про взаємозв’язок складу і будови речовин, про взаємодію, добування і використання речовин.
У 1860 році в м. Карлсруе відбувся перший міжнародний з'їзд хіміків, на якому були прийняті визначення таких понять, як атом, молекула і елемент. Сьогодні користуються наступними визначеннями:
– атом – електронейтральна частинка, яка складається з позитивно зарядженого ядра і негативно заряджених електронів, які рухаються навколо ядра. Це найменша частинка хімічного елемента, що зберігає його типові властивості (атом є хімічно неподільний). Ядро атома складається з протонів і нейтронів. Їх суму називають нуклонним числом атома. Вона приблизно дорівнює масі ядра в а.о.м., тому її також називають масовим числом атома. Кількість протонів – протонне число, співпадає з порядковим номером елементу в таблиці Д.І. Менделеєва. Сукупність атомів з однаковим протонним числом називається хімічним елементом;
– молекула – найменша частинка речовини, яка здатна самостійно існувати і має всі хімічні властивості речовини.
Проста речовина – форма існування хімічного елементу у вільному вигляді. Різниця між простою речовиною і хімічним елементом полягає в тому, що один і той же хімічний елемент може утворювати декілька простих речовини – алотропних модифікацій. Наприклад: хімічний елемент Фосфор утворює прості речовини білий, червоний, чорний фосфор, елемент Карбон – прості речовини алмаз і графіт; елемент Оксиген – прості речовини кисень і озон. Явище існування хімічного елементу у вигляді кількох простих речовин називається алотропією.
Складна речовина утворюється внаслідок взаємодії між атомами різних хімічних елементів, наприклад КСl, НСl, Na2CO3 та ін.
Атоми хімічних елементів та речовини характеризуються певною масою, кількістю, об’ємом тощо. Абсолютні маси атомів і молекул надзвичайно малі. Наприклад, маса атома ізотопу Карбону 12 6С складає 1,99·10-23 г, а однієї молекули СО2 – 7,31·10-23 г. Тому користуються поняттям відносної маси.
За атомну одиницю маси (а.о.м.) прийнята 1/12 маси атома (ma) ізотопу Карбону 126С: 1 а.о.м. = 1,66·10-24 г.
Відносна атомна маса (Аr) хімічного елементу – маса атома (ma), виражена в атомних одиницях маси тобто: Ar = ma/(1/12) ma(126С ) = ma/1,66·1024.
Відносна молекулярна маса (Мr) – це маса молекули, виражена в атомних одиницях маси. Молекулярна маса речовини дорівнює сумі атомних мас елементів, що входять до складу молекули.
Обидві величини є безрозмірними і виражаються в безрозмірних одиницях. Наприклад: відносна молекулярна маса вільного хлору Мr (Сl2) = 70,9 а.о.м., атомна маса Хлору вдвічі менша – 35,45 а.о.м., оскільки одна молекула хлору Сl2 містить два атом Хлору Сl2 = 2Сl.
У хімічних розрахунках поряд із такими фізичними величинами як маса і об'єм, використовують кількість речовини – величина, яка пропорційна числу структурних одиниць, що містяться у речовині. Одиницею кількості речовини в хімії є моль.
Моль – кількість речовини, яка містить стільки атомів, молекул, йонів, електронів або інших структурних одиниць, скільки міститься атомів у 12г ізотопу Карбону 12 6С, а саме: 6,023·1023 (число Авогадро). Наприклад: 1 моль О2 містить 1 моль (6,023·1023) молекул кисню і 2 моль (12,046·1023) атомів Оксигену. 1 моль СО2 містить 1 моль атомів Карбону і 2 моль атомів Оксигену.
Маса 1 моля даної речовини в грамах має назву молярної маси (М). Молярну масу вимірюють в г/моль (кг/кмоль).
Кількість молей простої чи складної речовини ν знаходять із відношення маси цієї речовини до його молярної маси:
![]() , (1.1) або
, (1.1) або 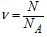 , (1.2)
, (1.2)
де N – число частинок речовини, NA – число Авагадро.
Хімічним еквівалентом елементу (Е) називається така його кількість, яка сполучається без залишку з одним молем атомів Гідрогену або заміщує таку саму кількість атомів Гідрогену в хімічних реакціях. Величина обернена еквіваленту називається числом еквівалентів (ne). Наприклад:
Н2 + S = H2S
2 моль 1моль
атомів атомів
з 1 молем атомів Гідрогену без залишку сполучається ½ моль атомів Сульфуру, таким чином, еквівалент Сульфуру ЕS складає ½, а 1 моль сульфуру містить два еквіваленти, ne = 2.
3Н2 + N2 = 2NH3
6 моль 2моль
атомів атомів
з 1 молем атомів Гідрогену без залишку сполучається 1/3 моль атомів Нітрогену, таким чином, еквівалент Нітрогену ЕN складає 1/3, а ne = 3.
Еквівалентною масою (або молярною масою еквіваленту) me називається маса одного еквівалента елементу (речовини). Таким чином, число еквівалентів виражають у молях, а еквівалентну масу – у г/моль.
Для простих речовин:
me = М/(В∙n), (1.3)
де М – молярна маса простої речовини, г/моль; В – валентність елементу, який складає просту речовину, n – число атомів елементу у простій речовині.
Наприклад: mе(О2) = 32/(2·2)=8г/моль.
Для складних речовин:
me (оксиду) = Мокс /(В ∙n), (1.4)
де Мокс – молярна маса оксиду, г/моль; В – валентність металу або неметалу, який утворює оксид, n – кількість атомів металу або неметалу, який утворює оксид.
Наприклад, mе(СаО) = М/(2·1) = 56/2=28 г/моль.
me (кислоти або основи) = М/n, (1.5)
де М – молярна маса кислоти або основи, г/моль; n – основність кислоти (кількість атомів водню) або кислотність основи (кількість гідроксильних груп).
Наприклад, mе (H2SO4) = М/2 = 98/2=49 г/моль; me(Ca(OH)2) = М/2 = 74/2 = 37 г/моль.
me(солі) = Мсолі/В∙n, (1.6)
де Мсолі – молярна маса солі, г/моль; В – валентність металу, який входить до складу солі, n – кількість атомів металу. Наприклад, me(Al2(SO4)3) = M/(2·3) = 342/6 = 57 г/моль.
me (йону) = Мйону/z, (1.7)
де Мйону – молярна маса йону, г/моль; z – заряд йону.
Наприклад: me(SO42–) = M/2 = 98/2 = 48 г/моль.
Масу еквівалентну речовини можна розрахувати, як суму еквівалентних мас йонів. Наприклад: me(Al2(SO4)3) = me(Al3+) + me(SO42–) = 27/3 + 98/2 = 57 г/моль.
Еквівалент речовини можна розрахувати з виразу Е=me/М, а число еквівалентів – з виразу ne = М/me.
Наприклад, еквівалент сполуки (Е) Al2(SO4)3 = me(Al2(SO4)3)/М(Al2(SO4)3) =1/6, а число еквівалентів (ne) = me(Al2(SO4)3)/М(Al2(SO4)3) = 6.
Еквівалент і еквівалентна маса – величини змінні, вони залежать від характеру реакції:
а) H2SO4 + КОН = KHSO4 + H2O оскільки в молекулі кислоти заміщується лише один атом Гідрогену, то me (кислоти) = М/1 = 98 г/моль,
Е (кислоти) = me/М=98/98 = 1
б) H2SO4 + 2КОН = K2SO4 + 2H2O оскільки атоми Калію заміщується два атоми Гідрогену сульфатної кислоти, то me (кислоти) = М/2= 49г/моль;
Е (кислоти) = me/М=49/98 = 1/2.
Еквівалентним об'ємом називається об'єм, який займає за даних умов один еквівалент газоподібної речовини. Обчислити еквівалентний об'єм газоподібної речовини можна за формулою:
Ve=Vm/(В∙n), (1.8)
де Vm – молярний об'єм газу, л/моль; В – валентність елементу, який складає газоподібну просту речовину, або неметалу, в складі газоподібного кислотного оксиду, n – число атомів елементу у простій речовині або неметалу у складі кислотного оксиду. Наприклад: Vе(О2) = 22,4/(2·2) =5,6л/моль; Vе(N2O) = 22,4/(1·2) = 11,2 л/моль.
1.2 Основні закони хімії
Закон збереження маси речовин. Михайло Васильович Ломоносов у 1748 році, а пізніше Антуан Лавуазьє встановили: "Маса речовин, які вступають у реакцію, дорівнює масі речовин, що утворюються в результаті реакції".
|
|
Ломоносов Михайло Васильович, (1711-1765 р.р.). Народився у селянській родині. У 1745 р. став професором хімії. Він створив першу хімічну лабораторію в Росії. Наукові інтереси Ломоносова М.В. енциклопедичні: він займався хімією, фізикою, астрономією, мінералогією, геологією та ґрунтознавством , географією, картографією, збагатив їх своїми відкриттями і став засновником нових наук (фізичної хімії та ін.); створив нові прилади для геодезії, мінералогії та ін. Поряд з природничими науками займався літературою, стилістикою російської мови, історією. М.В. Ломоносов відомий як художник. Він створив мозаїчне панно "Полтавська битва" |
|
Антуан Лоран Лавуазьє, (1743-1794 р.р.), французький хімік, народився у родині юристів, один із засновників сучасної хімії. Застосовував методи кількісного аналізу в хімії, дослідив роль кисню в процесах горіння, окиснення, дихання. А. Лавуазьє був ініціатором і одним з розробників нової хімічної номенклатури. Автор класичного курсу "Начальний підручник хімії". Під час Французької революції за рішенням суду революційного трибуналу як генеральний відкупщик був гільйотинований у числі інших відкупщиків. |
|
|
|
Пруст Жозеф Луї, (1754-1826 р.р.), французький хімік, народився у родині аптекаря. Отримав хімічну освіту у Парижському університеті. На запрошення іспанського короля Карла ІІІ працював професором кафедри хімії у Сеговії, а потім Мадриді. Самим видатним науковим досягненням Ж. Пруста стало відкриття закону постійності складу. Завдяки тому, що дослідження Ж.Пруста відзначались винятковою точністю для свого часу, цей закон отримав визнання більшості хіміків, зайняв важливе місце в хімічній теорії періоду класичної хімії. |
Закон збереження маси речовин є одним із основних законів природи. Він окремий випадок більш загального закону збереження матерії й енергії. Німецький фізик Альберт Ейнштейн довів, що між масою і енергією існує взаємозв'язок:
Е = Δmс2, (1.9)
де Е – енергія, m – маса, с – швидкість світла (3∙108 м/с ).
Згідно з цим законом зміні маси на величину Δm відповідає певна зміна енергії.
Сучасне формулювання закону збереження маси речовин математично виражається таким чином:
![]() , (1.10)
, (1.10)
де ![]() – маса всіх вихідних речовин;
– маса всіх вихідних речовин; ![]() – маса продуктів реакції;
– маса продуктів реакції; ![]() – маса всіх видів випромінювання.
– маса всіх видів випромінювання.
Закон постійності складу речовин сформульований у кінці XVIII століття французьким хіміком Жаном Прустом: "Кожна індивідуальна молекулярна хімічна сполука має сталий якісний і кількісний склад, незалежно від способу її добування".
Наприклад, СО2 можна одержати різними способами:
СаСО3  СаО + СО2
СаО + СО2![]()
С + О2 = СО2
Na2CO3 + 2НСl = 2NaCl + СО2 + Н2О
Закон постійності складу речовини відіграв дуже важливу роль в розвитку хімічної науки, але він не є всезагальним і має істотні обмеження: поряд із сполуками зі сталим складом – дальтонідами, існують сполуки немолекулярної структури, які мають змінний склад – бертоліди: ТіН1-2, ТіС0,6-1 і ін. Багато таких сполук серед оксидів, сульфідів, нітридів.
Закон простих вагових (кратних) відношень сформульований Джоном Дальтоном: "Якщо два елементи утворюють між собою кілька хімічних сполук, то на одну й ту ж масову частину одного елементу, припадають такі масові частини іншого елементу, які відносяться між собою як прості цілі числа".
|
Джон Дальтон (1766-1844 р.р.), англійський хімік і фізик, засновник хімічного атомізму. Відкрив закон кратних відношень, ввів поняття "атомна вага", першим визначив атомні маси ряду елементів. Відкрив ряд газових законів, які тепер названі його ім’ям. Першим описав дефект зору, яким сам страждав, і який пізніше назвали дальтонізмом. |
|
Наприклад: a) CO і б) СО2
а) CO: 12м.ч. "С" – 16м.ч. "О" б) СО2 12 м.ч. "С" – 32 м.ч. "О"
1 м.ч. – x1 1 м.ч. – х2
х1 = 1,3 х2 = 2,6
Масові кількості кисню у цих сполуках відносяться як невеликі цілі числа: 1,3 : 2,6 = 1 : 2.
Закон простих об'ємних відношень або газовий закон Жозефа Луї Гей-Люссака сформульований у 1808 р.: "За однакових умов об'єми газів, що вступають в реакцію, відносяться між собою та до об'ємів газів, що утворились в результаті реакції, як прості цілі числа".
|
|
Жозеф Луї Гей-Люссак, (1778 –1850 р.р.), французький фізик і хімік. Наукові роботи Ж. Гей-Люссака відносяться до різних областей хімії. Незалежно від Д. Дальтона він відкрив один з газових законів – закон теплового розширення газів, який пізніше отримав його ім’я. Сумісно з німецькими дослідниками встановив склад води, показав, що співвідношення водню і кисню в її молекулі дорівнює 2:1. Ж. Гей-Люссак відкрив закон об’ємних відношень, довів, що хлор – це елемент а не кисневмісна сполука, встановив елементарний характер калію та натрію, фосфору та сірки, дослідив синильну кислоту, встановив її склад за отриманими результатами розробив концепцію водневих кислот, отримав і вивчив диціан, тим самим заклавши основу для розвитку теорії складних радикалів. |
Наприклад: 2H2S(г) + 302(г) = 2S02(г) + 2Н20(г)
2V : 3V 2V : 2V
На підставі рівняння можна робити різні розрахунки.
Закон еквівалентів був експериментально встановлений німецьким вченим В. Ріхтером (1792 р.), а остаточно сформульований Джоном Дальтоном у 1803 р.: "Хімічні елементи і речовини реагують між собою у масових кількостях, пропорційних їхнім еквівалентам (еквівалентним масам)".
|
Иеремия Вениамин Ріхтер, (1762-1807 р.р.), німецький хімік, народився в Сілезії. У своїх наукових роботах прагнув знайти математичні залежності в хімічних реакціях. В роботі "Начала стехіометрії або спосіб вимірювання хімічних елементів" показав, що при утворенні сполук елементи вступають у взаємодію у строго визначених пропорціях, які пізніше назвали еквівалентами. Ввів поняття "стереохімія", як похідне від грецьких слів stoicheion – основа, елемент і metreo – вимірюю, що повинно було значити вимірювання відношень, в яких хімічні елементи реагують один з одним. Привів перші в історії хімії кількісні рівняння реакцій. |
|
Математично закон записується так:
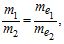 (1.11)
(1.11)
де m1, m2 – маси елементів або речовин (г), а me1, me2 – еквівалентні маси (г/моль).
Закон Амадео Авогадро: "В однакових об'ємах різних газів за однакових умов (тиск, температура) міститься однакова кількість молекул".
|
|
Амедео Авогадро (1776-1856 р.р.), італійський вчений фізик і хімік, народився в Турині. Основні роботи А. Авагадро присвячені молекулярній фізиці. Він висунув молекулярну гіпотезу будови речовин, встановив один із газових законів, який пізніше назвали законом Авагадро. Виходячи з цього закону, вчений розробив метод визначення молекулярної і атомної ваги. Ім’ям А.Авагадро назвали універсальну сталу – число молекул в одному молі ідеального газу (число Авагвдро). |
Однакова кількість молекул будь-якого газу за однакових умов займає однаковий об'єм. Цей об'єм називається молярним об'ємом газу (Vm) і за нормальних умов (0°С, Р=101,3 кПа) дорівнює 22,4 л, таким чином 1 моль будь-якого газу за нормальних умов (н.у.) займає 22,4 л/моль або 0,0224 м3/моль. Користуючись цим законом, кількість молей газу в певному об’ємі за н.у., можна розрахувати за формулою:
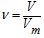 , (1.12)
, (1.12)
де V– об’єм газу за нормальних умов, л; Vm – молярний об’єм газу, л/моль.
Якщо газ знаходиться за умов, які відрізняються від нормальних, використовують рівняння Бойля-Маріота для приведення його до нормальних умов:
PV/T = P0V0/T0, (1.13)
де Р0, V0, Т0 – нормальні умови, при цьому Т0 = 273 К; Р0 = 101325 Па або 101,325 кПа; P, V, T – задані умови.
Молярну масу газу можна визначити за рівнянням Клапейрона-Менделєєва:
![]() , (1.14)
, (1.14)
де m – маса, г; М – молекулярна маса, г/моль; R – універсальна газова стала, що дорівнює 8,31 Дж/(моль∙К); Р – тиск, Па; V – об'єм, м3; Т – абсолютна температура, К. Інші значення R – 62360 [мм рт. ст.∙мл/(моль∙К)] або R = 0,082 [атм∙л/(моль∙К)].
Можна розрахувати молярну масу газу (М1) через його відносну густину:
М1=DM2, (1.15)
де D – відносна густина газу; М2 – молярна маса газу, за яким визначена відносна густина, найчастіше це водень (тоді М2=2) або повітря (тоді М2=29).
Контрольні питання
- Дайте визначення поняттям: атом, молекула, елемент, проста та складна речовина, моль, мольний об’єм газу.
- Дайте визначення поняттям хімічний еквівалент і еквівалентна маса. Розрахуйте Е, ne, me для речовин Н3PO4, MgO, (CuOH)2CO3, KHSO4, О2.
- Закон еквівалентів і його математичний вираз .
- Сформулюйте закон простих вагових (кратних) відношень, проілюструйте закон на прикладі оксидів Нітрогену: N2O, NO, N2O3, NO2, N2O5.
- Закон збереження маси речовин М.В. Ломоносова і його розвиток у роботах А.Л. Лавуазьє. Історичне значення цього закону.
- Закон простих об’ємних відношень або газовий закон Гей-Люссака. Проілюструйте на прикладі реакції: NH3(г) + O2(г) → NO(г) + H2O(г).
- Закон сталості складу. Якісний і кількісний склад речовини. Дальтоніди і бертоліди. Навести приклади.
- Закон А. Авагадро. Який об’єм займає 1 моль газу за н.у.?
- Користуючись яким законом можна привести об’єм газу до н.у.?
- Наведіть всі можливі математичні вирази, за якими можна розрахувати кількість молів простої або складної речовини (в тому числі газоподібної).






