2 ТЕОРІЯ БУДОВИ АТОМІВ ТА ПЕРІОДИЧНИЙ ЗАКОН
План
2.1 Історія розвитку теорії про будову атомів. Сучасна теорія будови атомів. Квантова або хвильова механіка. Квантові числа.
2.2 Атомні орбіталі і принципи їх заповнення електронами.
2.3 Зв'язок між електронною будовою атомів і хімічними властивостями елементів.
2.4 Періодичний закон і періодична система елементів.
2.5 Основні параметри, які визначають властивості елементів.
2.1 Історія розвитку теорії про будову атомів. Сучасна теорія
будови атомів. Квантова або хвильова механіка. Квантові числа
Перша модель атома була запропонована в 1903 р. Дж. Томсоном. За його гіпотезою атом мав вигляд суцільної позитивно зарядженої сфери, в якій розміщені незначні за розмірами негативно заряджені електрони.
Велику роль у встановленні складної природи атома відіграло відкриття і вивчення радіоактивності. Здатність деяких елементів випромінювати невидимі для ока промені, які спричиняють почорніння фотографічних пластинок, проходять крізь речовини, йонізують повітря, називається радіоактивністю, а відповідні елементи – радіоактивними. У 1899 р. англійський фізик Ернест Резерфорд встановив, що радіоактивні промені є неоднорідними і складаються із β-променів (потік електронів), α-променів (потік позитивно заряджених частинок з масою атома гелію ![]() ), γ-променів (електромагнітні хвилі з λ=4·10-11…2·10-9м).
), γ-променів (електромагнітні хвилі з λ=4·10-11…2·10-9м).
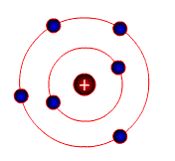
Рисунок 2.1 – Планетарна модель атому
В 1911 р. Е. Резерфорд запропонував планетарну модель атома (рисунок 2.1): в центрі – позитивно заряджене ядро, маса якого майже дорівнює масі атома, навколо ядра подібно до планет сонячної системи рухаються електрони, число яких дорівнює позитивному заряду ядра. Під час руху навколо ядра відцентрова сила урівноважується силою притягнення електронів до ядра.
Вивчаючи характеристичні рентгенівські спектри (фотонне випромінювання з дискретним енергетичним спектром, яке виникає при зміні енергетичного стану електронів атому, λ=10-7-10-14 м) різних хімічних елементів, Генріх Мозлі в 1913 р. встановив, що корінь квадратний з частоти (ν=1/λ) певних ліній однакових серій характеристичного рентгенівського спектра прямо пропорційна порядковому номеру елемента в періодичній системі: ![]() , де а і b – сталі величини; λ – довжина хвилі власного випромінювання елемента з порядковим номером Z. Цей закон дав змогу визначити точні значення порядкових номерів для елементів.
, де а і b – сталі величини; λ – довжина хвилі власного випромінювання елемента з порядковим номером Z. Цей закон дав змогу визначити точні значення порядкових номерів для елементів.
Німецький фізик Макс Планк, вивчаючи природу випромінювання нагрітих твердих тіл, висловив припущення, що енергія випромінюється і поглинається не безперервно, а певними порціями – квантами, пропорційними частоті коливань. Величину кванта енергії можна обчислити із рівняння Планка: Е = hν де Е – кількість енергії з частотою коливань ν; h – стала Планка – 6,626·10-34Дж∙с.
Подальшого розвитку планетарна теорія будови електронної оболонки атому набула в роботах датського фізика Нільса Бора. У 1913 р. він сформулював основні положення своєї теорії будови атомі у вигляді постулатів:
1 – електрон рухається навколо ядра тільки по певних колових орбітах, які називаються стаціонарними, або квантовими, не випромінюючи і не поглинаючи енергії;
2 – якщо електрон переміщується з більш віддаленої на ближчу до ядра стаціонарну орбіту, випромінюється квант, енергія якого дорівнює різниці енергії електрона на цих орбіталях: hν=Е2–Е1, якщо навпаки електрон переміщується з ближньої на більш віддалену від ядра стаціонарну орбіту, поглинається квант.
Стан, що відповідає найменшому запасу енергії атома, називається основним. Перехід електрона на більш віддалену від ядра орбіту називається збудженим. Перехід атома із збудженого у основний стан супроводжується випромінюванням кванта енергії (рисунок 2.2).
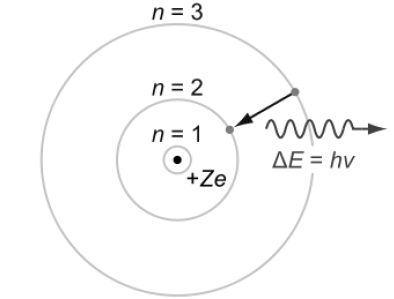
Рисунок 2.1 – Схема переходу атома на орбіту з випромінюванням енергії
Розраховані Бором на основі своєї теорії частоти ліній у спектрі атомарного водню збігались з експериментальними. Отже теорія будови атома Н. Бора не лише пояснювала фізичну природу атомних спектрів, як наслідок переходу атомних електронів з однієї орбіти на іншу, а й давала змогу їх розраховувати. Але до багатоелектронних атомів теорію Бора не вдавалось застосувати. Описати рух електронів багатоелектронних атомів можна за допомогою сучасній теорії будови атомів – квантовій або хвильовій механіці.
Квантова механіка – це система понять та рівнянь, якими необхідно користуватися замість законів і рівнянь класичної фізики, щоб описати поведінку і властивості атомних об'єктів.
Рівняння Луї де Бройля.
У 1924 р. Луї де Бройль припустив, що корпускулярно-хвильова двоїстість (дуалізм) – це властивість матерії. Рух будь-якої матеріальної частинки можна розглядати як хвильовий процес і для нього справедливе співвідношення: λ = h/mv, де m і v – маса і швидкість руху частинки (електрону); h-стала Планка; λ – довжина хвилі. Це математичний вираз дуалізму "хвиля-частинка". Будь-якій частинці з масою m, яка рухається із швидкістю v, відповідає хвиля довжиною λ і, навпаки – полю, яке характеризується довжиною хвилі λ, відповідає мікрочастинка з масою m.
Стосовно до електрона (потоку електронів), ця гіпотеза була підтверджена у 1927 p. K. Девіссоном і Р. Джермером (США) дослідами з дифракції пучка електронів на кристалі нікелю. З того часу квантова механіка розглядає електрон як частинку і як хвилю.
Дифракція електронів, тобто відхилення від прямолінійного розповсюдження біля краю перешкоди, яка розташована на шляху руху електронів, використовується в електронних мікроскопах.
Принцип невизначеності Гейзенберга
В.Гейзенберг (1927р., німецький фізик) запропонував принцип невизначеності: для мікрочастинки атомного масштабу не можливо одночасно встановити координати і швидкість її руху. Математично це виглядає таким чином: Δx·Δvх≥h/m. Добуток невизначеності положення (Δx) і швидкості (Δvх) руху частинки не може бути меншим величини h/m. Пояснимо цей важливий принцип більш детально. Припустимо, що ми вирішили чітко зафіксувати точне положення електрону. Для спостереження за ним потрібно використати джерело випромінювання, як, наприклад, для визначення положення предмету в темній кімнаті потрібен промінь ліхтарика. Однак промінь ліхтарика на предмет суттєво не вплине, а от поглинання кванту світла електроном змінить його швидкість и, як наслідок, енергетичний стан (це ніби промінь ліхтарика пересунув предмет у кімнаті). Промінь відіб’ється від електрону і повернеться до спостерігача, сповістивши про місце знаходження електрону, але не про його швидкість. Якщо визначати енергію (швидкість) електрону за відомими формулами (v=hv/mc), вимірюючи частоту (ν) його коливання, то ми зможемо визначити положення електрону не точніше, ніж довжина хвилі.
Висновок: властивості елементарних частинок не можуть бути описані лише з хвильової або лише з корпускулярної точки зору. Електрон – мікрочастинка, тому неможливо відтворити траєкторію його руху в атомі і неможливо створити наочно модель атома, яка б відповідала характеру цього руху. Можна лише вказати область навколо ядерного простору, у якому більш ймовірно існує електрон.
Тому, вводиться поняття про електронну хмару з ймовірністю ψ2 знаходження електрона в даній точці простору або у елементі об'єму dV навколо ядра ψ2ΔV.
Хвильове рівняння Ервіна Шредінгера.
В 1926 р. австрійській вчений Е. Шредінгер запропонував хвильове рівняння, яке у квантовій механіці відіграє таке ж значення, як закони Ньютона у класичній механіці.
Це рівняння зв'язує хвильову функцію ψ з потенціальною енергією електрону U та його повною енергією Е:
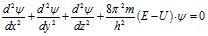
де m – маса електрона, h – стала Планка; х, у, z – координати тримірного простору, які визначають положення електрона у атомі, якщо ядро атома знаходиться на початку координат; U – потенціальна енергія електрона (електростатична взаємодія електрона з ядром, яка залежить від відстані електрона від ядра, тобто від координат х, у, z ); ψ – функція координат х, у, z.
Це рівняння – стаціонарне (не залежить від часу ) і нерелятивне (не враховує залежність маси електрона від швидкості його руху – більш детально розглядається у курсі фізики ). В процесі розв’язання рівняння знаходять значення хвильової функції ψ в різних точках навколо ядерного простору. Квадрат цієї функції ψ2 є пропорційним імовірності перебування електрона в даному елементарному об’ємі з координатами х, у, z. Отже, квантова механіка не визначає положення електрону в навколо ядерному просторі та його швидкість, а визначає лише ймовірність перебування електрону в певному елементарному об’ємі та його енергію.
Розподіл ймовірностей перебування електрону в навколоядерному просторі зображають у вигляді електронної хмари, густина якої в різних ділянках пропорційна ймовірності перебування електрону. Електронна хмарка в принципі нескінченна, але можна виділити таку її частинку, де перебування електрону найбільш ймовірне. Цю область простору називають орбіталлю.
Розв’язок хвильового рівняння дає нескінченне число значень функцій ψ (ψ1, ψ2, ψ3 … ψn), з яких потрібно вибрати такі, які дійсні, скінченні і відповідають цілком певним значенням енергії Е1, Е2, Е3…Еn. Кожний з вибраних таким чином розв’язків відповідає певній орбіталі. Найважливіші характеристики орбіталей (енергія, форма, розміщення в просторі) визначаються квантовими числами, які вводяться при розв’язанні хвильового рівняння.
Головне квантове число n – характеризує рівень енергії у полі ядра і відстань цього рівня від ядра. Для атома водню: Е = -13,6 (1/n2) еВ.
Головне квантове число приймає значення цілих чисел: n = 1, 2, 3, 4...![]() (від одиниці до нескінченності, що відповідає стану йонізації, тобто відриву електрона від атома). Його позначають також літерами, наприклад: n = 1(К), n = 2(L), n = 3(М), n = 4(N), n = 5(О), n = 6(Р).
(від одиниці до нескінченності, що відповідає стану йонізації, тобто відриву електрона від атома). Його позначають також літерами, наприклад: n = 1(К), n = 2(L), n = 3(М), n = 4(N), n = 5(О), n = 6(Р).
Побічне, орбітальне або азимутальне квантове число l визначає енергію енергетичного підрівня, характеризує форму орбіталі (азимутальне, від арабського "аз мутус" – шлях, траєкторія руху). Приймає значення від 0 до
(n – 1). Має такі літерні позначення:
|
l |
0 |
1 |
2 |
3 |
4 |
|
|
s |
p |
d |
f |
g |
(зі спектроскопії: s (sharp) – різкий; р (principal) – головний; d (diffuse) – дифузний; f (fundamental) – фундаментальний.
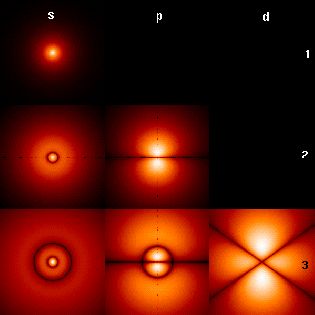
s-орбіталь має форму кулі, р-орбіталь – гантелеподібну, d-орбіталь має вигляд чотирьох об'ємних пелюстків, f-орбіталь – шість пелюсток (рис. 2.3 а, б).
Магнітне квантове число ml – характеризує орієнтацію орбіталі у магнітному полі на даному енергетичному підрівні (момент імпульсу є вектором) або просторове розміщення орбіталей відносно магнітної осі атома і приймає значення: від +l через 0 до -l; або ml визначає значення проекції орбітального моменту кількості руху (М) на виділений напрямок (наприклад, на вісь z): Mz=(h/2π)ml
Число орбіталей з даним значенням l може бути (2l+1).
|
Орбітальне квантове число l |
Магнітне квантове число ml |
Кількість орбіталей з даним значенням l |
|
0 |
0 |
1 |
|
1 |
1; 0; -1 |
3 |
|
2 |
2; 1; 0; -1; -2 |
5 |
|
3 |
3; 2; 1; 0; -1; -2; -3 |
7 |
Орбіталі з однаковою енергією називаються виродженими. Наприклад, р – стан вироджений тричі. Загальне число орбіталей даного енергетичного рівня дорівнює n2.
Таким чином, енергетичні рівні (оболонки), які характеризуються головним квантовим числом n, розщепляються на енергетичні підрівні, що характеризуються орбітальним квантовим числом l. Кожний підрівень складається з певної кількості орбіталей, їх число (2l + 1). Число електронів на кожній орбіталі визначається формулою 2(2l + 1). Наприклад:
|
Головне квантове число, n |
Орбітальне квантове число, l |
Число орбіталей на енерг. підрівні,
|
Число орбіталей на енергет. рівні, n2 |
Число електронів на енерг. підрівні,
|
Число електронів на енерг. рівні,
|
|
1 |
0 (s) |
1 |
1 |
2 |
2 |
|
2 |
0 (s) 1 (p) |
1 3 |
4 |
2 6 |
8 |
|
3 |
0 (s) 1 (p) 2 (d) |
1 3 5 |
9 |
2 6 10 |
18 |
|
4 |
0 (s) 1 (p) 2 (d) 3 (f) |
1 3 5 7 |
16 |
2 6 10 14 |
32 |
|
|
|
|
а |
б |
|
а – просторова орієнтація орбіталей, б – форма орбіталей |
|
|
Рисунок 2.3 – Форма і просторова орієнтація s-, p-, d- орбіталей |
|
Спінове квантове число ms – характеризує обертання електрона навколо власної вісі. Воно має два значення:+1/2 і -1/2 (рисунок 2.4).

Рисунок 2.4 – Обертання електрона навколо своєї вісі
Крім квантово-механічного уявлення про будову атому, існує інша сучасна теорія викладена в роботах польського вченого Михайла Гризінського, де електрон розглядається лише як частинка, а не як частинка і хвилька одночасно, згідно уявлення про двоїсту природу електрону. Крім того електрони в атомі рухаються по радіальних траєкторіях по відношенню до ядра, тобто електрони ніби падають на ядро, але в останню мить відштовхуються від нього за рахунок відштовхування магнітних полів ядра і електрону і тому не взаємодіють з ядром, а також ця теорія містить багато інших уявлень відмінних від квантової механіки (рисунок 2.5).
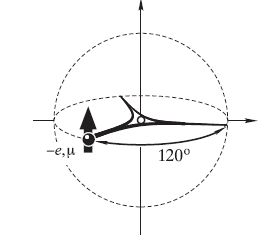
Рисунок 2.5 – Модель руху електрону по радіальній траєкторії в атомі водню
2.2 Атомні орбіталі і принципи їх заповнення електронами
Атомна орбіталь характеризує ту частину простору навколо ядра, у якому найбільш вірогідне знаходження електрона.
В 1925 році В. Паулі формулює найважливіший принцип: "В атомі не може бути навіть двох електронів, які мають однакове значення усіх квантових чисел". Будь-які два електрони повинні відрізнятися хоча б значенням одного квантового числа. Це означає, що на одній орбіталі може знаходитися лише два електрони.
Порядок заповнення орбіталей підкоряється, правилам Гунда (Хунда) і В.М. Клечковського. В основі цих правил лежить принцип послідовного заповнення АО в міру зростання енергії.
Правило Гунда: Електрони даного енергетичного підрівня прагнуть зайняти максимальне число АО (енергетичних місць), щоб спінове квантове число було максимальним.
Наприклад, при заселенні еквівалентних орбіталей (рх, ру, рz) меншій енергії відповідає паралельне розташування спінів (випадок (а), але не (б)):
|
Σms=3∙(±1/2) = ±3/2 |
Σms= ±1/2 |
|
(а) |
(б) |
Правила В.М. Клечковського: АО заповнюються електронами у порядку послідовного зростання суми квантових чисел (n+l) – перше правило; при однакових значень суми (n+l) спочатку заповнюються АО з меншим значенням n, тобто у порядку послідовного збільшення головного квантового числа - друге правило.
Наприклад:
|
1s |
n=1 |
l=0 |
n+l=1 |
6s |
n=6 |
l=0 |
n+l=6 |
|
2s |
n=2 |
l=0 |
n+l=2 |
4f |
n=4 |
l=3 |
n+l=7 |
|
2p |
n=2 |
l=1 |
n+l=3 |
5d |
n=5 |
l=2 |
n+l=7 |
|
3s |
n=3 |
l=0 |
n+l=3 |
6р |
n=6 |
l=1 |
n+l=7 |
|
3p |
n=3 |
l=1 |
n+l=4 |
7s |
n=7 |
l=0 |
n+l=7 |
|
4s |
n=4 |
l=0 |
n+l=4 |
5f |
n=5 |
l=3 |
n+l=8 |
|
3d |
n=3 |
l=2 |
n+l=5 |
6d |
n=6 |
l=2 |
n+l=8 |
|
4p |
n=4 |
l=1 |
n+l=5 |
7p |
n=7 |
l=1 |
n+l=8 |
|
5s |
n=5 |
l=0 |
n+l=5 |
|
|
|
|
|
4d |
n=4 |
l=2 |
n+l=6 |
|
|
|
|
|
5p |
n=5 |
l=1 |
n+l=6 |
|
|
|
|
Таким чином, заповнення АО відбувається в порядку зростання їх енергії:
1s< 2s< 2p< 3s< 3p< 4s < 3d< 4p< 5s < 4d< 5p< 6s < 4f ≤ 5d< 6p< 7s< 5f≈6d<7p.
Електронні формули елементів
Розміщення електронів на енергетичних рівнях і підрівнях називається електронною конфігурацією. Запис електронних конфігурацій (електронних формул) здійснюють таким чином: вказують значення головного квантового числа, потім – літерами s, p, d, f – значення орбітального квантового числа, а зверху справа над літерою – число електронів на даному підрівні. Наприклад, запис 2р4 означає, що на другому енергетичному рівні на р-підрівні знаходиться чотири електрони. Послідовність заповнення електронами орбіталей різних енергетичних рівнів можна уявити наступним чином:
1 s2 2s2 2p6 3s2 Зр6 4s2 3d10 4р6 5s2 4d10 5p6 6s2 5d1 4f14 5d9 6p6 7s2 6d1 5f14 6d9.
При складанні електронних формул користуються наступним алгоритмом:
- число електронів, які розташовуються на енергетичних рівнях атому дорівнює заряду ядра і, відповідно, порядковому номеру елементу. Наприклад, число електронів, які розташовані на енергетичних рівнях Алюмінію дорівнює 13, адже заряд ядра і порядковий номер алюмінію 13;
- внутрішні енергетичні підрівні, які розташовані ближче до ядра, заповнюються максимально для них можливим числом електронів, а зовнішні енергетичні підрівні можуть бути незавершеними;
- зовнішній рівень, який буде не заповнений до кінця, можна визначити за номером періоду. Якщо елемент розташований у 4 періоді, то підрівні 4 рівня (4s, 3d, 4р) можуть бути незавершеними. Наприклад, для Алюмінію маємо 1s22s22p63s23р1 (1s, 2s, 2p, в даному випадку внутрішні енергетичні рівні, заповнені повністю; останній 13-ий електрон знаходиться на незаповненому повністю зовнішньому енергетичному рівні).
Важливе значення мають валентні електрони, які приймають участь в утворенні хімічних зв'язків. Як правило, це електрони або тільки зовнішнього рівня, що заповнюється, або електрони зовнішнього і передзовнішнього рівня (d), якщо передзовнішній рівень не заповнений повністю. Наприклад, у розглянутому випадку з Алюмінієм +13Al 1s22s22p63s23р1, валентними є електрони зовнішнього рівня 3s23р1, оскільки передзовнішні рівні повністю заповнені. Для Феруму маємо електронну формулу +26Fe 1s22s22p63s23р64s23d6, валентними будуть електрони зовнішнього підрівня 4s2 та передзовнішнього 3d6, оскільки він неповністю заповнений.
За електронною формулою валентних електронів атома даного елемента, можна визначити до якої родини елементів (s, р, d, f) він відноситься, оскільки у s-, р-, d-, f-елементів добудовуються відповідно s-, р-,d-, f- АО.
Наприклад: 4s23d5 – це елемент 4-го періоду, 7-ої групи (2+5), d-елемент (тому що забудовується d-підрівень), Манган (Мn).
2.3 Зв'язок між електронною будовою атомів і хімічними властивостями елементів
Електронна будова атомів дає можливість охарактеризувати властивості елементів та їх сполук: положення в періодичній системі, метал чи неметал, ступінь окиснення, кислотно-основні властивості оксидів, формули відповідних кислот, гідроксидів, амфолітів.
Максимальна цифра перед s-електронами вказує на номер періоду; сума валентних електронів визначає номер групи. До головної підгрупи
(А-групи) належать елементи, у яких валентними електронами є s- і
р-електрони, ці елементи називають s- і р-елементами відповідно. Формули валентних електронів для елементів А-груп: ns1-2 або ns2np1-6. До побічної
(В-групи) належать d- і f-елементи. Їх валентні електрони: ns0-2 (n-1)d1-10. У
f-елементів в утворенні хімічних зв'язків можуть брати участь і f-електрони.
До металів відносяться усі s-елементи, крім Гідрогену і Гелію, d- і
f-елементи, а також деякі р-елементів (III А-група). Атоми металів містять на зовнішньому рівні від 1 до 3 електронів.
До неметалів відносяться р-елементи, у яких на зовнішньому енергетичному підрівні міститься 5 – 8 електронів.
Метали мають лише позитивний ступінь окиснення, неметали і металоїди – негативний, який можна обчислити таким чином: номер групи мінус 8. Наприклад, номер групи дорівнює 6, звідси: 6-8= -2, (ст.ок. S в Н2S).
Під час утворення позитивних йонів із р-елементів, спочатку елемент втрачає р-електрони, потім s-електрони, потім d-електрони із пар, а потім – неспарені.
Наприклад: 5s2 5p3 (Sb°, 5 період, V група):
|
Sb° 5s2 5p3
|
|
Sb+3 5s2 5p°
|
|
Fe° 4s2 3d6
|
|
Fe+3 4s°3d5
|
Приклад 2.1 Охарактеризувати властивості елементу, для якого z = 25.
Рішення:
Повна електронна формула цього елементу 1s22s22p63s2Зр64s23d5.
Валентні електрони 4s23d5, отже це елемент 4 періоду, VII В-групи,
d-елемент, манган (Mn), метал, максимальний ступінь окиснення +7, оксид Mn2O7, кислотного характеру, якому відповідає кислота HMnО4.
Приклад 2.2 Охарактеризувати властивості елементу, для якого z = 16.
Рішення:
Повна електронна формула цього елементу 1s22s22p63s2Зр4.
Валентні електрони 3s23р4, отже – це елемент 3 періоду, VI А-групи,
р-елемент, Сульфур (S), неметал, максимальний ступінь окиснення – +6, мінімальний – -2; оксид SO3, кислотного характеру, якому відповідає кислота H2SO4, гідрид – H2S.
2.4 Періодичний закон і періодична система елементів
Попередники Д.І. Менделєєва здійснювали спробу провести класифікацію хімічних елементів: І. Деберейнер (1817 – 1829 рр.) встановив правило тріад; Дж. Ньюленд (1863 р.) – закон октав; А. де Шанкуртуа запропонував земну спіраль (1862 р.), у якій подібні елементи виявилися у багатьох випадках розміщеними один під одним на спіральних витках; Л. Мейер, практично одночасно з Д.І. Менделєєвим запропонував таблицю, подібну до таблиці Менделєєва. Однак, попередники Д.І. Менделєєва шукали лише очевидної подібності між елементами, не допускаючи думок про об'єднання (в періоди) таких не схожих елементів, як Натрій і Хлор.
Д.І. Менделєєв відкрив один із фундаментальних законів природи –періодичний закон (1869 р.), який дозволив створити не просто таблицю, а єдину систему елементів: "властивості елементів і їх сполук знаходяться у періодичній залежності від їх атомних мас".
Порядковий номер елемента є його фундаментальною характеристикою. Те ж саме можна сказати і про заряд ядра, оскільки його величина чисельно дорівнює порядковому номеру. Ядро – основа атома, яка визначає особливість елементів. До складу ядер усіх атомів, крім легкого ізотопу Гідрогену (Протію), входять протони і нейтрони (нуклони). Відомості про деякі елементарні частинки наведено в таблиці 2.1.
Маса атома практично дорівнює масі ядра – сумі мас протонів і нейтронів (маса електрона мала).
Ізотопи (від грец. “ізос” – однаковий, “топос” – місце) – це різновид атомів одного й того ж елементу з однаковим зарядом ядра або порядковим номером (z), але з різними масовими числами. У періодичній системі елементів вони займають одне й теж місце. Наприклад: ![]() і
і ![]() , де z = 17 (по 17 протонів), але 35 – 17 = 18 і 37 – 17 = 20 нейтронів.
, де z = 17 (по 17 протонів), але 35 – 17 = 18 і 37 – 17 = 20 нейтронів.
А = Z + N, де А – масове число (а.о.м.), z – порядковий номер або число протонів і N – кількість нейтронів.
Таблиця 2.1 – Характеристика елементарних частинок
|
частинка |
символ |
маса спокою |
заряд Кл/cgse |
|
|
г |
а.о.м. |
|||
|
Протон |
р |
1,679·10-24 |
1,007276 |
1,602·10-19/4,809·10-10 |
|
Нейтрон |
n |
1,675·10-24 |
1,008665 |
0/0 |
|
Електрон |
|
9,108·10-28 |
0,000549 |
1,602·10-19/ 4,803·10-10 |
Ізобари (від грец. “барос” – важкий) – різновид атомів з однаковими масовими числами, але з різним порядковим номером або зарядом ядра (z). Наприклад:![]() .
.
Таким чином, з відкриттям ізобарів виникла необхідність у новому формулюванні періодичного закону: "властивості елементів та їхніх сполук перебувають у періодичній залежності від заряду ядра атома (порядкового номера)".
Ізотони – це різновидність атомів з однаковим числом нейтронів. Наприклад:
|
|
(p-54, n-82) |
|
|
(p-56, n-82 ) |
|
|
(p-57, n-82) |
Розташування елементів у певному порядку називається періодичною системою, яка є графічним вираженням періодичного закону.
Відомо багато форм періодичної системи (понад 400), проте найважливіша – це коротка форма, запропонована Д.І. Менделєєвим, яка після вдосконалення є найпоширенішою до останнього часу. У такій формі періодична система включає всі відомі елементи і має місце для невідкритих елементів.
Основними структурними одиницями періодичної системи є періоди і групи.
Період – це горизонтальний ряд, в якому елементи розміщені в порядку зростання атомних мас (порядкового номера). Номер періоду співпадає із значенням головного квантового числа n зовнішнього енергетичного рівня. Усі періоди, окрім першого, попарно містять однакове число (X) елементів, яке можна визначити за формулами В. М. Клечковського:
|
Непарний період |
Парний період |
|
X = 0,5(n+1)2 |
X = 0,5(n+2)2 |
|
n=1, 3, 5, 7 |
n =2, 4, 6 |
Наприклад, якщо n = 3, то X = 0,5∙(3 + 1)2 = 8 елементів; якщо n = 4, то X = 0,5∙(4 + 2)2 = 18 елементів і т.д.
Всього є сім періодів. Кожен період, крім першого, починається з лужного металу і закінчується благородним газом. Перший період найкоротший і має два елементи: Гідроген і Гелій. Другий і третій періоди містять по вісім елементів. Усі три періоди називаються малими періодами. Четвертий і п’ятий великі періоди містять по 18, а шостий – 32 елементи. Останній сьомий період – незавершений.
У малих періодах зі збільшенням порядкового номера спостерігається поступове зменшення металічних і посилення неметалічних властивостей. Для елементів великих періодів ця закономірність дещо ускладнюється. Наприклад, у п’ятому періоді, починаючи з Rb, металічні властивості послаблюються і досягають мінімуму у таких металів як Ru, Rh, Pd. Однак, починаючи із Cd (у якого металічні властивості стрибкоподібно зростають) з ростом порядкового номера повторюється зміна властивостей елементів, характерна для малих періодів: поступовий і закономірний перехід металічних властивостей у неметалічні і закінчується період благородним газом.
Такі зміни властивостей елементів в періодах із ростом порядкового номера можна пояснити наступним чином: оскільки у s- і р-елементів забудовується зовнішній електронний рівень, у d-елементів – передзовнішній, а у f-елементів – третій ззовні, то відмінність у властивостях найбільш різко проявляється у сусідніх s (р)-елементів. У d- і, особливо, у f-елементів одного й того ж періоду різниця у властивостях проявляється менш помітно.
d- і f-елементи одного періоду об'єднуються у родини. В 4 – 6 періодах у родини з 10 елементів об'єднуються d-елементи. Це родини 3d- (Sc – Zn),
4d- (Y – Cd) і 5d- (La, Hf – Hg ) елементів. В 6 і 7-му періодах у родини з 14 елементів об'єднуються f-елементи, це родини: 4f-елементів (Се – Lu), які називаються лантаноїдами та родина 5f-елементів (Th – Lr) – актиноїди.
Групи і підгрупи. Якщо головне квантове число n визначає положення елемента в періоді, то орбітальне l, разом із магнітним ml і спіновим ms квантовими числами визначає положення елемента у відповідній групі періодичної системи.
У відповідності до максимального числа електронів на зовнішньому енергетичному рівні атомів у не збудженому стані, елементи періодичної системи поділяють на вісім груп. Положення в групах s- і р-елементів визначається загальним числом електронів зовнішнього квантового рівня. Так, s-елементи утворюють І і ІІ групи; р-елементи – ІІІ – VIII (сума s + р). Наприклад:
|
Р |
3s23p3 |
– 3 період, V група; |
|
Mg |
3s2 |
– 3 період, II група; |
|
Ar |
3s23p6 |
– 3 період, VIII група та ін. |
Положення в групах d-елементів зумовлюється загальним числом
s-електронів зовнішнього і d-електронів передостаннього рівнів, за цією ознакою перші шість елементів кожної родини d-елементів розміщуються в одній із відповідних груп: Sc (4s23d1) – у III групі; Mn (4s23d5) – у VII групі; Fe (4s23d6) – у VIII групі; Zn (4s23d10) – у якого забудований d-підрівень і зовнішніми є 4s2 електрони, належить до II групи.
Через присутність на зовнішньому енергетичному рівні лише одного електрону (за рахунок "провалу" одного із s-електронів на d-підрівень) такі елементи як Cu (4s13d10), Ag (5s14d10), Au (6s15d10) належать до I групи. Тоді як Co (4s23d7), Ni (4s23d8), Rh (5s13d8), Pd (5s°4d10), Ir (6s25d7), Pt (6s15d9) разом з Fe, Ru і Os – до VIII групи (так звані тріади перехідних d-елементів).
Враховуючи особливості електронних структур елементів, родину лантаноїдів (4f-елементи) і актиноїдів (5f-елементи) розміщують у ІІІ групі.
В підгрупу типових елементів виділяють елементи малих періодів (без поділу на головну та побічну). В останньому випадку, згідно з Б.В. Некрасовим, елементи кожної групи поділяють на три підгрупи: типові елементи і дві підгрупи, складені із елементів великих періодів.
Наприклад, IV група періодичної системи елементів складаються із наступних трьох підгруп:
|
Типові елементи |
Елементи підгрупи германію |
Елементи підгрупи титану |
|
С Is22s22p2 |
Ge 3d104s24p2 |
Ті 4s23d2 |
|
Si 3s23p2 |
Sn 4d105s25p2 |
Zr 5s24d2 |
|
|
Pb 5d106s26p2 |
Hf 6s25d2 |
Електронні аналоги – це елементи, у яких валентні електрони розміщені на орбіталях, що описуються загальною для усіх елементів формулою. У періодичній системі елементів електронні аналоги входять до складу однієї підгрупи.
Таким чином, структура періодичної системи Д.І. Менделєєва визначається будовою атомів. Вона складається із восьми груп і семи періодів.
У 1 – 3 періодах (малі періоди) знаходяться типові елементи (див.вище).
4 – 7 періоди складаються із двох рядів: парного і непарного (для короткої форми таблиці). Послідовність розміщення елементів в 2 – 7 періодах така:
2 період: два s-елементи Li (2s1), Be (2s2) і шість р-елементів: B (2s22p1)…..F 2s22p5, Ne 2s22p6;
3 період: два s-елементи Na (3s1), Mg (3s2) і шість р-елементів: Al (3s23p1)…..Cl (3s23p5), Ar (3s23p6);
4 період: два s-елементи: K (4s1), Ca (4s2), десять d-елементів: Sc (4s23d1)...Zn (4s23d10) і шість р-елементів (див. період. систему);
5 період побудований аналогічно 4-му періоду;
6 період: два s-елементи: Cs (6s1); Ba (6s2); один d-елемент La (6s25d1); чотирнадцять f-елементів: Се…Lu, дев’ять d-елементів: Hf (6s25d2)... (6s26d10) і шість р-елементів Тl (6s26p1)…..At (6s26p5), Rn (6s26p6);
7 період – неповний, він повторює структуру 6-го періоду. До нього належить родина актиноїдів (f-елементи).
Отже, перший період містить 2 елементи; 2 і 3 – по вісім елементів; 4 і 5 періоди – по 18 елементів; 6 період – 32 елементи; 7 період – 25 елементів (незавершений).
2.5 Основні параметри, які визначають властивості елементів
Властивості елементів визначаються електронною будовою атомів, радіусами атома і йона (rат, rйона), енергіями йонізації і спорідненості до електрона. Останні два показники кількісно характеризують здатність атомів приймати або віддавати електрони (їх окисно-відновну активність або металічні і неметалічні властивості).
Енергія йонізації (І) – кількість енергії (кДж/моль або еВ/атом), яка необхідна для відщеплення електрону від атома у незбудженому стані з перетворенням його у позитивно заряджений йон.
Енергія йонізації у електрон-вольтах на атом чисельно дорівнює потенціалам йонізації у вольтах (В).
Для багатоелектронних атомів значення І1, І2, .... Іn відповідає відриву першого, другого, третього і n-електрона. При цьому завжди І1< І2< І3.... Іn (зростає позитивний заряд йону, що утворюється).
Енергія йонізації визначає міцність зв'язку електронів з ядром, на яку впливають три основні фактори:
а) ефект екранування внутрішніх енергетичних підрівнів (послаблює зв'язок зовнішніх електронів з ядром); чим більше внутрішніх енергетичних рівнів, тим більше ефект екранування;
б) ефект проникнення – згідно з квантовою механікою, усі електрони (навіть зовнішні) певний час можуть знаходитися в просторі, близькому до ядра, що збільшує міцність зв'язку зовнішніх електронів з ядром; найбільшу проникаючу здатність мають s-електрони ( s > р > d);
в) взаємне відштовхування електронів одного й того ж енергетичного рівня, особливо, однієї й тієї ж АО.
Енергія йонізації залежить від заряду ядра (z), rат, rйона та електронної будови атома. Чим більше rат, rйона, тим менша енергія йонізації. Зі збільшенням z у межах одного періоду енергія йонізації збільшується. Чим менша енергія йонізації, тим більша відновлювальна активність елементу (яскравіше виражені його металічні властивості).
Внаслідок ефекту екранування у А-групах енергія йонізації зменшується зверху вниз, тоді як у В-групах – зростає (наприклад, V-В: Ванадій, Ніобій, Тантал), оскільки 6 s-електрони Танталу потрапляють під подвійний екран 5d- і 4f-електронів. Тому енергія йонізації для елементів V-А і V-B-груп закономірно змінюються:
|
5A |
As 9,81 |
5B |
V 6,74 |
|
|
Sb 8,64 |
|
Nb 6,88 |
|
|
Bi 7,29 |
|
Та 7,88 |
Електроспорідненість йонів – різниця між потенціалом йонізації І і теплотою гідратації L йонів при їх розчиненні: K = I – L.
Потенціал йонізації дорівнює енергії, яка необхідна для відриву електрона від атома під час утворення йона. Теплота гідратації (сольватації) L описує енергію гідратації йона. Різниця потенціалу йонізації і енергії гідратації характеризує здатність йона до утворення ковалентного зв'язку. При утворенні, наприклад, комплексних сполук і осадів, відбувається спочатку дегідратація йона, потім заповнення його вакантних орбіталей електронами, тобто процес, у деякій мірі зворотний гідратації і йонізації. Чим більша різниця між енергією йонізації та енергією гідратації, тим кращою є здатність йонів до асоціації або утворення хімічних сполук.
Ковалентна характеристика катіонів (К) у водних розчинах пов'язана з їх відношенням до сильно поляризованих аніонів, наприклад S![]() , РО
, РО![]() , СгО
, СгО![]() та ін., з якими вони можуть утворювати осади. За величиною К катіони можна поділити на декілька груп (таблиця 2.2).
та ін., з якими вони можуть утворювати осади. За величиною К катіони можна поділити на декілька груп (таблиця 2.2).
Сульфіди катіонів з малим значенням К розчинні у воді, або розкладаються до гідроксидів; катіони з середнім К – нерозчинні у воді, розчинні в НСl; катіони з великим К – нерозчинні у кислотах.
Таблиця 2.2 – Класифікація катіонів за ковалентною характеристикою
|
Заряд |
Значення К і група катіонів |
||
|
йона |
невелике |
середнє |
велике |
|
1+ |
< 126 (Na+, K+) |
– |
>126 (Cu+, Ag+) |
|
2+ |
<294 (Ва2+, Sr2+ Са2+, Mg2+) |
294 - 550 (Mn2+, Fe2+, Co2+, Ni2+) |
>550 (Cu2+, Cd2+, Hg2+ Pb2+) |
|
3+ |
<760 (Аl3+, Сг3+) |
760…970 (Fe3+) |
>970 (Вi3+, As3+, Sb3+, Sn4+) |
Енергія спорідненості до електрону (Е) – це енергетичний ефект процесу приєднання електрону до нейтрального атома з перетворенням його в негативно заряджений йон: Є° + ![]() = Є– ± Е
= Є– ± Е
Ця енергія чисельно дорівнює енергії йонізації, але протилежна їй за знаком.
Найбільше значення енергії спорідненості до електрона мають
р-елементи VI-А, VII-А груп. Мінімальну і, навіть, від’ємну спорідненість до електрона мають атоми з електронною конфігурацією: s2, s2p6, p3.
Якщо дія сили тяжіння ядерного поля на електрон сильніша, ніж сили відштовхування від інших електронів, то спостерігається екзоефект. Величини Е відомі лише для невеликого числа елементів, оскільки пряме їх визначення пов'язане з великими труднощами.
Якщо приєднання першого електрона для низки елементів є процесом екзотермічним, то приєднання другого електрона завжди є ендотермічним процесом. Це означає, що згідно з квантово-механічними розрахунками, неможливе приєднання двох або трьох електронів до атома. Тому прості одноатомні багатозарядні йони типу О2-, S2-, N3- та ін. у вільному стані існувати не можуть. Тому, запис формули, наприклад, Сu2+О2- є приблизним і умовним. Чим більше Е, тим більша окиснювальна активність елемента (неметалічні властивості).
Електронегативність (ЕН) – це поняття, яке дозволяє оцінити здатність атому одного елемента відтягувати на себе електронну густину порівняно з атомами інших елементів сполуки.
За пропозицією І. Маллікена ЕН можна визначити так: ![]() .
.
Існує більш ніж 20 шкал ЕН, хоча відносне розміщення елементів у ряду ЕН приблизно однакове. Полінг ввів відносну шкалу ЕН, взявши за одиницю порівняння електронегативність Літію. Тоді відносна електронегативність (ВЕН) Флуору дорівнює 4,0. Нижче наведено ВЕН для деяких елементів:
|
Н 2,1 |
Li 1,0 |
С 2,5 |
N 3,07 |
О 3,5 |
F 4,0 |
|
|
Na 0,9 |
Si 2,1 |
Р 2,06 |
S 2,5 |
Сl 3,0 |
|
|
К 0,8 |
Ge 1,7 |
|
|
Вr 2,8 |
EH – величина непостійна, залежить від валентного стану, типу сполуки і від іншого компоненту.
Атомні та йонні радіуси – величини умовні (внаслідок хвильового характеру електронів rат, rйона), їх обчислюють виходячи із атомних відстаней (при вивченні будови молекул, кристалів), які залежать від природи атомів, характеру зв'язку між ними, агрегатного стану речовини. Тому мають на увазі так звані ефективні радіуси. Зміна rат, rйона у періодичній системі носить періодичний характер. У періодах rат, rйона зменшуються (більш помітно у малих періодах). У s- і р-елементів – значніше, ніж у d- і f-елементів (внаслідок d- і f - стиснення). У групах – rат збільшується, особливо у s- і р-елементів, rат, d-елементів 5 – 6 періодів приблизно однакові, внаслідок f-стиснення.
Наприклад:
|
р-елементи |
d-елементи |
||||
|
|
Z |
r, |
|
Z |
r, |
|
As |
33 |
1,48 |
V |
23 |
1,34 |
|
Sb |
51 |
1,61 |
Nb |
41 |
1,45 |
|
Bi |
83 |
1,82 |
Та |
73 |
1,46 |
Радіус негативно заряджених йонів у А-групах збільшується зверху вниз, як і радіус атома.
Радіус аніона завжди більший радіуса нейтрального атома, оскільки зі збільшенням числа електронів на кожний із них припадає все менша частка ядерного заряду, і притягання електронів до ядра послаблюється.
Радіус катіона завжди менший ніж радіус нейтрального атома, і чим більший заряд катіона тим менший радіус. У даному випадку більша частка ядерного заряду припадає на кожний електрон, що залишається, таким чином, вони сильніше притягуються до ядра.
Радіус йона має великий вплив на його основні або кислотні властивості. При збільшені радіуса йона основні властивості гідроксидів металів зростають (LiOH→KOH); у гідридів неметалів відбувається збільшення кислотних властивостей (HF→НІ). При збільшенні радіуса послаблюється взаємне притягання йонів металу і гідроксиду, що полегшує процес йонізації і підсилює основні властивості сполуки. Аналогічно при збільшені радіуса зростає здатність галогеноводневих кислот дисоціювати у розчинах на протони і аніони, сила кислот при цьому зростає. Радіус зумовлює здатність йонів до поляризації.
Таким чином, йонні радіуси змінюються у періодах і групах аналогічно атомним, отже, характер їх зміни носить періодичний характер.
У періодичній залежності від порядкового номеру елементів знаходиться дуже багато хімічних і фізичних властивостей елементів та їх сполук: атомні об'єми, температури кипіння і плавлення, питомі теплоємності, магнітні властивості, теплоти утворення сполук, енергії дисоціації та ін.
Види аналогій.
Розрізняють горизонтальну (у періодах), вертикальну (у групах), діагональну і валентну аналогії властивостей елементів. Крім того, є ще так звана вторинна та внутрішня періодичність.
Горизонтальна аналогія: у періодах (2 і 3 малих періодах) відновлювальна активність елементів зменшується, а окиснювальна зростає зліва направо:

Це пов’язано зі зменшенням rат, збільшенням І, Е та числа зовнішніх електронів. У зв'язку з цим спостерігається різка зміна властивостей елементів від металу до неметалу.
У непарних рядах великих періодів властивості елементів змінюються аналогічно: від металу до неметалу; у парних рядах розміщені метали, які мають 1 – 2 електрони на зовнішньому енергетичному рівні (відбувається забудова передостаннього рівня, d-підрівня). Тому в даному випадку не спостерігається різка зміна властивостей, хоча ряд починає активний метал з високою відновлювальною активністю.
Вертикальна аналогія: у головних підгрупах відновлювальна активність зростає, а окиснювальна – зменшується зверху вниз (оскільки зростає rат, зменшуються І, Е) у побічних підгрупах відновлювальна активність зростає у зворотному напрямку (зменшується І). Наприклад:
|
1 A |
|
відновлювальна активність зростає |
7А |
|
окиснювальна активність знижується |
5В |
|
відновлювальна активність зростає |
|
|
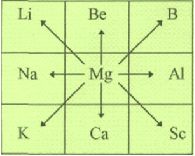
Діагональна аналогія. Д.І. Менделєєв висловив припущення про існування атомної аналогії, яка встановлює закономірність зв'язку властивостей даного елемента з властивостями елементів із сусідніх груп, періодів і діагоналі. Наприклад, Магній певними властивостями подібний до Літію, Берилію, Бору, Натрію, Алюмінію, Калію, Кальцію і Скандію. Глибокий зміст подібної "зірчатості" (термін ввів О.Е. Ферсман) полягає у взаємодії електронної конфігурації атома з його ядром. Розрізняють малу (B-Si, Be-Al) і велику діагональну аналогію ( Ti-Nb, Ca-La). |
Валентна аналогія. Роботи Д.І. Менделєєва, присвячені вдосконаленню періодичної системи, дозволили виявити "подвійні подібні відношення" між елементами: підгрупа елементів Be, Mg, Са, Sr, Ba подібна з підгрупою Zn, Cd, Hg, тобто вони повинні складати одну групу (у даному випадку за валентністю).
Розрізняють також й іншу валентну аналогію, наприклад: Mg![]() Mn2+, К+ і Тl
Mn2+, К+ і Тl![]() , що пояснюється подібністю будови електронних оболонок, близькими значеннями rат i rйона, а також подібними просторовими і електростатичними характеристиками еквізарядних йонів (у кристалічній гратці і у розчині).
, що пояснюється подібністю будови електронних оболонок, близькими значеннями rат i rйона, а також подібними просторовими і електростатичними характеристиками еквізарядних йонів (у кристалічній гратці і у розчині).
На основі теорії будови атомів було встановлено причину періодичної зміни властивостей елементів у системі, а саме: властивості елементів, а також форми і властивості їхніх сполук знаходяться в періодичній залежності від заряду ядер і структури електронної оболонки їх атомів.
Зміна кислотно-основних властивостей: у А-групах основні властивості зростають зверху вниз (наприклад, в І-А, R-OH), кислотна активність також збільшується зверху вниз (наприклад, в VII-А, Н-Hal), що зумовлено збільшенням радіусу йона. Сила безоксигенових кислот збільшується у періодах зліва направо (зі зменшенням заряду En-). Наприклад, НСl як кислота сильніша, ніж H2S.
Сила оксигеновмісних кислот також зростає у цьому напрямку, що пов’язано зі збільшенням заряду Е+. Наприклад, у ряду:
![]() <
< ![]() <
< ![]()
Із загальної формули кислот: ![]() видно, що сила кислот зростає зі збільшенням Е+, m і зменшенням n. Наприклад:
видно, що сила кислот зростає зі збільшенням Е+, m і зменшенням n. Наприклад:
![]() >
> ![]() або
або ![]() >
> ![]() , оскільки зростає Е+ і число m;
, оскільки зростає Е+ і число m;
![]() >
> ![]() або
або ![]() >
> ![]() , оскільки збільшується m і зменшується n.
, оскільки збільшується m і зменшується n.
Вторинна періодичність – це періодична, а не монотонна зміна властивостей елементів та їхніх сполук у межах однієї підгрупи. В межах однієї підгрупи періодично змінюються енергії йонізації, атомні радіуси та інші властивості й характеристики елементів.
Вторинна періодичність найбільш чітко виявляється в зміні ентальпій утворення оксидів елементів ІІІ (E2O3), IV (EO2), V (E2O5) та VI (EO3) головних груп періодичної системи елементів. Дійсно, в кожній підгрупі стійкість вищих оксидів, наприклад у ряду СO2 – SiO2 – GeO2 – SnO2 – PbO2, змінюється періодично. При цьому можна виділити низку більш стійких оксидів-аналогів (SiO2, SnO2) та менш стійких (CO2, GeO2, PbO2) в ряду яких стабільність в цілому зменшується.
Типовим прикладом вторинної періодичності може бути кількість та стійкість оксигеновмісних сполук галогенів. Так, для Флуору не характерне утворення сполук з Оксигеном, а ті, що існують (OF2 та O2F2), нестійкі. Хлор утворює більше число сполук з оксигеном (ClO2 – Cl2O6 – Cl2O7), які стійкі за звичайних умов. Для брому знову не характерне утворення сполук з Оксигеном, а ті, що є (Br2O та BrO2), за звичайних умов розкладаються. Наступний елемент (Йод) знову утворює декілька стійких оксидів (J2O4, J2O5, J4O9). Отже здатність до утворення сполук з Оксигеном у підгрупі галогенів змінюється не монотонно, а періодично.
Внутрішня періодичність полягає в тому, що властивості елементів та їхніх сполук у горизонтальних рядах змінюються не монотонно, а періодично. Для великих періодів внутрішня періодичність виявляється в деякому посиленні металічних властивостей в середині періоду на фоні загального їх послаблення. При цьому максимальна металевість у середині періоду припадає на елементи однієї групи: Cu, Ag, Au. Така періодичність дозволила розділити великі періоди на ряди. Внутрішня періодичність зумовлена особливістю заповнення електронами орбіталей. Оскільки d- і f-орбіталі є внутрішніми, то їх заповнення призводить до екранування зовнішніх електронних оболонок від ядра і відповідно до зменшення розмірів атомів (d-, f-стиснення), що і викликає немонотонну зміну властивостей елементів у підгрупах зверху вниз.
Контрольні питання
- Розвиток уявлення про будову атома в роботах вчених ХІХ століття.
- Рівняння Луї де Бройля. Двоїста природа електрону.
- Принцип невизначеності Гейзенберга. Висновки.
- Квантово-механічна модель атома. Що таке атомна орбіталь (АО)?
- Квантові числа і їх простіша інтерпретація.
- Яке значення набувають квантові числа l, ml, ms, якщо n = 3? n = 4?
- Принцип Паулі і правило Хунда (Гунда). Вказати, чому дорівнює Σms, якщо орбіталі характеризуються такою кількістю електронів: s2, p3, d6?
- Правила В. Клечковського. Записати порядок заселення рівнів і підрівнів, якщо сума n + l = 5.
- За якими формулами обчислюється ємність рівнів і підрівнів?
- Поясніть, яка максимальна кількість елетронів може бути на р-підрівні?
- Дайте визначення енергія йонізації та енергія спорідненості до електрону.
- Електронегативність. Відносна електронегативність. Поясніть, як змінюються ці величини в періодах і групах?
- Наведіть короткі відомості про види аналогій, які характерні для періодичної системи елементів.